Florian Kopper, Kiel
Probleme bei der medikamentösen Therapie
Während Patienten, die an einem idiopathischen M. Parkinson erkrankt sind, in den ersten Jahren der Erkrankung gut von der Behandlung mit Levodopa oder Dopamin-Agonisten profitieren und im Alltag dank der guten Wirksamkeit der Präparate kaum eingeschränkt sind, wird die Behandlung nach mehreren Jahren dopaminerger Therapie immer schwieriger. Zu den ursprünglichen akinetischen Symptomen zum Teil mit Ruhe- und Haltetremor treten mit den Jahren der Behandlung oft schwer einstellbare motorische Fluktuationen und Dyskinesien hinzu. Die therapeutische Breite zwischen hypokinetischen Zuständen („Off“) und Phasen guter Beweglichkeit („On“) mit Levodopa-induzierten Nebenwirkungen wie Dyskinesien und Psychosen wird immer schmaler. Ein zufriedenstellender Beweglichkeitszustand wird im Tagesverlauf nur noch selten erreicht, da akinetische Zustände oft übergangslos von massiven Dyskinesien abgelöst werden. Die Vorhersagbarkeit der Arzneimittelwirkung wird für den Patienten immer unsicherer, sodass die Planung der Verrichtung der Alltagstätigkeiten im Verlauf nahezu unmöglich wird. Die modernen oral verfügbaren Agonisten und Inhibitoren des Dopamin-Metabolismus helfen, dieses Stadium der Erkrankung um einige Jahre hinauszuzögern. Doch mit fortschreitender Degeneration der nigrostriatalen Neuronen stößt auch dieses Behandlungsprinzip an seine Grenzen, insbesondere wenn psychiatrische Nebenwirkungen die Behandlung limitieren.
Pathologische Basalganglienaktivität
Als Folge der Degeneration der nigrostriatalen Neuronen stellt sich in den Basalganglien ein Ungleichgewicht zwischen exzitatorischen und inhibitorischen Neuronen ein. Eine besondere Rolle kommt hierbei dem Nucleus subthalamicus zu. Einzelzellableitungen und Untersuchungen des Gehirnstoffwechsels im Tiermodell der Parkinson-Krankheit haben gezeigt, dass aufgrund des striatalen Dopamin-Mangels im Nucleus subthalamicus abnorm hohe neuronale Entladungsraten vorliegen. Der Nucleus subthalamicus treibt hierbei als einziges exzitatorisches Kerngebiet der Basalganglien den Globus pallidus internus an, der seinerseits die Aktivität des ventrolateralen Thalamus hemmt. Die überschießende Hemmung des ventrolateralen Thalamus und seiner kortikalen Projektionsareale, des prämotorischen und supplementär motorischen Kortex, wird als Ursache der Akinese angesehen. An der Entstehung des Rigors, der posturalen Instabilität und der Gangstörung sind vermutlich auch absteigende Faserverbindungen vom Globus pallidus internus zum Hirnstamm beteiligt. Sowohl tierexperimentell als auch in der klinischen Anwendung konnte gezeigt werden, dass durch Inhibition des Nucleus subthalamicus die thalamische Hemmung reduziert und die akinetisch-rigiden Symptome gebessert werden können.
Zielstruktur Nucleus subthalamicus
Im Tiermodell der Parkinson-Krankheit führen Läsionen des Nucleus subthalamicus (STN) zu einer dramatischen Besserung der Symptome. Läsionen im STN galten jedoch lange wegen der befürchteten ballistischen Nebenwirkungen für Neurochirurgen als undenkbar. Die außerordentlichen Fortschritte im Bereich der Medizintechnik ermöglichten jedoch Ende der 80er Jahre erstmalig tiefe Hirnkerne durch eine chronische Elektrostimulation zu blocken. Hierzu wird eine Stimulationselektrode direkt in den Nucleus subthalamicus eingeführt, welche über kontinuierliche Reizung mit hochfrequenten Impulsen mit der krankhaften Aktivität interferiert und so die überschießende Aktivierung der nachgeschalteten inhibitorischen Kerne reduziert.
Durchführung der tiefen Hirnstimulation
Mit Hilfe der Magnetresonanztomographie ist es heute möglich, die Zielstrukturen, beispielsweise den Nucleus subthalamicus, bildgebend darzustellen. Zusätzlich basiert die Zielpunktidentifikation auf bekannten relativen Lagebeziehungen zu anatomischen Landmarken wie der vorderen und hinteren Kommissur. Nach Definition des Zielpunkts im dreidimensionalen Bilddatensatz wird der Trepanationspunkt so gewählt, dass das resultierende Trajekt keine eloquenten Areale verletzt und blutungsrelevante Strukturen wie Ventrikelwand und Gefäße meidet. Nach Durchführung einer Bohrlochtrepanation in lokaler Anästhesie wird beim wachen Patienten die Sonde unter Ableitung der elektrischen Aktivität der zerebralen Neuronen zum berechneten Zielpunkt vorgeschoben. Anhand der Nervenzellaktivität kann die Lokalisation des Zielkerns bereits prognostiziert werden, letztlich entscheidet jedoch das Ergebnis einer Teststimulation unter Berücksichtigung der gewünschten Effekte und Nebenwirkungen über die Position der permanenten Elektrode (Abb. 1, Abb. 2). In erfahrenen Zentren ist für die Durchführung einer bilateralen Operation mit Bildgebung bis zur Implantation der permanenten Elektrode eine Zeit von etwa acht bis zehn Stunden erforderlich. In der postoperativen Phase werden die Impulsparameter vom behandelnden Neurologen eingestellt und die medikamentöse Behandlung an die neue Situation angepasst. Je nach Patient ist hierfür ein stationärer Aufenthalt von einer bis drei Wochen erforderlich, abhängig vom Allgemeinzustand vor der Operation und der Geschwindigkeit des Ansprechens der Symptome auf die Stimulation.
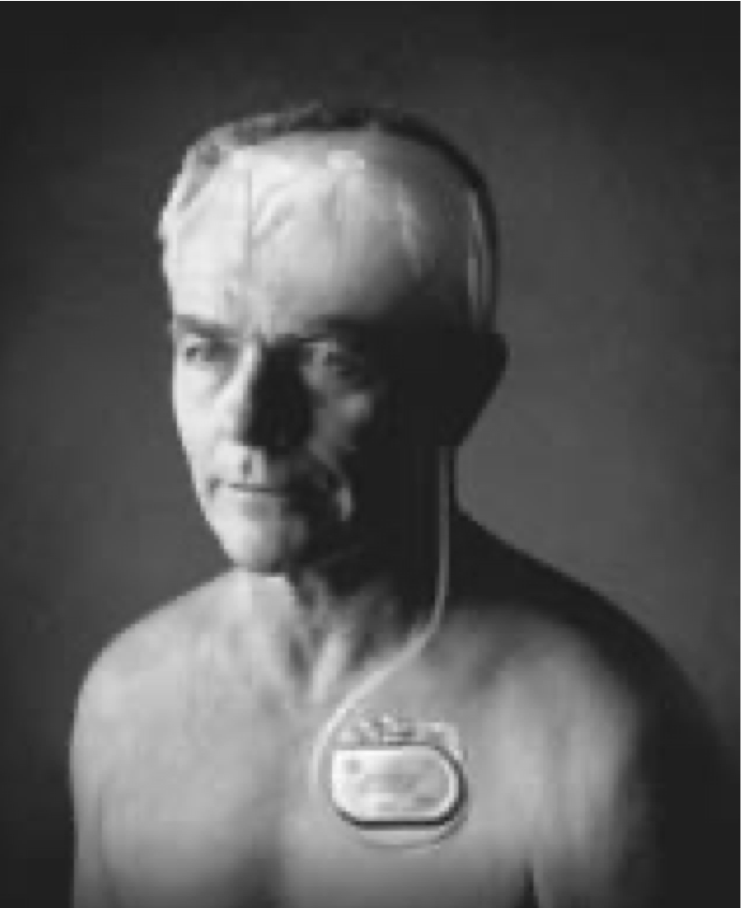
Abb. 1. Lage des implantierten Schrittmachersystems. In Einzelfällen wird der Impulsgenerator aus kosmetischen Gründen im lateralen Oberbauch eingesetzt. Die Verbindungskabel zwischen Stimulationselektroden und Schrittmacher verlaufen subkutan. [Fotos: Medtronic GmbH]

Abb. 2. Stimulationssystem mit Stimulationselektroden, Extensionskabel und Impulsgenerator. Der Impulsgenerator liefert die Energie für beide Stimulationselektroden. Rechts im Bild das für Patienten verfügbare Handprogrammiergerät.
Ergebnisse der tiefen Hirnstimulation
Mehrere Studien haben mittlerweile eine durchschnittlich Reduktion von 40 bis 70 % der motorischen Symptome durch dieses Behandlungsverfahren nachweisen können. Durch die kontinuierliche Stimulation werden darüber hinaus Fluktuationen nahezu vollständig geglättet. Die mittlere Reduktion der Dyskinesien beträgt 80 bis 90 %. Die Linderung der Dyskinesien infolge der Subthalamicus-Stimulation beruht nach heutiger Auffassung hauptsächlich auf einer deutlichen Arzneimittelreduktion; durchschnittlich kann die dopaminerge Therapie um ungefähr 60 % verringert werden. Inwieweit plastisch adaptive Phänomene in den Basalganglien und nachgeschalteten Netzwerken zu einer mittelfristigen Linderung der Dyskinesien beitragen, ist bislang nicht abschließend geklärt. Da die beschriebenen Effekte nicht unmittelbar nach Beginn der Stimulation einsetzen, sollten die Patienten vor dem Eingriff darüber informiert werden, dass mitunter Anpassungen der Stimulationsparameter über Monate erforderlich sind, bis der bestmögliche Stimulationseffekt erreicht wird.
Postoperativer Verlauf
Für die Patienten, die im Alltag massiv aufgrund unvorhersehbarer Wirkfluktuationen und damit verbundener plötzlich einsetzender Phasen der Akinese oder heftiger Dyskinesien beträchtlich eingeschränkt waren, beginnt in den Monaten nach der Operation eine Normalisierung des Tagesablaufs. Aktuelle Studienergebnisse zeigen, dass zwei Jahre nach der Implantation von Stimulationselektroden in den STN eine Reduktion der täglichen Zeit mit schlechter Beweglichkeit von 7,25 auf 2,25 Stunden erfolgt und die Schwere der Dyskinesien um 60 % zurückgeht. Die motorische Verbesserung schlägt sich in einer Verbesserung der Lebensqualität um 62 % für den Patienten selbst und – sozialmedizinisch von besonderer Bedeutung – auch für die Bezugsperson des Patienten um 68 % nieder.
Für den weiteren Verlauf ist es bei akuter Erkrankung wichtig, dass das ärztliche Team vor Ort über das implantierte Neurostimulationssystem informiert ist und so die erforderlichen diagnostischen und therapeutischen Maßnahmen unter der Berücksichtigung der kontraindizierten Verfahren (Diathermie und mit Ausnahmen die Kernspintomographie) auswählen kann. Aus diesem Grunde führen die mit einem Neurostimulationssystem versorgten Patienten einen Schrittmacherausweis mit sich. Bis vor wenigen Jahren waren die Schrittmacher so programmiert, dass mit Hilfe eines speziellen Steuermagneten der Impulsgenerator durch den Patienten selbst ein- oder ausgeschaltet werden konnte. Allerdings konnte auch durch Metalldetektoren an Flughäfen und anderen Personenkontrollen die Stimulationseinheit versehentlich abgeschaltet werden.
Heute sind Handprogrammiergeräte für Patienten erhältlich, die induktiv nicht magnetisch wirken, so dass an der implantierten Stimulationseinheit auf die Magnetfunktion verzichtet und der Stimulator entsprechend umprogrammiert werden kann. In Grenzen ermöglichen diese Programmiergeräte sogar eine Adaptation der Stimulationsparameter durch den Patienten selbst.
Patienten-Selektion
Eine Nucleus-subthalamicus-Stimulation kommt für einen Patienten dann in Betracht, wenn er unter einem idiopathischen Parkinson-Syndrom mit therapierefraktären motorischen Fluktuationen leidet. Auch können Patienten, deren dopaminerge Behandlung durch ausgeprägte Dyskinesien oder psychiatrische Nebenwirkungen limitiert ist, gut von der tiefen Hirnstimulation profitieren. Wichtigstes Kriterium für die Indikationsstellung ist das Ansprechen der Parkinson-Symptome auf die Behandlung mit Levodopa. Symptome, die in der besten Beweglichkeitsphase nach einem Levodopa-Test mit supramaximaler Dosis persistieren, wie beispielsweise Freezingphänomene, Gleichgewichtsstörungen oder Dysarthrophonie, werden durch die tiefe Hirnstimulation in aller Regel nicht gebessert. Der geeignete Zeitpunkt im Krankheitsverlauf, an dem die behandelnden Ärzte einem Patienten eine operative Behandlung empfehlen, sollte nicht allein durch den klinischen Schweregrad bestimmt werden. Auch sozialmedizinische Überlegungen, wie etwa der drohende Verlust der Berufsfähigkeit sollte in die Abwägung einbezogen werden. In einer Spezialambulanz für Bewegungsstörungen kann im Einzelfall die Indikation für eine operative Therapie geprüft und der Patient entsprechend beraten werden.
Dr. Florian Kopper, Abt. Neurologie, Universitäts-Nervenklinik, Niemannsweg 147, 24105 Kiel, E-Mail: f.kopper@neurologie.uni-kiel.de
Deep brain stimulation: A powerful tool in the treatment of advanced Parkinson’s disease
Due to the availability of minimal traumatising techniques the stereotactic treatment of movement disorders has increasingly gained importance. Since the introduction of levodopa the ablative procedures of early stereotactic surgery in the treatment of Parkinson’s disease were only applied in certain cases. In the last year over 500 stereotactic guided implantations of deep brain stimulation electrodes have been carried out in Germany alone.
Keywords: Deep brain stimulation, Parkinson’s disease, subthalamic nucleus
Psychopharmakotherapie 2005; 12(01)
