Simon Halm, Oliver G. Bosch und Erich Seifritz, Zürich
Psychedelika sind eine Gruppe von Substanzen, die mit charakteristischen Wahrnehmungsveränderungen einhergehen. Die Anwendung beim Menschen blickt auf eine teils Jahrtausende lange Geschichte zurück, etwa im spirituellen Kontext bei indigenen Volksgruppen [6]. Den Ausdruck psychedelisch prägte der britische Psychiater Humphrey Osmond in seinem Briefwechsel mit dem Autor und Philosophen Aldous Huxley. Er setzt sich aus griechisch ψυχη (psyché, Seele) und δῆλος (dẽlos, offenkundig, offenbar) zusammen, kann also als „die Seele offenbarend“ verstanden werden. Huxley selbst war es, der den Begriff später in seinem einflussreichen Essay The Doors of Perception weltweit bekannt machte, indem er seine von Osmond begleitete Erfahrung mit dem klassischen Psychedelikum Mescalin literarisch eindrucksvoll beschrieb.
In der wissenschaftlichen Welt war es dann der Schweizer Albert Hofmann, der mit seiner Entdeckung der einzigartigen psychedelischen Wirkung von Lysergsäurediethylamid (LSD) im Jahre 1943 ein neues weltweites Interesse an dieser und mit ihr verwandten Substanzen auslöste. Die frühe Phase der klinischen Forschung lieferte über rund 20 Jahre vielversprechende Hinweise auf das therapeutische Potenzial psychedelischer Substanzen, wobei die Vielzahl dieser klinischen Studien heutigen Standards in Bezug auf Verblindung und Kontrollgruppen nicht genügen. Diese rapide Entwicklung blieb jedoch nicht ohne problematische Begleiterscheinungen. Die Idealisierung und der weitreichend unkontrollierte Gebrauch führten zu politischen Spannungen und letztendlich sogar zu einem weltweiten Verbot von LSD im Jahre 1970. Der Entdecker Albert Hoffman selbst nannte die Substanz später konsequenterweise sein „Sorgenkind“. Das Ende der Geschichte war jedoch noch nicht geschrieben und es kam beginnend in den 1990er-Jahren zu einer zunächst leisen, später jedoch rasanten Renaissance dieses Sorgenkinds und seiner Geschwister, die auf die Bühne der internationalen Wissenschaft zurückkehrten. Erneut wurde begonnen das therapeutische Potenzial klassischer Psychedelika wie LSD und Psilocybin, aber auch weiterer bewusstseinsverändernder Substanzen wie Ketamin und neu auch Lachgas (N2O, Distickstoffmonoxid) zu untersuchen. Parallel ermöglichten Fortschritte in den Neurowissenschaften und insbesondere neue bildgebende Verfahren ein besseres Verständnis der neurobiologischen Grundlagen der substanzinduzierten Bewusstseinszustände [23, 70]. Die an die Rückkehr der klassischen und atypischen Psychedelika gebundenen Hoffnungen werden dabei verstärkt durch ein zurückgehendes Interesse der pharmazeutischen Industrie an der psychopharmakologischen Arzneimittelentwicklung [13]. Der aktuelle Hype um psychedelische Substanzen stützt sich auf berechtigte Hoffnungen, birgt jedoch auch nicht zu vernachlässigende Risiken. Diese narrative Übersichtsarbeit beschreibt die klinisch vielversprechendsten klassischen und atypischen Psychedelika, ihre Pharmakologie, Wirkungsmechanismen sowie die aktuelle Studienlage zur Anwendung in der Behandlung psychischer Erkrankungen.
Klassische und atypische psychedelische Substanzen und ihre Pharmakologie
Psychedelika sind eine Gruppe psychoaktiver Substanzen die eine charakteristische psychedelische Erfahrung mit Veränderungen in Aufmerksamkeit, visueller Wahrnehmung, Emotionen, Selbstwahrnehmung und sozialer Interaktion auslösen. Die Phänomenologie des Erlebten und die zugrunde liegenden pharmakologischen Prozesse unterscheiden sich zwischen Substanzen erheblich, weshalb sich zunächst eine Einteilung in klassische und atypische Psychedelika bewährt hat. Klassische Psychedelika sind serotonerg wirksam und lassen sich wiederum einteilen in Tryptamin-Derivate (etwa Psilocybin oder Dimethyltryptamin [DMT]), Phenethylamine (Mescalin) und Ergolin-Derivate (LSD). Während die Geschichte dieser Substanzen in der westlichen Forschung Anfang des 20. Jahrhunderts begann, blicken sie in ihren natürlich vorkommenden Formen als Psilocybin-haltige Pilze (Gattung Psilocybe), Kaktuspflanzen (Peyote) und DMT (im Pflanzensud Ayahuasca) auf jahrtausendealte Traditionen in spirituellen und indigen-medizinischen Kontexten zurück. Atypische Psychedelika sind eine heterogene Gruppe an Substanzen, die ebenfalls mit Bewusstseinsveränderungen unterschiedlicher Qualität einhergehen. Beispiele mit therapeutischem Wert in der Psychiatrie sind die primär glutamaterg und dissoziativ wirkenden Substanzen Ketamin und N2O.
Lysergsäurediethylamid
LSD ist ein semisynthetisches Derivat der Lysergsäure und kann aus Mutterkornalkaloiden zum Beispiel aus Claviceps purpurea gewonnen werden. Chemisch gehört es zur Strukturklasse der Ergoline und weist eine chirale Struktur auf, wobei ausschließlich das D-Isomer psychoaktive Wirkung zeigt (Abb. 1). Pharmakodynamisch vermitteln der partielle Agonismus am Serotonin 5-HT2A- und 5-HT1A-Rezeptor sowie die agonistische Wirkung an Dopamin-D1- und -D2- und adrenergen Rezeptoren die Wirkung. Pharmakokinetisch besitzt LSD eine hohe Potenz: Die untere Schwelle für eine psychoaktive Wirkung liegt bei etwa 25 µg p. o. (ca. 0,35 µg/kg), die typische Dosis für eine volle psychedelische Erfahrung bei 100 bis 200 µg p. o. (ca. 1,4 bis 2,8 µg/kg). Die Wirkdauer liegt dosisabhängig bei 6 bis 10 Stunden, wobei teilweise längere Nachhallwirkungen beschrieben werden. Die mittlere letale Dosis (LD50) variiert zwischen Gattungen und wird mit 0,3 bis 60 mg/kg i.v angegeben. Letale Überdosierungen im Menschen sind selten und wurde vor allem in Verbindung mit erhöhter Risikobereitschaft unter Substanzwirkung berichtet [45, 61]. Auch drei Fälle von potenziell Überdosierungs-assoziierter letaler Toxizität beim Menschen sind beschrieben [41].
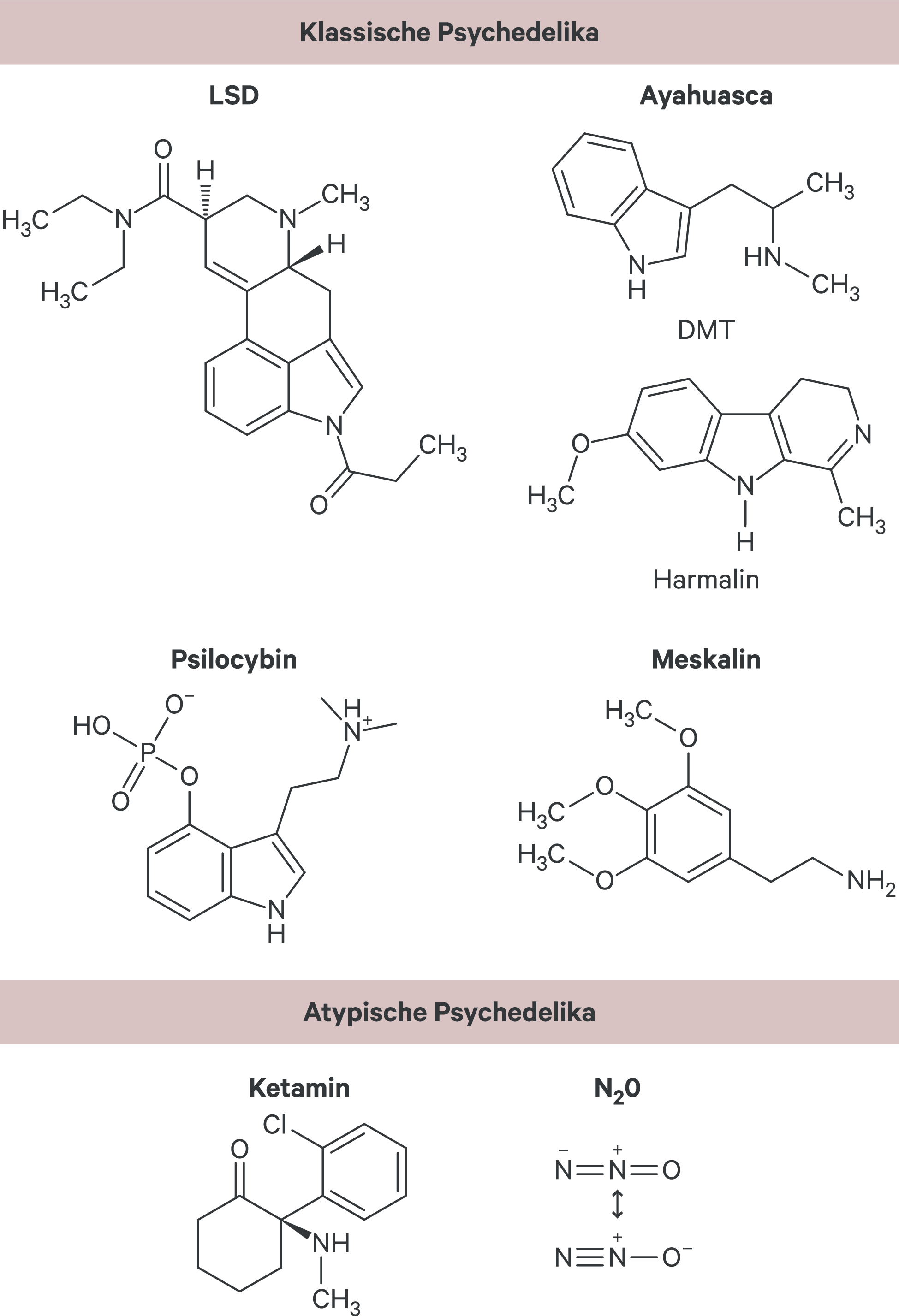
Abb. 1. Chemische Struktur klassischer und atypischer Psychedelika DMT: Dimethyltryptamin; LSD: Lysergsäurediethylamid
Psilocybin
Psilocybin (4-Phosphoryloxy-N,N-dimethyltryptamin) ist ein natürlich vorkommendes Alkaloid mit Tryptamin-Struktur. Es lässt sich weltweit in über 200 Pilzspezies der Gattung Psilocybe finden, die auch als „Magic Mushrooms“ bezeichnet werden. Die zeremonielle Anwendung der psychoaktiven Pilze hat eine lange Tradition bei indigenen Völkern Mittel- und Südamerikas, wo die Pilze beispielsweise vom Volk der Mazateken als heilig angesehen werden [72]. Es wird nach Einnahme in den aktiven Metaboliten Psilocin dephosphoryliert, der mit starker Affinität an 5-HT2A-Rezeptoren und weitere Serotonin-Rezeptoren bindet. Die Plasma-Psilocin-Level und Besetzung der 5-HT2A-Rezeptoren korrelieren eng mit der psychedelischen Wirkung [32]. Die für eine volle psychedelische Erfahrung verwendete Dosierung liegt zwischen 20 und 30 mg (0,3 bis 0,6 mg/kg Körpergewicht [KG]), womit eine Sättigung (70 %) der Besetzung der 5-HT2A-Rezeptoren erreicht wird [32]. Die Effekte erreichen nach oraler Einnahme nach einer bis zwei Stunden einen Höhepunkt und halten bis zu sechs Stunden an. Die LD50 bei Mäusen beträgt 280 mg/kg und die sehr seltenen Überdosis-assoziierten Todesfälle bei Menschen waren durch erhöhte Risikobereitschaft unter Substanzeinfluss bedingt [45, 61].
DMT/Ayahuasca
Ayahuasca ist der gebräuchliche Name für einen Pflanzensud, der in indigenen Gemeinschaften der Amazonasregion seit über 1000 Jahren in spirituellen Zeremonien verwendet wird [33]. Seine psychedelischen Eigenschaften werden durch DMT erzeugt, das in verschiedenen Pflanzen der Region, z. B. in Psychotria viridis, vorkommt [22]. Da DMT rasch durch Monoaminoxidasen (MAO) im menschlichen Gastrointestinaltrakt abgebaut wird, ist für die Wirksamkeit eine Kombination mit einem MAO-Inhibitor wie Harmin oder Harmalin, gewonnen aus Lianengewächsen (z. B. Banisteriopsis caapi), notwendig. Das Tryptamin-Derivat DMT besitzt eine sehr ähnliche Struktur wie Psilocybin und Serotonin und vermittelt seine Wirkung über die Aktivierung von 5-HT2A- und 5-HT2C-Rezeptoren. Analysen von Proben aus der Amazonasregion zeigen bei dem verwendeten Planzensud einen variablen Dosisbereich von 9 bis 42 mg DMT (ca. 0,1 bis 0,6 mg/KG), das mit Harmin bzw. Harmalin kombiniert verabreicht wurde [19]. Der Höhepunkt der psychoaktiven Wirkung wird nach 60 bis 120 Minuten erreicht, bei einer Dauer von rund vier Stunden [54]. Es gibt keine bekannte LD50 und die medizinischen Risiken der Anwendung scheinen gering, obwohl in einzelnen Fallbeschreibungen ein letaler Ausgang nach Einnahme durch Menschen bericht wird [24, 61].
Ketamin
Ketamin ist ein synthetisches, chirales Cyclohexanonderivat, das seit langem als dissoziatives Anästhetikum in der Tier- und Humanmedizin verwendet wird und auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation geführt wird [76]. Chemisch handelt es sich um ein Razemat, wobei beide vorkommenden Konfigurationen unterschiedliche Wirkprofile besitzen. Ketamin unterscheidet sich wesentlich von anderen Anästhetika, da es hämodynamische Parameter stabilisiert [67] und häufiger dissoziative Effekte bis hin zu außerkörperlichen Erfahrungen induziert [36]. Es wird auch hedonistisch gebraucht und kann aufgrund seiner spezifischen bewusstseins- und wahrnehmungsverändernden Wirkung als atypisches Psychedelikum klassifiziert werden. Pharmakodynamisch wird die Wirkung durch einen non-kompetitiven Antagonismus glutamaterger N-Methyl-D-aspartat-(NMDA-)Rezeptoren in kortikalen Regionen induziert. Es werden zudem weitere Prozesse auf molekularer Ebene und insbesondere die Synaptogenese angestoßen. Aufgrund seiner geringen oralen Bioverfügbarkeit (BV) von 17 % wird es klinisch häufig intranasal (BV 25–50 %), intramuskulär (BV 93 %) oder intravenös verabreicht. Die typische Dosis für eine psychedelische Wirkung beträgt bei racemischem Ketamin rund 35 mg i. v. (0,5 mg/kg KG) und 18 mg i. v. (ca. 0,25 mg/kg KG) für (S)-Ketamin. Die psychoaktiven Effekte halten etwa 90 bis 120 Minuten an [27, 36, 47]. Bei Tieren wird eine LD50 von über 600 mg/kg beschrieben, was einer Äquivalenzdosis von mehr als vier Gramm bei Menschen entsprechen würde. In der Literatur finden sich mehrere Berichte von letalen Intoxikationen meist bei jungen Männern nach kombinierter Einnahme mit atemdepressiven Substanzen [14].
Lachgas
Lachgas (Distickstoffmonoxid [N2O], englisch nitrous oxide), ist ein volatiles, farbloses Gas aus der Gruppe der Stickoxide. Es blickt als sicheres Inhalationsanästhetikum auf eine lange Verwendung in der Narkose- und Zahnmedizin zurück, wo es typischerweise in einem 50%igen Gemisch mit Sauerstoff verabreicht wird. Erste Effekte treten bereits ab einer Atemluftkonzentration von 20 % auf. Aufgrund seiner ausschließlich pulmonalen Aufnahme und Elimination flutet es schnell an und besitzt ein günstiges Nebenwirkungsprofil. Eine zentralnervöse Wirkung wird im Tier- und Gewebsmodell durch einen non-kompetitiven Antagonismus an Glutamat-Rezeptoren (NMDA-Rezeptoren und in geringerem Maße Alpha-Amino-3-hydroxy-5-methyl-4-isoxazolpropionsäure-[AMPA-]Rezeptoren) vermittelt [39]. Die Eliminationshalbwertszeit von N2O beträgt etwa fünf Minuten. Es gibt keine bekannte LD50 im Menschen, jedoch sind nach Überdosierungen bei nicht medizinischem Gebrauch Fälle funikulärer Myelose [30] und letale Ausgänge beschrieben [49].
Neurobiologische Grundlagen und Erklärungsmodelle
Das wiederkehrende Interesse am klinischen Potenzial psychedelischer Substanzen hat auch das Verständnis der den veränderten Bewusstseinszuständen zugrunde liegenden neurobiologischen Mechanismen vorangetrieben. Auf diesem sehr dynamischen Forschungsfeld haben sich eine Reihe von Hypothesen betreffend Neurotransmission, Konnektivität- und Netzwerkveränderungen sowie Neuroplastizität und prädiktiver Kodierung etablieren können [69].
Pharmakodynamik
Klassische Psychedelika agieren agonistisch an 5-HT2A-Rezeptoren apikaler Dendriten von Pyramidenzellen in Schicht V von neo- und subkortikalen Arealen [42]. Die aktuelle Evidenz legt nahe, dass dieser Grundmechanismus für die Vermittlung der Wirkung eine wesentliche Rolle spielt. Bereits 1998 konnten Vollenweider et al zeigen, dass die bewusstseinsverändernde Wirkung von Psilocybin ausbleibt, wenn im Menschen gleichzeitig der spezifische 5-HT2A-Antagonist Ketanserin verabreicht wird [70]. Gleiches konnte später für die Effekte von DMT und LSD reproduziert werden [50, 66]. Weiterhin zeigen Positron-Emissions-tomographische (PET) Studien, dass das Ausmaß der Besetzung von 5-HT2A-Rezeptoren im präfrontalen Kortex mit der psychedelischen Wirkung korreliert ist [32].
Bei Ketamin und N2O handelt es sich dagegen primär um non-kompetitive Antagonisten an glutamatergen NMDA-Rezeptoren, obwohl zudem eine Aktivierung glutamaterger AMPA-Rezeptoren und auch ein Agonismus am Kappa-Opioid-Rezeptor zu beobachten sind [25,39].
Veränderungen des thalamischen Filters
Psychedelika modulieren 5-HT2A-vermittelt thalamokortikale Feedbackschleifen, was zu einer Enthemmung thalamischer Afferenzen in Richtung Kortex führt [69]. Intero- und exterozeptive Stimuli scheinen weniger stark inhibiert und über thalamische Verbindungen stärker in kortikale Areale geleitet zu werden. Dies scheint unter Psilocybin, LSD und DMT der Fall zu sein und ist mit der 5-HT2A-Aktivierung korreliert [53, 55]. Zwei Bildgebungsstudien zeigen nach Gabe von LSD erhöhte funktionelle thalamische Konnektivität, insbesondere zu sensorischen Arealen [37, 52]. Die kortikale Überladung mit sensorischen Informationen bietet ein Erklärungsmodell für die psychedelische Erfahrung.
Integration von Hirnnetzwerken
Zunehmende Evidenz aus der funktionellen Bildgebung deutet darauf hin, dass Psychedelika Hirnnetzwerke modulieren, die für Selbst-Erleben und Selbst-bezogenes Denken verantwortlich sind. Ein konsistent reproduziertes Ergebnis ist die Desintegration bzw. reduzierte funktionale Konnektivität innerhalb von Strukturen des „Default Mode Network“ (DMN), das bei Reiz-unabhängigem Denken aktiv und bei verschiedenen pathologischen Zuständen überaktiv zu sein scheint [9, 12]. Sowohl unter klassischen serotonergen Psychedelika als auch unter Ketamin-Einfluss ist eine Desintegration des DMN zu beobachten [9, 12]. Weiterhin wird beobachtet, dass die Konnektivität zwischen sensorischen Arealen zunimmt (phänomenologisch beispielsweise als Synästhesie erlebt), während sich die Integration in assoziativen Kortexarealen verringert [69].
Veränderungen der Entropie
Ein kompatibles Modell postuliert, dass sich psychedelische Zustände im Gehirn in erhöhter neuronaler Entropie widerspiegeln. Diese Idee basiert auf der Annahme, dass Stimuli nach den Prinzipien der Bayes’schen Inferenz verarbeitet werden, d. h., ständig neue Annahmen, sogenannte „prior beliefs“ generiert und aktualisiert werden. In Bezug auf Psychedelika-induzierte Zustände postuliert das REBUS(relaxed beliefs under psychedelics)-Modell, dass unter Einfluss psychedelischer Substanzen diese Grundannahmen über die Umwelt in einem Zustand erhöhter Entropie weniger gefestigt sind und leichter durch neue sensorische Inhalte modulierbar werden [10, 11]. Die Erweiterung des sensorischen Informationsflusses in Richtung Kortex kann in Einklang gebracht werden mit dem oben beschriebenen thalamischen Filtermodell. Wissend, dass negative Verzerrungen in Annahmen über sich selbst und die Umwelt einen wichtigen transdiagnostischen psychopathologischen Mechanismus darstellen, kann hier bereits eine mögliche Brücke zur psychologischen Wirkweise geschlagen werden.
Induzierte Neuroplastizität
Aktuelle Studien in Tier- und In-vitro-Modellen zeigen, dass durch 5-HT2A-Aktivierung eine Glutamat-induzierte Erhöhung der Neuroplastizität ausgelöst wird [78]. Diese Effekte in Bezug auf Regulation der Synaptogenese und Gedächtniskonsolidierung spielen auch post-akut eine wichtige Rolle und tragen zu den langandauernden therapeutischen Effekten bei [31]. Die von der phänomenologischen Erfahrung unabhängigen Effekte befeuern auch die Debatte, in welchem Maße die bewusstseinsverändernde Wirkung notwendig ist, um Symptomverbesserungen zu bewirken. Für Ketamin sind vielfältige molekulare Prozesse beschrieben, die über die akute Substanzwirkung hinaus in Gang gesetzt werden. Bedeutsam ist hier beispielsweise die Steigerung von Brain-derived neurotrophic Factor (BDNF).
Wirkmechanismen weiterer atypischer Substanzen
Stickstoffmonoxid (N2O) ist ähnlich wie Ketamin bereits lange als Analgetikum und Anästhetikum in Gebrauch, die neurobiologischen und insbesondere antidepressiven Wirkungsmechanismen sind jedoch erst in der jüngeren Vergangenheit näher untersucht worden. Die Substanz wirkt (wie Ketamin) als nichtkompetitiver Glutamat-NMDA-Rezeptor-Antagonist in präklinischen Tier- und Gewebemodellen [39]. Weiterhin scheint der analgetische Effekt von N2O durch die Aktivierung von Kappa-Opioid-Rezeptoren vermittelt zu werden, ein Mechanismus, der bekanntermaßen ebenfalls die antidepressive Wirkung bei Ketamin und Buprenorphin verstärkt [18, 25]. In EEG-Studien zeigen sich durch N2O-Behandlung induzierte hochamplitudige Delta-Oszillationen [46].
Die wesentlichen pharmakologischen und neurobiologischen Wirkungen der Psychedelika sind in Tabelle 1 zusammengefasst.
Tab. 1. Übersicht über die Pharmakologie und Neurobiologie der beschriebenen Substanzen
|
Substanz |
Pharmakologie |
Neurobiologische Prozesse |
|
LSD |
Partieller Agonist an 5-HT2A- und weiteren Serotonin-Rezeptoren Agonist an D1–4-Dopamin-Rezeptoren Schwacher Agonist an adrenergen Rezeptoren |
Sekundäre Steigerung kortikaler Glutamat- und Dopaminkonzentrationen Gesteigerte sensorische Verarbeitung bei reduzierter assoziativer Netzwerk-Integrität, Desintegration des DMN, Reduzierte Amygdala-Reaktivität, Zunahme neuronaler Entropie und Komplexität, Induzierung von Neuroplastizität |
|
Psilocybin |
Partieller Agonist an 5-HT2A- sowie weiteren Serotonin-Rezeptoren |
|
|
DMT/Ayahuasca |
Partieller Agonist an 5-HT2A-Rezeptor MAO-Inhibierung |
|
|
Ketamin |
Non-kompetitiver Antagonist am Glutamat-(NMDA-)Rezeptor Agonismus am Kappa-Opioid-Rezeptor |
Sekundäre Aktivierung glutamaterger AMPA-Rezeptoren Steigerung der Neuroplastizität (z. B. BDNF, eEF2, mTOR, GSK-3) Modulation ACC, PFC, Desintegration des DMN |
|
Lachgas |
Non-kompetitiver Antagonist am Glutamat-(NMDA-)Rezeptor Agonismus am Kappa-Opioid-Rezeptor |
Bisher limitierte Evidenz |
ACC: Anterior cingulate cortex; AMPA: α-Amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid; BDNF: Brain-derived neurotrophic factor; DMN: Default mode network; eEF2: Eukaryotic elongation factor 2; GSK-3: Glycogen synthase kinase-3; MAO: Monoaminoxidase; mTOR: Mechanistic Target of Rapamycin; NMDA: N-Methyl-D-aspartate; PFC; präfrontaler Kortex
Therapeutische Implikationen
Psychische Wirkungsmechanismen
Die diversen psychischen Phänomene während und nach Einnahme von Psychedelika werden zunehmend untersucht und in begleitend stattfindende Psychotherapie (pharmaco-enhanced psychotherapy) integriert [69].
Emotionsverarbeitung, psychologische Flexibilität und Akzeptanz
Psychedelika modulieren die psychologische und neurobiologische Reaktion auf negative Stimuli. Dies kann durch eine verminderte emotionale Reaktion beim Zeigen angsterfüllter Gesichtsausdrücke illustriert werden, die neuronal mit verminderter Amygdala-Reaktivität einhergeht. Folge sind Veränderungen in der Emotionsverarbeitung und Empathie [17]. Diverse Studien zeigen eine verringerte Amygdala-Reaktivität auf negative Stimuli unter Psilocybin und LSD [28, 37]. Bereits nach einmaliger Psilocybin-Gabe hielt dies bis zu vier Wochen an und war mit dem Therapieerfolg bei Patienten mit therapieresistenter Depression assoziiert [64]. Die psychedelische Erfahrung könnte es Patienten ermöglichen, negative Verzerrungen zu überwinden und ihre negativen Gedanken und Selbstwahrnehmungen weniger wertend und mit größerer psychologischer Flexibilität zu betrachten [74], was in Einklang mit den oben beschriebenen neurobiologischen Annahmen zur erhöhten Entropie im Rahmen des REBUS-Modells zu bringen wäre. Ein an diese Annahmen angelehntes begleitendes Psychotherapiemodell wurde beispielsweise von Watts et al. vorgeschlagen [74].
Selbsterleben und positive Entgrenzung
Einen wichtigen psychologischen Wirkfaktor stellen Veränderungen des Selbst-Erlebens dar, die von subtilen Veränderungen der Körperwahrnehmung bis hin zu totaler Selbst-Auflösung und Gefühlen ozeanischer Entgrenzung reichen können [34]. Eine als positiv erlebte Entgrenzung ist phänomenologisch bei klassischen Psychedelika wie auch bei Ketamin beschrieben [43]. Diverse Studien zeigen eine Korrelation von positiv erlebter Entgrenzung und Einheitsgefühl mit therapeutischem Erfolg, sowohl bei affektiven Störungen als auch bei Abhängigkeitserkrankungen [4, 43, 56].
Soziale Verarbeitungsprozesse
Psychedelika beeinflussen das Erleben sozialer Interaktionen und führen zu einer erhöhten emotionalen Empathie [51]. Randomisierte kontrollierte Studien konnten zeigen, dass bei Gesunden soziale Belohnungsprozesse positiv beeinflusst und negativ erlebte Gefühle sozialer Ausgrenzung reduziert werden. [51]. Dies könnte auch therapeutisch ein wichtiger Wirkfaktor sein, da sozialer Rückzug und verminderte soziale Kognition auslösende und aufrechterhaltende Faktoren für diverse psychiatrische Störungsbilder darstellen. Patienten mit therapieresistenter Depression beschrieben nach Einmalgabe von Psilocybin die Wiederherstellung einer positiven Beziehung zu ihrem sozialen Umfeld als bedeutendsten Wirkfaktor für den Therapieerfolg [73].
Achtsamkeit
Es besteht ein positiver Zusammenhang zwischen psychedelischer Erfahrung und achtsamkeitsbasierten Methoden, die zunehmend in psychotherapeutische Settings Einzug finden. In einer Placebo-kontrollierten Studie mit 39 erfahrenen Meditierenden, die 0,315 mg/kg Psilocybin p. o. erhielten, war durch die Substanz eine Vertiefung der meditativen Zustände und eine intensivierte positive Selbst-Auflösung zu beobachten. Im Follow-up nach vier Monaten zeigten sich in der Psilocybin-Gruppe weiterhin erhöhte Achtsamkeitswerte und positive Veränderungen in psychosozialer Funktion gegenüber der Placebo-Gruppe [63].
Auch die subjektive Erfahrung von Ketamin scheint sich positiv auf Achtsamkeitsverfahren auszuwirken. Insbesondere im Bereich der Abhängigkeitserkrankungen werden zunehmend Ketamin-Therapien in Verbindung mit Achtsamkeits-basierter Rückfallprävention als wirksame Therapiemethoden beschrieben [20].
Psychotherapeutische Integration
Frühe Forschung
Schon aus der Frühphase der psychiatrischen Forschung mit psychedelischen Substanzen ist bekannt, dass „Set und Setting“, also die psychische Konstitution des Patienten, die Haltung des Therapeuten und die direkte Umgebung während der Substanzeinnahme eine entscheidende Rolle für die Qualität der Erfahrung spielen [21]. Je nach subkulturellem Hintergrund können Erwartungseffekte dabei auch stark idealistisch oder spirituell geprägt sein [29].
Substanzgestützte Psychotherapie bzw. „pharmacoenhanced psychotherapy“
Die bei heutigen Studien gängigen Konzepte legen großen Wert auf die sichere Vorbereitung, sowie die Umgebung und Begleitung während der Substanzeinnahme. Eine begleitend stattfindende Psychotherapie integriert die Erfahrung und die angestoßenen Prozesse anschließend in den Alltag der Patienten. Dies wird als substanzgestützte oder psychedelikagestützte Psychotherapie bezeichnet [21, 29, 60]. Im Rahmen aktueller klinischer Phase-II-Studien, auch in Deutschland (NCT04670081) und der Schweiz (NCT03715127) hat sich ein vierstufiger Prozess etabliert, um Sicherheit und Behandlungserfolg zu optimieren:
- Screening und Assessment
- Vorbereitung
- Begleitete Substanzerfahrung
- Integration
Im ersten Schritt werden die psychische und körperliche Eignung der Teilnehmer abgeklärt. So werden im Rahmen aktueller Studien Patienten mit Psychosen oder Manien in der Anamnese oder bei Verwandten ersten Grades ausgeschlossen. Somatische Ausschlusskriterien sind schwere nicht eingestellte Hypertonien oder sonstige schwere Herz-Kreislauf-Erkrankungen. Im zweiten Schritt werden die Patienten auf die Wirkung vorbereitet und in mögliche begleitende Psychotherapieverfahren eingeführt. Insbesondere potenziell schwierige Erfahrungen werden vorbesprochen und eine vertrauensvolle Ebene zwischen Patienten und Therapeut etabliert.
Die Substanzsitzung selbst findet dann in einem komfortablen, Wohnzimmer-ähnlichen Setting statt, es besteht die Möglichkeit, Musik zu hören und sich bei geschlossenen Augen hinzulegen. Die Patienten werden eingeladen, sich auf die sich entfaltende Wirkung zu fokussieren, wobei die Therapeuten eine supportive Rolle einnehmen. Bereits am nächsten Tag und in darauffolgenden Sitzungen wird die Erfahrung nachbesprochen. Mögliche Erkenntnisse und Emotionen werden eingeordnet und neu gewonnene Sichtweisen in den Psychotherapieprozess und letztlich den Alltag integriert. Ein möglicher substanzübergreifender und transdiagnostischer Mechanismus könnte in der durch psychedelische Substanzen induzierten Neuroplastizität bestehen, die allgemein ein kritisches Fenster für die bessere Wirksamkeit verschiedener psychotherapeutischer Interventionen bieten könnte [66].
Risiken und unerwünschte Wirkungen
Die Vielzahl aktueller klinischer Studien zeigt, dass sowohl klassische als auch atypische psychedelische Substanzen ein gutes Sicherheitsprofil mit sich bringen, wenn sie therapeutisch begleitet in einem sicheren klinischen Rahmen verabreicht werden. Tabelle 2 gibt einen Überblick über die häufigsten unerwünschten Nebenwirkungen der beschriebenen Subtanzen.
Tab. 2. Übersicht über unerwünschte Arzneimittelwirkungen (UAW) der beschriebenen Substanzen
|
Substanz |
Akuteffekte |
Mögliche UAW |
|
LSD Psilocybin DMT/Ayahuasca |
Vegetative Stimulation, affektive Stimulation Visuelle Phänomene (z. B. geometrische Muster, Pseudohalluzinationen) Veränderung/Auflösung von Ich- und Zeiterleben, transzendente Erfahrungen |
Tachykardie, Hypertonie, Mydriasis, Nausea, Emesis, transiente Kopfschmerzen Anspannung, Angst/Panik (z. B. im Kontext von Ich-Auflösung), Selbstüberschätzung, Unfallgefahr Seltene Fälle andauernder Wahrnehmungsveränderungen (HPPD) |
|
Ketamin |
Dissoziatives Erleben, außerkörperliche Erfahrungen, Verzerrungen des Körper-, Raum- u. Zeiterlebens, Veränderung/Auflösung von Ich- und Zeiterleben, transzendente Erfahrungen |
Blutdruckanstieg, Nausea, Kopfschmerz, Schwindel, Koordinationsstörungen, Langzeit: Ulzerative Zystitiden, Urothelveränderungen |
|
Lachgas |
Dissoziatives Erleben, Sedierung |
Kopfschmerzen, Übelkeit, leichte Benommenheit, funikuläre Myelose |
HPPD – Hallucinogen Persisting Perception Disorder
Somatische Nebenwirkungen
In einer Übersichtsarbeit zeigte sich über verschiedene Studien hinweg eine durchweg sehr gute Verträglichkeit von Psilocybin in einem klinischen Kontext bei über 100 Patienten [65]. Nebenwirkungen von Psilocybin und DMT beinhalten Blutdruckanstieg, Übelkeit und vorübergehende Kopfschmerzen. Häufigste Nebenwirkungen von Ketamin sind transienter Blutdruckanstieg, Nausea, Kopfschmerz, Schwindel, Koordinationsstörungen und veränderte visuelle und auditive Wahrnehmung [62]. Diese Nebenwirkungen sind aufgrund der kurzen Halbwertszeit nur von kurzer Dauer. Missbrauch von Ketamin findet häufig in höherer Frequenz und Dosierung statt und wird mit einem erhöhten Risiko für ulzerative Zystitis in Verbindung gebracht. Auch wenn in bisherigen Therapieprogrammen keine erhöhte Inzidenz für Zystitiden gefunden wurde, wird ein Monitoring solcher Symptome in aktuellen Therapieleitlinien empfohlen. Die medizinische Anwendung von N2O in der Anästhesie gilt als sicher, bekannte Nebenwirkungen wie Kopfschmerzen, Übelkeit und leichte Benommenheit können durch in der psychiatrischen Anwendung niedriger wirksame Konzentrationen limitiert werden [40].
Psychische Nebenwirkungen
Akute psychische Komplikationen, umgangssprachlich auch als „bad trip“ bezeichnet, beinhalten Desorientierung, Panik und Überforderung mit dem Erlebten. Negative Erfahrungen sind dabei umgebungsabhängig und werden im Nachhinein häufig als hilfreich beschrieben, wenn sie mit der richtigen therapeutischen Unterstützung bewältigt wurden [26]. Unter Ketamin-Wirkung können Dissoziation und ängstlich gefärbte Erlebnisse bis hin zu außerkörperlichen Erfahrungen vorkommen und psychisch herausfordernd sein [2]. Interessanterweise führte in einer Studie mit gesunden Probanden (S)-Ketamin zu Psychose-ähnlichen Reaktion, während (R)-Ketamin Gefühle von Entspannung und Wohlbefinden induzierte [68]. Obwohl bis anhin nicht systematisch untersucht, weisen individuelle Fallberichte auf das Manie-induzierende Risiko klassischer Psychedelika bei Patienten mit bekannter bipolarer affektiver Störung oder dafür positiver Familienanamnese hin [5]. Unklar bleibt aktuell, wie dieses Risiko in einem kontrollierten klinischen Setting gegenüber dem positiven antidepressiven Effekt dieser Substanzen bei bipolarer Depression abzuwiegen ist. In einer aktuellen Studie wird daher die Sicherheit und Verträglichkeit in der Anwendung bei Patienten mit Bipolar-II-Störung untersucht (NCT05065294, 2022).
Missbrauchspotenzial
Hedonistischer Gebrauch von Ketamin ist häufig und ist in hohen Dosierungen und hoher Frequenz mit Toleranz- und Abhängigkeitsentwicklung assoziiert [59]. Wichtig ist zu erwähnen, dass in Bezug auf Dosis und Applikationsfrequenz ein großer Unterschied zwischen therapeutischer und missbräuchlicher Anwendung besteht. Im Follow-up großer klinischer Studien mit depressiven Patienten wurde nach Ketamin-Therapie kein erhöhtes Craving oder Missbrauch berichtet. Klassische Psychedelika wie Psilocybin und LSD zeigen keine Toleranzentwicklung und weisen unter den hedonistisch verwendeten Substanzen das niedrigste Abhängigkeitspotenzial auf. Insbesondere für Psilocybin und Ketamin gibt es sogar vielversprechende Ergebnisse auf ein therapeutisches Potenzial in der Behandlung von Abhängigkeitserkrankungen [4, 20].
Klinische Anwendung in der Behandlung der unipolaren Depression
Im Folgenden soll ein Überblick über die Studienlage und Evidenz der verschiedenen Substanzen in der Depressionsbehandlung gegeben werden.
Psilocybin
Bereits frühe klinische Studien mit Psilocybin zeigten vielversprechende Behandlungserfolge, sind jedoch aufgrund fehlender Verblindung und Kontrollgruppen in ihrer Aussagekraft limitiert [6]. Ab 2016 berichteten zwei kontrollierte Studien signifikante, schnelle und robuste Effekte auf Depressions- und Angstsymptomatik bei Patienten mit Krebserkrankungen. In einem Cross-over-Studiendesign mit Niacin als Placebo-Kontrolle (n = 29) war in diesem Patientenkollektiv eine deutliche und andauernde Symptomreduktion nach Einmalgabe von Psilocybin zu beobachten. Der Behandlungserfolg war mit durch die Substanz ausgelösten mystischen Erfahrungen assoziiert [57]. Eine weitere Studie (n = 51) reproduzierte diese Ergebnisse unter Gabe einer hohen Dosis Psilocybin gegenüber einer Placebo-ähnlichen Dosis. In beiden Studien hielten die Symptomreduktion und die verbesserte Lebensqualität der Menschen mit Krebserkrankungen auch nach sechs Monaten weiter an.
Bei Patienten mit therapieresistenter Depression führte Psilocybin in einer Open-Label-Studie von Carhart-Harris et al. zu schnell eintretender und bis drei Monate andauernder Verbesserung der depressiven Symptomatik [8]. Darauf aufbauend konnten die selben Autoren zeigen, dass die zweimalige Gabe von 25 mg Psilocybin bei Patienten mit mittelgradiger bis schwerer Depression eine gleichwertige antidepressive Wirkung aufwies wie die etablierte Psychopharmakotherapie mit dem selektiven Serotonin Wiederaufnahmehemmer (SSRI) Escitalopram [7]. Eine weitere aktuelle randomisierte Phase-II-Studie ergab bei 24 Patienten mit Depression einen signifikanten, hohen antidepressiven Effekt von Psilocybin-gestützer Psychotherapie gegenüber der Wartelistenkondition [15]. In dieser Studie erfüllten nach einer Woche 58 % und nach vier Wochen noch 54 % der Teilnehmer aus der Psilocybin-Gruppe die Kriterien für eine Remission ihrer Depression.
Aufgrund der vielversprechenden Ergebnisse erhielt Psilocybin von der amerikanischen Food and Drug Administration den Status als sogenannte Breakthrough-Therapy, das heißt, bei Vorlage eines Zulassungsantrags wird dieser bevorzugt bearbeitet werden. Erwartet werden noch die Ergebnisse weiterer Phase-II-Studien im deutschsprachigen Raum (NCT03715127 PUK Zürich, NCT04670081 ZI Mannheim & Charité Berlin), in denen ebenfalls die Wirksamkeit und Wirkungsmechanismen von Psilocybin-gestützter Psychotherapie bei Patienten mit Depression untersucht werden. Tabelle 3 gibt einen Überblick über abgeschlossene und aktuell laufende Phase-II-Studien zur Untersuchung von Psilocybin in der Behandlung der Depression.
Tab. 3. Überblick über abgeschlossene und aktuell laufende Phase-II-Studien zur Untersuchung von Psilocybin in der Behandlung der Depression
|
Studientitel |
Studienkennnummer |
Ort |
Stichprobe |
Intervention |
Endpunkt |
Ergebenis/Publikation |
Schlussfolgerung |
|
Rapid and sustained symptom reduction following psilocybin treatment for anxiety and depression in patients with life-threatening cancer: a randomized controlled trial |
NCT00957359 |
Department of Psychiatry, New York University School of Medicine |
n = 29 (14 Psilocybin; 15 Niacin) |
Zweimalig Psilocybin (0,3 mg/kg) oder Gabe eines aktiven Placebo (Niacin 250 mg) im Abstand von 7 Tagen mit begleitender Psychotherapie |
STAI-T und STAI-S, |
Hochsignifikante Unterschiede zwischen Aktiv- und Placebo-Gruppe in STAI-T, STAI-S, HADS-A( 58 % vs. 14 %), HADS-T, HADS-D und BDI (83 % vs. 14 %) an Tag 1 , 2 und 6, sowie bis 7 Wochen nach der ersten Psilcybinsitzung |
Schnell anhaltender und andauernder positiver Effekt auf Depressions- und Angstsymptiomatik bei Patienten mit lebensbedrohlichen Krebserkrankungen |
|
Psilocybin produces substantial and sustained decreases in depression and anxiety in patients with life-threatening cancer: a randomized double-blind trial |
NCT00465595 |
Johns Hopkins University |
n = 51 (25 niedrige Dosis; 26 hohe Dosis) |
Zweimalig Psilocybin 22 oder 30 mg/70 kg (hohe Dosis) vs. 1 oder 3 mg/70 kg (niedrige Dosis) im Abstand von 5 Wochen mit begleitender Psychotherapie |
GRID-HAM-D-17, |
Signifikant höhere Response und Remission in der Hochdosisgruppe, Effekte blieben bis 6 Monate nach der ersten Sitzung signifikant |
Schnell anhaltender und andauernder positiver Effekt auf Depressions- und Angstsymptiomatik sowie Lebensqqalität bei Patienten mit lebensbedrohlichen Krebserkrankungen. Weitere Populationen sollten untersucht werden. |
|
Psilocybin versus escitalopram in depression [7] |
NCT03429075 |
Imperial College London |
n = 59 (30 Psilocybin; 29 Escitalopram) |
Zweimalig Psilocybin (25 mg) vs. Placebo (Cellulose) vs. Escitalopram (10, dann 20 mg) vs. Placebo (1 mg Psilocybin). |
QIDS-SR-16 |
Kein signifkanter Unterschied zwischen Psilocybin 25 mg und Escitalopram, kein Unterschied betreffend adverse events |
Gleiche Wirksamkeit wie Standardtherapie (Escitalopram), evtl. Vorteile bei sekundären Endpunkten für Psilocybin. Größere und längere Studien sollten Psilocybin mit etablierten Antidepressiva vergleichen. |
|
Effects of psilocybin in major depressive disorder |
NCT03181529 |
Johns Hopkins University |
n = 24 (15 Psilocybin; 12 Warteliste) |
Zweimalig Psilocybin (erst 20 mg/70 kg, dann 30 mg/70 kg mit begleitender Psychotherapie, gegenüber Warteliste mit verspäteter Behandlung |
GRID-HAM, QIDS-SR |
Schnelles Ansprechen der Depression nach 1 Tag. Symptomatik signifikant geringer nach 5 und auch 8 Wochen. Große Effektstärken (Cohens d = 2,6) |
Psilocybin-assistierte Psychotherapie bringt schnelle und robuste Effekte mit sich. Ergebnisse sollten in weiteren Placebo-kontrollierten Studien bestätigt werden. |
|
Clinical, Neurocognitive, and Emotional Effects of Psilocybin in Depressed Patients |
NCT03715127 |
Psychiatrische Universitätsklinik Zürich |
n = 55 |
Einmalige Dosis Psilocybin (0,215 mg/kg) vs. Placebo (100 % Mannitol); mit begleitender Psychotherapie |
MADRS, BDI |
Studie abgeschlossen, Ergebnisse noch nicht veröffentlicht |
Ausstehend |
|
Efficacy and Safety of Psilocybin in Treatment-Resistant Major Depression (EPIsoDE) |
NCT04670081 |
Zentralinstitut Mannheim, Charité Berlin |
Ziel n = 144 |
Zweimalige Gabe von Psilocybin 25 mg/25 mg vs. 5m/25 mg vs. 25 mg/5 mg vs. Nicotinamid (100 mg)/25 mg Psilocybin; mit begleitender Psychotherapie |
HAM-D, BDI |
Studie in aktiver Rekrutierung |
Ausstehend |
BDI: Beck Depression Inventory; GRID-HAM: GRID Hamilton Depression Rating Scale; HADS: Hospital Anxiety and Depression Scale (HADS-A: anxiety; HADS-D: depression; HADS-T: total); HAM-A: Hamilton Anxiety Rating Scale; HAM-D: Hamilton Depression Rating Scale; MADRS: Montgomery-Åsberg Depression Rating Scale; QIDS-SR: Quick Inventory of Depressive Symptomatology – Self Rated; STAI: Spielberger State-Trait Anxiety Inventory (STAI-S: state; STAI-T: trait)
DMT/Ayahuasca
Ähnlich wie bei Psilocybin wiesen zunächst kleine, nicht Placebo-kontrollierte Studien auf die antidepressive Wirksamkeit einer einmaligen Ayahuasca-Gabe hin. So konnten sowohl in Gesunden als auch bei einer kleinen Anzahl von Patienten mit Depression (n = 6) Hinweise auf antidepressive Effekte gefunden werden [16]. In einer Open-Label-Studie zeigte sich, dass diese antidepressiven Effekte in einer größeren Stichprobe (n = 17) signifikant waren, schnell eintraten und für drei Wochen anhielten [58]. Hier erhielten die Patienten der Ayahuasca-Gruppe adaptiert an ihr Körpergewicht individuell zwischen 96 mg und 160 mg DMT kombiniert mit 25 bis 42 mg Harmin. Während bei dieser Studie die weitgehende Begrenzung auf milde und mittelgradige Depressionen eine Limitierung darstellt, konnte eine darauf aufbauende Studie rapide antidepressive Effekte bei Patienten mit schweren therapieresistenten Depressionen beschreiben. Die körpergewichtsadaptierte Ayahuasca-Mischung wurde mit einem aktiven, Zinksulfat enthaltenden Placebo verglichen (n = 29) [44].
Ketamin
Der erste Bericht über die antidepressiven Eigenschaften von Ketamin geht in das Jahr 2000 zurück und diese Eigenschaften konnten seitdem in einer Vielzahl randomisiert kontrollierter Studien und Metaanalysen bestätigt werden [3, 77]. Konsistent beschrieben wird ein schneller, robuster, aber relativ kurz anhaltender antidepressiver Effekt von Ketamin in verschiedenen Applikationsformen. Der Effekt tritt dabei innerhalb von einer bis 24 Stunden nach Verabreichung auf und hält für ein bis zwei Wochen an, kann aber durch wiederholte Applikationen verlängert werden. Mehrere systematische Reviews und Metaanalysen bestätigen außerdem einen moderat bis starken positiven Effekt von Ketamin auf den Rückgang von Suizidgedanken, insbesondere bei Patienten mit bipolaren affektiven Störungen [1]. Obwohl bis anhin nur das Enantiomer (S)-Ketamin in Kombination mit einem Antidepressivum zur Behandlung therapieresistenter Depression zugelassen ist, zeigt sich ein antidepressiver Effekt sowohl für razemisches als auch für (R)-Ketamin [25].
N2O
In einer ersten kleinen Proof-of-Concept-Studie konnten Nagele et al. 2014 zeigen, dass bei 20 Patienten mit therapieresistenter Depression die Gabe von 50%igem N2O zu einem signifikanten antidepressiven Effekt führte. Dieser Effekt trat innerhalb von 24 Stunden ein und hielt bei einigen Patienten bis zu einer Woche an [38]. Diese Ergebnisse konnten in einer Phase-II-Studie erhärtet werden, in der 24 Patienten cross-over jeweils mit Placebo, 50 % oder 25 % N2O behandelt wurden [40]. Die antidepressiven Effekte dauerten hier zwischen zwei und vier Wochen an. Bemerkenswerterweise zeigte sich die Wirksamkeit von 25%igem N2O gleichwertig zu der von 50%igem N2O, wobei in der niedrigen Konzentration rund viermal weniger unerwünschte Wirkungen auftraten. Die kleine Teilnehmerzahl und die durch die dissoziative Wirkung auftretende weitgehende Entblindung der Teilnehmer werden von den Autoren als limitierende Faktoren diskutiert [40]. Auch diese Autoren konnten im Rahmen von Heilversuchen positive Erfahrungen bei Therapieresistenz machen.
Bewertung und Ausblick
Aufgrund der begrenzten Wirksamkeit und Stagnation der Psychopharmakotherapie in den letzten Jahren ist der Bedarf an innovativen Behandlungsmethoden hoch. Psychedelische Substanzen erscheinen durch ihre einzigartige Wirkungsweise und ihr Zusammenspiel mit psychotherapeutischen Mechanismen vielversprechend. Trotz wichtiger Limitationen wie möglicher funktioneller Entblindung und Erwartungseffekten zeigen eine Reihe von Phase-II-Studien für klassische Psychedelika und andere Substanzen wie N2O vielversprechende therapeutische Effekte bei häufigen psychischen Erkrankungen wie der rezidivierenden depressiven Störung. Insbesondere bei Ketamin führte die breite Evidenz zur schnellen antidepressiven Wirksamkeit bereits zu einer Zulassung zur Behandlung therapieresistenter Depressionen. Gerade in Bezug auf die klassischen Psychedelika scheint jedoch die mediale Berichterstattung und Euphorie teilweise über das hinauszugehen, was durch die bisher limitierte Evidenz gerechtfertigt wäre. Beschleunigt wird diese Entwicklung durch das große wirtschaftliche Interesse und Investitionen in diesen aussichtsreichen und wachstumsstarken Markt [48]. Gleichzeitig zeigen sich Parallelen zu problematischen Entwicklungen der 60er- und 70er-Jahre. In den USA nimmt der nichtmedizinische Gebrauch psychedelischer Substanzen zu und geschieht teils in sogenannten „brain wellness clinics“, in denen die Substanzen off-Label verschrieben werden [75]. Die Geschichte hat gezeigt, dass ein unbedachter, unkritischer Umgang sowie die Idealisierung von Psychedelika zu gesellschaftlichen Problemen führen können. Es wird daher darauf ankommen, mit weiteren größeren Studien nach strengen wissenschaftlichen Standards weitere Evidenz zu klinischer Wirksamkeit, Wirkungsmechanismen und zur bestmöglichen psychotherapeutischen Begleitung zu sammeln. Die Implementierung von Sicherheitsstandards, ethischen Richtlinien und adäquater Therapeutenausbildung werden dabei entscheidende Faktoren bleiben. Werden diese Risiken und Limitationen beachtet, haben Psychedelika und die neurowissenschaftliche Untersuchung der durch sie ausgelösten veränderten Bewusstseinszustände das Potenzial, unser Verständnis von psychiatrischen Erkrankungen und den neurobiologischen Grundlagen des menschlichen Bewusstseins nachhaltig zu erweitern. Aufbauend auf ihre teils Jahrhunderte lange Tradition könnte die sorgfältig bedachte Anwendung dieser Substanzen in einen modernen klinischen Rahmen integriert werden und für eine Vielzahl an Patienten langerwartete neue Behandlungsoptionen bieten.
Interessenkonflikterklärungen
S. M. Halm und O. G. Bosch erklären, dass keine Interessenkonflikte vorliegen.
E. Seifritz: Beraterhonorare und Vortrags- oder Autorenhonorare von Angelini, Janssen, Lundbeck, Mepha, OM Pharma, Otsuka, Recordati, Schwabe, Sunovion und Takeda; Forschungsbeihilfe vom Schweizerischen Nationalfonds und der Universität Zürich; Verwaltungsratsmandate der Psychiatrischen Dienste Kanton St. Gallen und der Privatklinik Wyss AG, Psychiatrie Baselland sowie Aktien Abcellera
Literatur
1. Abbar M, Demattei C, El-Hage W, Llorca PM, et al. Ketamine for the acute treatment of severe suicidal ideation: double blind, randomised placebo controlled trial. BMJ 2022;376:e067194.
2. Acevedo-Diaz EE, Cavanaugh GW, Greenstein D, Kraus C, et al. Comprehensive assessment of side effects associated with a single dose of ketamine in treatment-resistant depression. J Affect Disord 2020;263:568–75.
3. Berman RM, Cappiello A, Anand A, Oren DA, et al. Antidepressant effects of ketamine in depressed patients. Biol Psychiatry 2000;47:351–4.
4. Bogenschutz MP, Forcehimes AA, Pommy JA, Wilcox CE, et al. Psilocybin-assisted treatment for alcohol dependence: a proof-of-concept study. J Psychopharmacol 2015;29:289–99.
5. Bosch OG, Halm S, Seifritz E. Psychedelics in the treatment of unipolar and bipolar depression. Int J Bipolar Disord 2022;10:1–16.
6. Bruhn JG, De Smet PAGM, El-Seedi HR, Beck O. Mescaline use for 5700 years. Lancet 2002;359:1866.
7. Carhart-Harris R, Giribaldi B, Watts R, Baker-Jones M, et al. Trial of psilocybin versus escitalopram for depression. N Engl J Med 2021;384:1402–11.
8. Carhart-Harris RL, Bolstridge M, Rucker J, Day CMJ, et al. Psilocybin with psychological support for treatment-resistant depression: an open-label feasibility study. Lancet Psychiatry 2016;3:619–27.
9. Carhart-Harris RL, Erritzoe D, Williams T, Stone JM, et al. Neural correlates of the psychedelic state as determined by fMRI studies with psilocybin. Proc Natl Acad Sci U S A 2012;109:2138–43.
10. Carhart-Harris RL, Friston KJ. REBUS and the anarchic brain: Toward a unified model of the brain action of psychedelics. Pharmacol Rev 2019;71:316–44.
11. Carhart-Harris RL, Leech R, Hellyer PJ, Shanahan M, et al. The entropic brain: A theory of conscious states informed by neuroimaging research with psychedelic drugs. Front Hum Neurosci 2014;8:20.
12. Carhart-Harris RL, Roseman L, Bolstridge M, Demetriou L, et al. Psilocybin for treatment-resistant depression: fMRI-measured brain mechanisms. Sci Reports 2017;7:1–11.
13. Cressey D. Psychopharmacology in crisis. Nature 2011 Jun 14.
14. Darke S, Duflou J, Farrell M, Peacock A, et al. Characteristics and circumstances of death related to the self-administration of ketamine. Addiction 2021;116:339–45.
15. Davis AK, Barrett FS, May DG, Cosimano MP, et al. Effects of psilocybin-assisted therapy on major depressive disorder: A randomized clinical trial. JAMA Psychiatry 2021;78:481–9.
16. De Osório FL, Sanches RF, Macedo LR, dos Santos RG, et al. Antidepressant effects of a single dose of ayahuasca in patients with recurrent depression: a preliminary report. Rev Bras Psiquiatr 2015;37:13–20.
17. Dolder PC, Schmid Y, Müller F, Borgwardt S et al. LSD acutely impairs fear recognition and enhances emotional empathy and sociality. Neuropsychopharmacology 2016;41:2638–46.
18. Fukagawa H, Koyama T, Fukuda K. κ-Opioid receptor mediates the antinociceptive effect of nitrous oxide in mice. BJA Br J Anaesth 2014;113:1032–8.
19. Gable RS. Risk assessment of ritual use of oral dimethyltryptamine (DMT) and harmala alkaloids. Addiction 2007;102:24–34.
20. Grabski M, McAndrew A, Lawn W, Marsh B, et al. Adjunctive ketamine with relapse prevention-based psychological therapy in the treatment of alcohol use disorder. Am J Psychiatry 2022;179:152–62.
21. Gukasyan N, Nayak SM. Psychedelics, placebo effects, and set and setting: Insights from common factors theory of psychotherapy. Transcult Psychiatry 2021;1363461520983684.
22. Hamill J, Hallak J, Dursun SM, Baker G. Ayahuasca: Psychological and physiologic effects, pharmacology and potential uses in addiction and mental illness. Curr Neuropharmacol 2018;17:108–28.
23. Hermle L, Fünfgeld M, Oepen G, Botsch H, et al. Mescaline-induced psychopathological, neuropsychological, and neurometabolic effects in normal subjects: Experimental psychosis as a tool for psychiatric research. Biol Psychiatry 1992;32:976–91.
24. Houle SKD, Evans D, Carter CA, Schlagenhauf P. Ayahuasca and the traveller: A scoping review of risks and possible benefits. Travel Med Infect Dis 2021;44:102206.
25. Jelen AL, Young AH, Stone JM. Ketamine: a tale of two enantiomers. J Psychopharmacol 2021;35:109–23.
26. Johnson MW, Richards WA, Griffiths RR. Human hallucinogen research: guidelines for safety. J Psychopharmacol 2008;22:603–20.
27. Kamp J, Jonkman K, Velzen M van, Aarts L, et al. Pharmacokinetics of ketamine and its major metabolites norketamine, hydroxynorketamine, and dehydronorketamine: a model-based analysis. Br J Anaesth 2020;125:750–61.
28. Kraehenmann R, Preller KH, Bosch OG, Seifritz E, et al. Psilocybin-induced decrease in amygdala reactivity correlates with enhanced positive mood in healthy volunteers. Biol Psychiatry 2015;78:572–81.
29. Lieberman JA. Back to the future – the therapeutic potential of psychedelic drugs. N Engl J Med 2021;384:1460–1.
30. Lin R, Chen H, Chang Y, Su J. Subacute combined degeneration caused by nitrous oxide intoxication: case reports. Acta Neurol Taiwan 2011;20:129–37.
31. Ly C, Greb AC, Cameron LP, Wong JM, et al. Psychedelics promote structural and functional neural plasticity. Cell Rep 2018;23:3170.
32. Madsen MK, Fisher PM, Burmester D, Dyssegaard, et al. Psychedelic effects of psilocybin correlate with serotonin 2A receptor occupancy and plasma psilocin levels. Neuropsychopharmacology 2019;44:1328–34.
33. Miller MJ, Albarracin-Jordan J, Moore C, Capriles JM. Chemical evidence for the use of multiple psychotropic plants in a 1,000-year-old ritual bundle from South America. Proc Natl Acad Sci U S A 2019;166:11207–12.
34. Millière R. Looking for the self: Phenomenology, neurophysiology and philosophical significance of drug-induced ego dissolution. Front Hum Neurosci 2017;11:245
35. Mueller F, Lenz C, Dolder PC, Harder S, et al. Acute effects of LSD on amygdala activity during processing of fearful stimuli in healthy subjects. Transl Psychiatry 2017;7: e1084.
36. Muetzelfeldt L, Kamboj S, Rees H, Taylor J, et al. Journey through the K-hole: phenomenological aspects of ketamine use. Drug Alcohol Depend 2008;95:219–29.
37. Müller F, Dolder PC, Schmidt A, Liechti ME. Altered network hub connectivity after acute LSD administration. NeuroImage Clin 2018;18:694–701.
38. Nagele P, Duma A, Kopec M, Gebara MA, et al. Nitrous oxide for treatment-resistant major depression: A proof-of-concept trial. Biol Psychiatry 2015;78:10–8.
39. Nagele P, Metz LB, Crowder CM. Nitrous oxide (N2O) requires the N-methyl-D-aspartate receptor for its action in Caenorhabditis elegans. Proc Natl Acad Sci U S A 2004;101:8791–6.
40. Nagele P, Palanca BJ, Gott B, Brown F, et al. A phase 2 trial of inhaled nitrous oxide for treatment-resistant major depression. Sci Transl Med 2021;13:eabe1376.
41. Nichols DE, Grob CS. Is LSD toxic? Forensic Sci Int; 284:141–5.
42. Nichols DE. Psychedelics. Pharmacol Rev 2016;68:264–355.
43. Nour MM, Evans L, Nutt D, Carhart-Harris RL. Ego-dissolution and psychedelics: Validation of the ego-dissolution inventory (EDI). Front Hum Neurosci 2016;10:269.
44. Palhano-Fontes F, Barreto D, Onias H, Andrade KC, et al. Rapid antidepressant effects of the psychedelic ayahuasca in treatment-resistant depression: a randomized placebo-controlled trial. Psychol Med 2019;49:655–63.
45. Passie T, Halpern JH, Stichtenoth DO, Emrich HM, et al. The pharmacology of lysergic acid diethylamide: A review. CNS Neurosci Ther 2008;14:295–314.
46. Pavone KJ, Akeju O, Sampson AL, Ling K. Nitrous oxide-induced slow and delta oscillations. Clin Neurophysiol 2016;127:556–64.
47. Peltoniemi MA, Hagelberg NM, Olkkola KT, Saari TI. Ketamine: A review of clinical pharmacokinetics and pharmacodynamics in anesthesia and pain therapy. Clin Pharmacokinet 2016;55:1059.
48. Phelps J, Shah RN, Lieberman JA. The rapid rise in investment in psychedelics – cart before the horse. JAMA Psychiatry 2022;79:189–90.
49. Potocka-Banas B, Majdanik S, Dutkiewicz G, Borowiak K, et al. Death caused by addictive inhalation of nitrous oxide. Hum Exp Toxicol 2011;30:1875–7.
50. Preller K, Herdener M, Pokorny T, Planzer A, et al. The fabric of meaning and subjective effects in LSD-induced states depend on serotonin 2A receptor activation. Curr Biol 2017;27:451–7.
51. Preller KH, Pokorny T, Hock A, Seifritz E, et al. Effects of serotonin 2A/1A receptor stimulation on social exclusion processing. Proc Natl Acad Sci U S A 2016;113:5119–24.
52. Preller KH, Razi A, Friston KJ, Vollenweider FX. Effective connectivity changes in LSD-induced altered states of consciousness in humans. Proc Natl Acad Sci U S A 2019;116:2743–8.
53. Quednow BB, Kometer M, Geyer MA, Vollenweider FX. Psilocybin-induced deficits in automatic and controlled inhibition are attenuated by ketanserin in healthy human volunteers. Neuropsychopharmacology 2012;37:630–40.
54. Riba J, Rodríguez-Fornells A, Barbanoj MJ. Effects of ayahuasca on sensory and sensorimotor gating in humans as measured by P50 suppression and prepulse inhibition of the startle reflex, respectively. Psychopharmacology (Berl) 2002;165:18–28.
55. Riba J, Valle M, Urbano G, Yritia M, Morte A, et al. Pharmacology of Ayahuasca: subjective and cardiovascular effects, monoamine metabolite excretion, and pharmacokinetics. J Pharmacol Exp Ther 2003;306:73–83.
56. Roseman L, Nutt DJ, Carhart-Harris RL. Quality of acute psychedelic experience predicts therapeutic efficacy of psilocybin for treatment-resistant depression. Front Pharmacol 2018;8:974.
57. Ross S, Bossis A, Guss J, Agin-Liebes G, Malone T, et al. Rapid and sustained symptom reduction following psilocybin treatment for anxiety and depression in patients with life-threatening cancer: a randomized controlled trial. J Psychopharmacol 2016;30:1165–80.
58. Sanches RF, De Lima Osório F, Santos RGD, Macedo LRH, et al. Antidepressant effects of a single dose of Ayahuasca in patients with recurrent depression: A SPECT study. J Clin Psychopharmacol 2016;36:77–81.
59. Sassano-Higgins S, Baron D, Juarez G, Esmaili N, Gold M. A review of ketamine abuse and diversion. Depress Anxiety 2016;33:718–27.
60. Schenberg EE. Psychedelic-assisted psychotherapy: A paradigm shift in psychiatric research and development. Front Pharmacol 2018;9:733.
61. Schlag AK, Aday J, Salam I, Neill JC, Nutt DJ. Adverse effects of psychedelics: From anecdotes and misinformation to systematic science. J Psychopharmacol 2022;36:258–72.
62. Short B, Fong J, Galvez V, Shelker W, Loo CK. Side-effects associated with ketamine use in depression: a systematic review. Lancet Psychiatry 2018;5: 65–78.
63. Smigielski L, Scheidegger M, Kometer M, Vollenweider FX. Psilocybin-assisted mindfulness training modulates self-consciousness and brain default mode network connectivity with lasting effects. Neuroimage 2019;196:207–15.
64. Stroud JB, Freeman TP, Leech R, Nutt DJ, et al. Psilocybin with psychological support improves emotional face recognition in treatment-resistant depression. Psychopharmacology (Berl) 2018;235:459–66.
65. Studerus E, Kometer M, Hasler F, Vollenweider FX. Acute, subacute and long-term subjective effects of psilocybin in healthy humans: a pooled analysis of experimental studies. J Psychopharmacol 2011;25:1434–52.
66. Valle M, Maqueda AE, Rabella M, Romero S, et al. Inhibition of alpha oscillations through serotonin-2A receptor activation underlies the visual effects of ayahuasca in humans. Eur Neuropsychopharmacol 2016;26:1161–75.
67. Vankawala J, Naples G, Avila-Quintero VJ, Ramírez KL, et al. Meta-analysis: hemodynamic responses to sub-anesthetic doses of ketamine in patients with psychiatric disorders. Front Psychiatry 2021;12:549080.
68. Vollenweider FX, Leenders KL, Scharfetter C, Maguire P, et al. Positron emission tomography and fluorodeoxyglucose studies of metabolic hyperfrontality and psychopathology in the psilocybin model of psychosis. Neuropsychopharmacology 1997;16:357–72.
69. Vollenweider FX, Preller KH. Psychedelic drugs: neurobiology and potential for treatment of psychiatric disorders. Nat Rev Neurosci 2020;21:611–24.
70. Vollenweider FX, Vollenweider-Scherpenhuyzen MFI, Hell D, et al. Psilocybin induces schizophrenia-like psychosis in humans via a serotonin-2 agonist action. Neuroreport 1998;9:3897–902.
71. Wallace M, Brenner A. How people change: Relationships and neuroplasticity in psychotherapy. J Psychiatr Pract 2019;25:71–2.
72. Wasson RG. The wondrous mushroom: mycolatry in Mesoamerica. New York: McGraw-Hill, 1980.
73. Watts R, Day C, Krzanowski J, Nutt D, Carhart-Harris R. Patients’ accounts of increased “connectedness” and “acceptance” after psilocybin for treatment-resistant depression. J Humanist Psychol 2017;57:520–64.
74. Watts R, Luoma JB. The use of the psychological flexibility model to support psychedelic assisted therapy. J Context Behav Sci 2020;15:92–102.
75. Wexler A, Sisti D. Brain wellness “spas”-anticipating the off-label promotion of psychedelics. JAMA Psychiatry 2022;79:748.
76. WHO model list of essential medicines – 22nd list, 2021. https://www.who.int/publications/i/item/WHO-MHP-HPS-EML-2021.02 (Zugriff am 04.09.2022).
77. Yavi M, Lee H, Henter ID, Park LT, Zarate CA. Ketamine treatment for depression: a review. Discov Ment Health 2022;2:9.
78. Zanos P, Gould TD. Mechanisms of ketamine action as an antidepressant. Mol Psychiatry 2018;23:801–11.
Simon Halm, Priv.-Doz. Dr. med. Oliver G. Bosch, Prof. Dr. med. Erich Seifritz, Klinik für Psychiatrie, Psychotherapie und Psychosomatik, Psychiatrische Universitätsklinik Zürich, Lenggstrasse 31, 8032 Zürich, Schweiz, E-Mail: simon.halm@pukzh.ch
Psychedelics in psychopharmacotherapy
After a hiatus of many years the interest in psychedelic substances in clinical application as well as in neurobiological and psychotherapy research is rising again. Classical psychedelics primarily act via the serotonin 5-HT2A receptor and induce characteristic alterations in sensory perception, social-, emotion-, and self-processing. They include lysergic acid diethylamide (LSD), psilocybin, and ayahuasca. Other consciousness-altering substances with different modes of action are called atypical psychedelics and comprise ketamine and laughing gas (N2O) among others. The ketamine enantiomer esketamine has been granted international approval for treatment-resistant depression. Further randomized, controlled phase II trials show promising results in the treatment of unipolar depression especially for psilocybin but also for N2O and ayahuasca. The new paradigm of psychedelic-assisted psychotherapy suggests a therapeutic framework in which a safely conducted psychedelic experience is integrated into a continuous psychotherapeutic process. This narrative review provides an overview over the clinically relevant psychedelic substances and their neurobiological and psychic mechanisms of action. If classical and atypical psychedelics will be able to fulfill their expectations and find their way into broader clinical use, will depend on future rigorous clinical trials with larger sample sizes.
Key words: Psychedelic therapy, substance-assisted psychotherapy, hallucinogens, psycholysis
Psychopharmakotherapie 2022; 29(06):207-218
