Wilfried Kuhn, Schweinfurt, Thomas Müller, Berlin, Andrzej Dekundy, Wojciech Danysz, Frankfurt/M., und Peter Riederer, Würzburg
Der Nachweis einer antiviralen Wirksamkeit führte zur Zulassung von Amantadin als Anti-Influenza-A2-Medikament („asiatische Grippe“) [14, 21] und dann etwa zehn Jahre später als Influenza-A-Prophylaxe. Tabelle 1 dokumentiert die wichtigsten Entdeckungen und Entwicklungen im Zusammenhang mit Amantadin von 1963 bis heute [12]. Wenige Jahre später nahm eine Parkinson-Patientin als Grippeprophylaxe über sechs Wochen zweimal täglich eine Tablette Amantadinhydrochlorid (200 mg/Tag) zu sich und beobachtete eine deutliche Verbesserung ihrer motorischen Störungen. Dies veranlasste Schwab et al. zur Durchführung einer klinischen Studie mit 163 Patienten mit Morbus Parkinson (MP) [61]. Diese und andere Untersuchungen in den darauffolgenden Jahren bestätigten in Summe einen mäßigen bis mittelstarken Effekt von Amantadin insbesondere auf die Kardinalsymptome Rigor und Bradykinese. Als günstig hat sich dabei die Kombination mit Levodopa erwiesen. In der klinischen Praxis wird Amantadin in oraler Form primär in frühen und mittleren Stadien der Erkrankung als symptomatische Therapie eingesetzt. In späteren Stadien, insbesondere beim Auftreten von akinetischen Krisen kann die Substanz auch in Form von Amantadinsulfat parenteral appliziert werden. In den letzten Jahren konzentrierte sich das wissenschaftlich-klinische Interesse insbesondere auf die Behandlung von Levodopa-induzierten Fluktuationen und Dyskinesien mit Amantadin. Neben der Behandlung des MP hat sich in der Neurologie die Behandlung von Vigilanzstörungen bei diversen – meist intensivpflichtigen – neurologischen Erkrankungen etabliert [6, 25]. Seit Jahren ist zudem das präklinisch nachgewiesene neuro- und zellprotektive Potenzial von Amantadin in der Diskussion. Die vielfältigen biochemischen Angriffspunkte von Amantadin ermöglichen zahlreiche therapeutische Optionen bei anderen neurologisch-psychiatrischen Erkrankungen [12]. Von besonderem Interesse ist aufgrund der aktuellen Pandemie das antivirale Potenzial von Amantadin bei Patienten mit COVID-19 [7, 57].
Tab. 1. Chronologie der wichtigsten Entdeckungen und Entwicklungen im Zusammenhang mit Amantadin (modifiziert nach [12])
|
Jahr |
Beschreibung der Entdeckung |
Autoren [Literatur] |
|
1963 |
Erstmalige Beschreibung von Amantadin als Medikament – antivirale Wirkung |
Gerzon et al. [21] |
|
1966 |
Amantadin (Symmetrel) von E.I. du Pont de Nemours & Company von der FDA zugelassen in den USA zur Vorbeugung von Influenza A2 |
Hubsher et al. [26] Maugh [47] |
|
1969 |
Erstmalige Beschreibung der Antiparkinson-Wirkung auf der Grundlage einer Fallbeobachtung (1968) durch eine Patientin. Amantadin bei Virusinfektion |
Schwab et al. [61] |
|
1970 |
Registrierung durch Merz Pharmaceuticals als PK-Merz (Amantadinsulfat) zur Behandlung von Parkinson-Krankheit, Vigilanz und Neuralgie bei Herpes zoster |
Zimmermann [74] |
|
1971 |
Wirkung bei tardiver Dyskinesie |
Decker [15] |
|
1971 |
Wirkung auf die Chorea bei Morbus Huntington |
Scotti u. Spinnler [62] |
|
1973 |
Wirkung in akinetischen Krisen und akinetischen Endstadien von Patienten mit der Parkinson-Krankheit |
Danielczyk [10] |
|
1973 |
Zulassung von Amantadinhydrochlorid (Symmetrel) zur Behandlung der Parkinson-Krankheit |
Hubsher et al. [26] u. Maugh [47] |
|
1981 |
Antitremor-Aktivität |
Mayam [45] |
|
1989 |
Erster Bericht über die Bindung von NMDA-(N-Methyl-D-aspartat-)Rezeptoren durch Amantadin |
Kornhuber et al. [33] |
|
1989 |
Nützlichkeit bei traumatischen Hirnverletzungen (TBI) |
Gualtieri et al. [25] |
|
1991 |
Erster Nachweis des NMDA-Rezeptor-Antagonismus durch Amantadin |
Kornhuber et al. [32] |
|
1993 |
Bindung an Sigma-Rezeptoren |
Kornhuber et al. [34] |
|
1997 |
Wirkung bei Levodopa-induzierten Dyskinesien |
Rajput et al. [56] |
|
2020 |
Zulassung von Gocovri (ADS-1502, Adamas Pharma) in den USA zur Behandlung von Levodopa-induzierten Dyskinesien |
Adamas [1] |
Pharmakologie
Amantadin gehört zur Gruppe der Adamantanamine. Diese Substanzen bestehen aus einer polaren Aminogruppe und einem diamantähnlichen apolaren Kohlenwasserstoffskelett (Abb. 1). Die Erstsynthese von Amantadin wurde 1960 beschrieben [65]. Amantadin überwindet zügig die Blut-Hirn-Schranke und wird mit dem Urin ausgeschieden. Zwei Amantadinsalze sind aktuell auf dem Markt erhältlich. Amantadinhydrochlorid wurde 1966 von Dupont als Symmetrel eingeführt. Die Zulassung erfolgte zur Vorbeugung von Influenza A2. Vier Jahre später konnte Merz Pharmaceuticals Amantadinsulfat zur Behandlung von MP, Vigilanzstörungen und Zosterneuralgie auf den Markt bringen (Tab. 1).
Abb. 1. Chemische Struktur von Amantadin (1-Amino-Adamantan)
Pharmakokinetik
Amantadinhydrochlorid wird oral verabreicht. Maximale Blutspiegel werden zwischen ein und vier Stunden erreicht, mit einer Halbwertszeit von etwa 15 Stunden bei gesunden Patienten [3]. Amantadinsulfat kann oral und intravenös verabreicht werden. Die Ergebnisse einer klinischen Anwendungsstudie mit 102 Patienten deuten auf eine bessere Wirksamkeit und medizinische Verträglichkeit von Amantadinsulfat im Vergleich zum Hydrochlorid hin [55]. Dies könnte auf unterschiedliche pharmakokinetische Eigenschaften zurückzuführen sein, die in einer Studie mit acht gesunden Teilnehmern nach Einnahme von 100 mg beider Formulierungen ermittelt wurden. Die tmax war bei Amantadinsulfat im Vergleich zum Hydrochlorid erhöht und die Cmax reduziert [48, 49]. Grund dafür ist die geringere Löslichkeit von oralem Amantadinsulfat im Vergleich zum Hydrochloridsalz. Dadurch kommt es zu einer langsameren Absorption im Magen-Darm-Trakt. Deshalb sind die Dosierungsempfehlungen unterschiedlich. Amantadinhydrochlorid sollte über vier bis sieben Tage auf bis zu 200 mg/Tag dosiert werden. Im Gegensatz dazu können 200 mg Amantadinsulfat bereits initial gegeben werden und je nach Patient auf bis zu 600 mg/Tag gesteigert werden. Wegen einer zunehmenden Vigilanzsteigerung im Laufe des Tages und möglicher nachfolgender Schlafstörungen oder auch gelegentlich auftretender Verwirrtheitszustände sollte die Hauptdosis in der ersten Tageshälfte (z. B. morgens und mittags) verabreicht werden. Dosisabhängige Plasma-/Serum-/Gewebekonzentrationen von Amantadin in Studien an Ratten, Mäusen und Makaken sowie Menschen wurden erst 2021 ausführlich referiert [12]. In Dosisbereichen von 50 mg bis 600 mg per os liegt die Plasma-/Serumkonzentration zwischen 0,59 und 11 μmol/l; in der Zerebrospinalflüssigkeit wurden Dosierungen von 200 mg und 300 mg geprüft, die Amantadinkonzentration lag hier zwischen 1,3 und 9,5 μmol/l. Post-mortem-Gehirnanalysen ergaben für diesen Dosisbereich Amantadin-Konzentrationen von 159 bis 281 μmol/l.
Pharmakodynamik
Zum Wirkungsmechanismus von Amantadin liegen inzwischen zahlreiche Daten vor. Präklinische Studien belegen Interaktionen von Amantadin mit intra- und extrazellulären molekularen Zielen wie Enzymen und Rezeptoren [12]. Bemerkenswert ist eine, verglichen mit der Plasmakonzentration, 10- bis 20-mal höhere intrazelluläre Konzentration, welche auf die lysosomale Bindung zurückgeführt wird [12, 35].
Unter Berücksichtigung dieses Aspekts haben Danysz et al. die biochemischen Zielparameter von Amantadin bei Affinitäten im therapeutischen Konzentrationsbereich zusammengestellt [12].
So konnte in vitro eine direkte und indirekte Modulation des dopaminergen Systems im Gehirn nachgewiesen werden [4]. Präsynaptische wie postsynaptische Wirkungen an dopaminergen Terminalen wie auch die Freisetzung von intraneuronalem Dopamin aus extravesikulären Speichern sind ebenso belegt wie auch eine durch Amantadin via Sigma-1-Rezeptoren induzierte Tyrosinhydroxylase-Aktivität mit konsekutiv vermehrter Bereitstellung von Dopamin [41]. Amantadin erhöht auch die Expression der mRNA der Aromatische-Aminosäuredecarboxylase in Phäochromozytom-Zellen (PC 12) um 70 %. Dies bewirkt eine vermehrte Dopaminsynthese mit vermehrter synaptischer Freisetzung [73]. Von Bedeutung für den Wirkungsmechanismus von Amantadin ist auch die Fähigkeit der Hemmung des N-Methyl-D-aspartat(NMDA)-Subtyps der Glutamatrezeptoren [32]. NMDA-Antagonisten blockieren die Überaktivität des Nucleus subthalamicus, steigern zudem die Dopaminfreisetzung und den Dopaminumsatz im Striatum und schützen nigrale Neuronen in bestimmten Tiermodellen vor dem Absterben [23]. Darüber hinaus konnte beobachtet werden, dass NMDA-Rezeptorantagonisten Levodopa-induzierte motorische Fluktuationen im MPTP-Parkinsonmodell umkehren oder zumindest reduzieren können [53]. Präklinische als auch klinische Daten und Beobachtungen deuten zudem auf eine leichte anticholinerge Wirkung von Amantadin hin, die bisher noch nicht im Detail erklärt werden kann [51]. Diese und zahlreiche andere, zum Teil widersprüchliche In-vitro-Befunde zum Wirkungsmechanismus von Amantadin via NMDA-Rezeptoren veranlassten Danysz et al. in einer Übersichtsarbeit deshalb zu der Schlussfolgerung, dass der NMDA-Antagonismus zwar möglicherweise dosisabhängig zur klinischen Wirkung beiträgt, aber letztlich nicht als Hauptmechanismus anzusehen ist [12]. Neben den genannten biochemischen Interaktionen scheinen bisher wenig beachtete In-vitro-Befunde doch von größerer Bedeutung für die Amantadin-Effekte zu sein als bisher vermutet. So könnte die bereits erwähnte Affinität zum Sigma-1-Rezeptor via einer NMDA-Rezeptormodulation nicht nur für die symptomatischen, sondern auch für die zumindest in vitro belegten neuroprotektiven Effekte von Amantadin verantwortlich sein. Zumindest konnte gezeigt werden, dass Sigma-1-Rezeptoren neuroprotektive Prozesse induzieren können [34]. Die mögliche Bedeutung anderer nachgewiesener biochemischer Interaktionen von Amantadin, beispielsweise der Antagonismus von Nikotinrezeptoren via einer Hemmung der Calmodulin-abhängigen Phosphodiesterase 1 oder die Stimulation der Ausschüttung des neurotrophen Faktors GDNF (Glial-cell-derived neurotrophic factor), muss derzeit spekulativ bleiben [12].
Zusammenfassend bleibt festzuhalten, dass die unterschiedlichen klinischen Wirkungen von Amantadin nicht auf einzelne Mechanismen, sondern vielmehr auf eine Kombination diverser molekularer Prozesse zurückzuführen sind. Vorzugsweise beeinflusst Amantadin (1) die Aromatische-Aminosäure-Decarboxylase, (2) Sigma-1-Rezeptoren, (3) nikotinerge Rezeptoren, (4) die Phosphodiesterase PDE 1 und (5) GDNF. Dosisabhängig sind auch andere Targets wahrscheinlich, beispielsweise ein NMDA-Antagonismus, ein serotoninerger 5-HT3-Antagonismus und eine Kaliumkanal-Blockade (Abb. 2 und 3). In experimentellen Studien zeigt Amantadin neuroprotektive Eigenschaften, basierend auf antioxidativen und antiinflammatorischen Daten. Zu Details sei auf die ausführliche Publikation von Danysz et al. verwiesen [12].
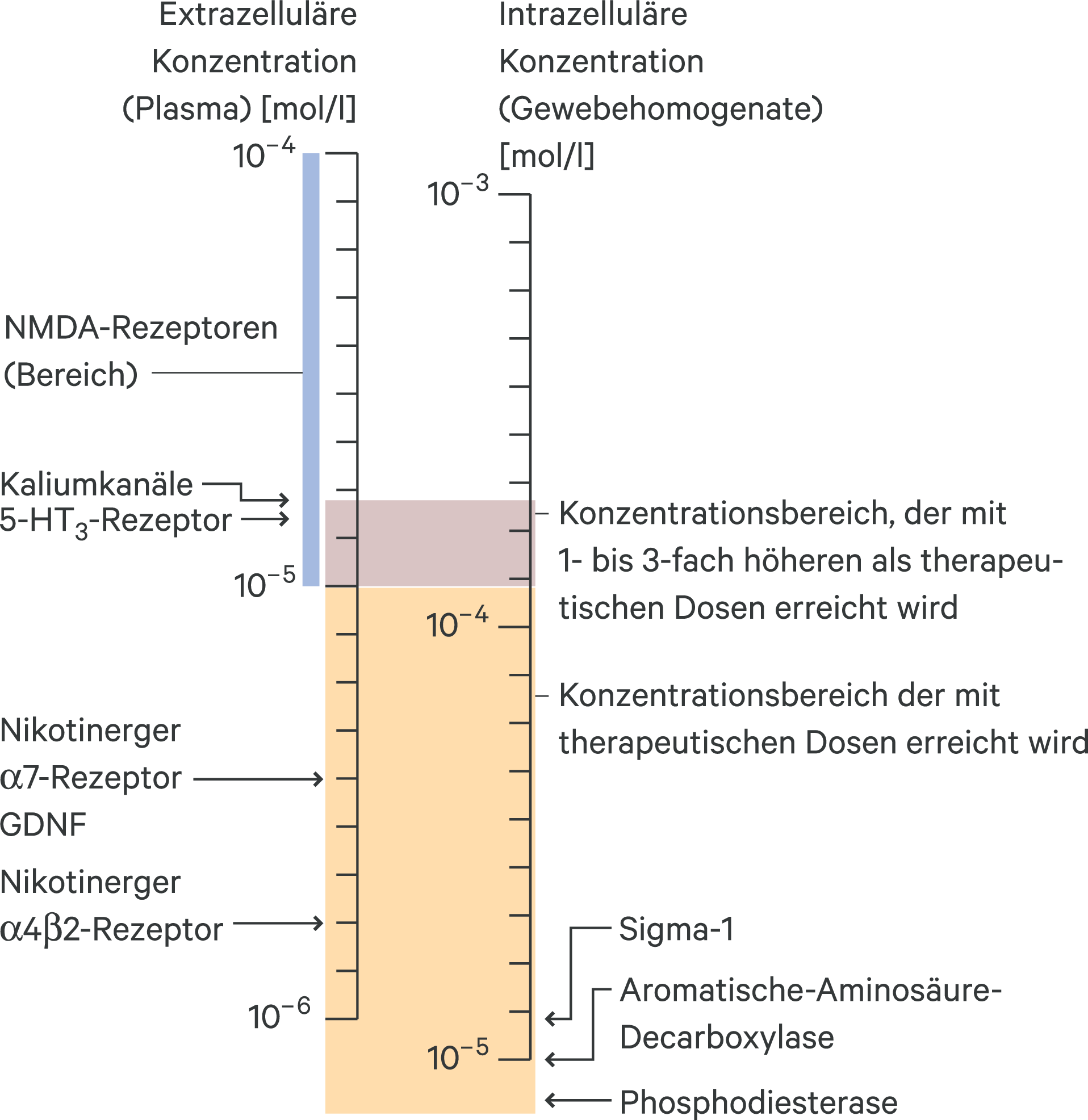
Abb. 2. Die wichtigsten pharmakologischen Wirkungsmechanismen von Amantadin. Diese basieren auf In-vitro-Aktivitäten und -Konzentrationen, die extrazellulär bzw. intrazellulär bei therapeutischer Dosierung erreicht werden (nach [12])
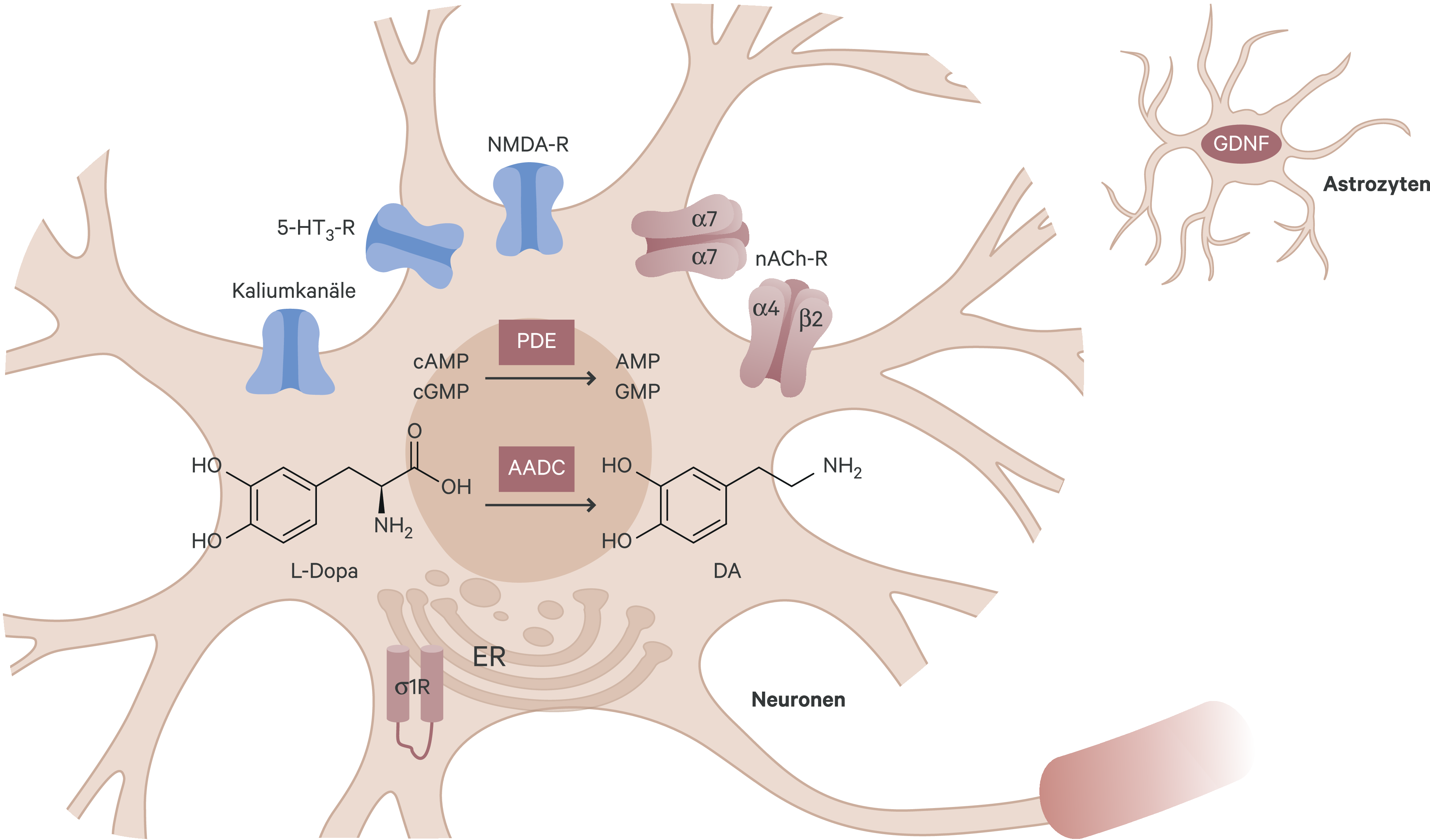
Abb. 3. Schema zur Darstellung der zellulären Lokalisation von Wirkungsmechanismen von Amantadin (nach [12]) Rot: wahrscheinlicher Wirkungsmechanismus; Blau: möglicher Wirkungsmechanismus
Klinische Wirksamkeit bei M. Parkinson
Nach der Entdeckung der Antiparkinson-Wirkung von Amantadin führten Schwab et al. eine große unkontrollierte Studie durch [61]. Zwei Drittel der Patienten zeigten eine Besserung bei einer Höchstdosis von 100 mg zweimal täglich. Bei einem Drittel dieser Patienten kam es nach vier bis acht Behandlungswochen zu einem langsamen, stetigen Rückgang, während bei den übrigen Patienten eine länger anhaltende Besserung über drei bis acht Monate eintrat. In einer Placebo-kontrollierten Cross-over-Studie stellte Savery fest, dass bei 42 Patienten (Hoehn- und-Yahr-Stadien 2 bis 4), die Levodopa einnahmen, 95 % eine Verbesserung durch 100 bis 200 mg Amantadinhydrochlorid pro Tag erfuhren [60]. Spätere Studien haben die Wirksamkeit von Amantadin bestätigt, obwohl Uneinigkeit über die Dauer des Nutzens und zum Teil auch darüber besteht, welche Symptome am besten ansprechen [39]. Koller stellte beispielsweise fest, dass Amantadin den Tremor um 23 % reduzierte, während mit Trihexyphenidyl und Levodopa eine Besserung um 59 % bzw. 55 % erreicht wurde [37]. Mehrere Studien und klinische Erfahrungen haben jedoch bestätigt, dass Bradykinesie und Rigor bei den meisten Patienten besser ansprechen als der Tremor. Darüber hinaus besserten sich vielfach auch das Allgemeinbefinden, die Stimmung, der Antrieb, kognitive Störungen und unter anderem auch ein vermehrter Speichelfluss [52]. Vorteile der oralen Applikation von Amantadin sind ein rascher Wirkungseintritt, die einfache Dosierung, eine gute Verträglichkeit und das günstige Nebenwirkungsprofil. Die meisten der Studien zu MP wurden in den 70er-Jahren durchgeführt und weisen methodische Mängel auf. In einem Cochrane-Review aus dem Jahr 2003 wurden sechs randomisierte kontrollierte Studien beschrieben, in denen Amantadin entweder als Mono- oder als Zusatztherapie bei Parkinson-Krankheit eingesetzt wurde. Obwohl alle Studien über positive Auswirkungen von Amantadin berichteten, kamen die Autoren zu dem Schluss, dass die vorliegenden Daten nicht ausreichen, um eindeutige Schlussfolgerungen zu ziehen [9].
Akinetische Krisen
In der klinischen Praxis hat sich Amantadin neben der oralen Kombinationstherapie mit Levodopa insbesondere als Notfallmedikament bei akinetischen Krisen bewährt [11]. Diese können bevorzugt im Spätstadium der Erkrankung auftreten und sind zeitweise über Tage mit einer andauernden Unterbeweglichkeit verbunden. Psychophysisch belastende Situationen, Infekte, Operationen oder plötzliches Absetzen der Medikamente können auslösende Faktoren sein. Wirksam ist neben Zusatzmaßnahmen (z. B. Flüssigkeitszufuhr) eine intravenöse Behandlung mit Amantadinsulfat ein- bis zweimal pro Tag über drei bis sechs Stunden für sieben bis zehn Tage. Klinische Beobachtungen lassen vermuten, dass gelegentlich auftretende Halluzinationen und Verwirrtheitszustände durch eine gleichzeitig weitergeführte Levodopa-Therapie gefördert werden [11]. In Anbetracht aller klinischen Daten und Erfahrungen besteht kein Zweifel daran, dass Amantadin eine moderate bis mittelstarke Wirkung entfalten kann und für die Behandlung insbesondere von Rigor und Bradykinese sowohl in frühen, wie auch partiell in fortgeschrittenen Stadien der Parkinson-Krankheit empfohlen werden.
On-Off-Fluktuationen und Freezing
Im Laufe der langjährigen Levodopa-Therapie können – abhängig unter anderem von der Höhe der Levodopa-Dosis – sogenannte On-Off-Fluktuationen, verbunden mit Dyskinesien (Hyperkinesien) auftreten. Die Verbesserung dieser Levodopa-abhängigen motorischen Komplikationen durch Amantadin wurde 1987 erstmals beschrieben [64]. Diese Beobachtungen konnten in einer doppelblinden, Placebo-kontrollierten Cross-over-Studie mit 14 Patienten bestätigt werden. Sowohl die Spitzenwerte von Dyskinesien als auch die Schwere der Off-Phasen konnten um 60 % reduziert werden [24]. Eine neuere randomisierte kontrollierte Studie untersuchte über einen Zeitraum von zwölf Monaten die antidyskinetische Wirkung von 300 mg Amantadinhydrochlorid bei 40 Parkinson-Patienten im Vergleich zu Placebo und stellte eine 45 %ige Verringerung des Gesamtdyskinesie-Scores fest [67]. Allerdings hielt der Nutzen bei den 20 Patienten, die Amantadin einnahmen, nur drei bis acht Monate an. Eine multivariate logistische Analyse zeigte, dass ein höheres Alter bei Krankheitsbeginn und die Einnahme von Dopaminagonisten positiv mit dem Ansprechen auf Amantadin verbunden waren [9]. Obwohl die Wirksamkeit von Amantadin bei speziellen Formen der Dyskinesie (Beindystonie, Spitzendosis) nicht ganz klar ist, liegen zahlreiche Befunde vor, die für eine Empfehlung von Amantadin bei der Behandlung von Dyskinesien sprechen. Diese Daten unterstützen frühere Laborstudien, die die antidyskinetische Wirkung von Amantadin mit dem NMDA-Rezeptor-Antagonismus in Verbindung brachten [53]. Die neue Zulassung von GocovriTM explizit für Dyskinesien und Off-time-Behandlung und von Osmolex ERTM für medikamenteninduzierte extrapyramidale Symptome in den USA unterstreicht diese therapeutische Option (s. u.) [1]. Hierbei handelt es sich um galenische Darreichungsformen mit verzögerter Freisetzung.
Neben der Dyskinesie bei fortgeschrittener Parkinson-Krankheit ist auch das Einfrieren des Gangs (Freezing of gait, FOG) ein häufiges Symptom, das eine Hauptursache für Behinderungen und Stürze darstellt. In einer kürzlich durchgeführten Studie erhielten elf Patienten (Hoehn-und-Yahr-Stadium 2 bis 4) Amantadinhydrochlorid 100 mg zweimal täglich über einen Zeitraum von 20 Monaten (Mittelwert). Zehn von elf Patienten berichteten über eine Verbesserung nach Beginn der Amantadin-Behandlung, aber dieser Effekt war hauptsächlich vorübergehend [44]. Weitere Studien sind in Vorbereitung, um die Wirkung von FOG zu ergründen.
Weitere Wirkungen
Ein weiterer Grund für eine Behandlung mit Amantadin sind mögliche neuroprotektive Eigenschaften, welche die Progression von MP verlangsamen können. Uitti untersuchte die Krankenblätter aller Patienten, bei denen in einer neurologischen Klinik über 22 Jahre hinweg Parkinson-Symptome diagnostiziert wurden. Insgesamt waren dies 836 Fälle. Die Behandlung mit Amantadin erwies sich als unabhängiger Prädiktor für das Überleben [69]. Die Ergebnisse könnten entweder auf eine anhaltende symptomatische Verbesserung oder auf das Vorhandensein einer inhärenten Neuroprotektion hindeuten. Als mögliche Erklärung der Studiendaten wäre auch eine Reduktion von Infekten aufgrund der antiviralen Eigenschaften von Amantadin denkbar. Obwohl präklinische Befunde für ein neuroprotektives Potenzial von Amantadin via beispielsweise antioxidative, antientzündliche und antiglutamaterge Mechanismen sprechen, ist das retrospektive Design der Studie von Uitti nicht ausreichend, um Amantadin als Neuroprotektivum in der Praxis zu empfehlen.
Klinische Beobachtungen und Studien deuten zudem auch auf eine Wirksamkeit von Amantadin bei nichtmotorischen Störungen hin. In einer großen Querschnittsstudie (n = 728) zu Impulskontrollstörungen bei MP konnte eine positive Wirkung mit Amantadin assoziiert werden [72]. Außerdem kann die Substanz Vigilanz, Antrieb und Müdigkeit verbessern. Während die Verbesserung der Kardinalsymptome von MP primär durch indirekte dopaminerge Stimulationseffekte zu erklären ist, sind bei der Wirkung auf nichtmotorische Symptome wahrscheinlich auch antiglutamaterge Mechanismen von Bedeutung [12, 28].
Verträglichkeit
Ein klinischer Vorteil von Amantadin ist die gute Verträglichkeit und das günstige Nebenwirkungsprofil (Tab. 2). Livedo reticularis und Unterschenkelödeme werden gelegentlich beobachtet und erfordern nicht unbedingt das Absetzen des Arzneimittels. Andere mögliche Ursachen für Unterschenkelödeme sollten differenzialdiagnostisch abgeklärt werden. Wesentlich unangenehmer ist das Auftreten von psychischen Nebenwirkungen wie Verwirrtheit, Halluzinationen und Schlaflosigkeit. Auch hier könnten die neue Retard-Formulierung (Gocovri®) und das dadurch bedingte veränderte Dosierungsschema geeignet sein, diesen Effekten vorzubeugen [1]. Diese klingen in den meisten Fällen auch nach dem Absetzen von Amantadin wieder ab. Im Allgemeinen treten diese Symptome vor allem bei Personen auf, bei denen eine zerebrale Vorschädigung vorliegt. Auch die Kombination mit Anticholinergika und hohen Levodopa-Dosen kann das Risiko dafür erhöhen [71]. Daher ist eine vorsichtige Anwendung bei älteren Menschen und ein eventueller Verzicht auf die Applikation – auch bei Patienten mit leichten kognitiven Störungen – zu erwägen. Da Amantadin überwiegend über die Nieren ausgeschieden wird, kann die Behandlung von Patienten mit eingeschränkter Nierenfunktion außerdem ein hohes Toxizitätsrisiko bergen. Als absolute Kontraindikation sind schwere Leber- und Nierenfunktionsstörungen, schwere Herzerkrankungen und Psychosen zu erwähnen. Mundtrockenheit und Sehstörungen sind wahrscheinlich auf die milden anticholinergen Eigenschaften von Amantadin zurückzuführen.
Tab. 2. Häufige Nebenwirkungen von Amantadin (nach [36])
|
Häufige Nebenwirkungen |
|
Andere neurologisch-psychiatrische Indikationen
Die zahlreichen präklinischen und klinischen Studienergebnisse und Beobachtungen haben den möglichen Anwendungsbereich von Amantadin im Laufe der Jahre in verschiedenen Sparten der Medizin ständig erweitert. Nicht alle präklinisch vielversprechenden Daten haben bereits zu praktischen Applikationsempfehlungen geführt (Tab. 3). Im folgenden Abschnitt soll primär auf bereits existierende praxisrelevante Anwendungen eingegangen werden.
Tab. 3. Klinische Indikationen zur Behandlung mit Amantadin
|
Klinisches Fachgebiet |
Indikationen |
|
Allgemeinmedizin |
A2-Virus-Influenzaprophylaxe |
|
Herpes-Virus-Erkrankungen |
|
|
COVID-19-Infektionen (ex juvantibus) |
|
|
Neurologie und Psychiatrie |
Morbus Parkinson |
|
Verbesserung von Vigilanzstörungen |
|
|
Extrapyramidal-motorische Störungen nach Neuroleptikagabe (EPMS) |
|
|
Tardive Dyskinesien |
|
|
Herpes-Zoster-Neuralgien |
|
|
Chronische Müdigkeit bei diversen Erkrankungen |
Vigilanzstörungen
Bereits Schwab et al. hatten 1969 nach Amantadin-Einnahme eine Steigerung der psychischen Aktivität beobachtet [61]. In zahlreichen Studien mit Parkinson-Patienten konnte in der Folge unter anderem eine Abnahme von Agitation, insbesondere jedoch eine Verbesserung der Vigilanz, verbunden mit einer Alpha-Aktivierung im EEG nachgewiesen werden. Allerdings waren bei einigen Patienten auch Nebenwirkungen wie Überaktivität, ängstliche Unruhe und visuelle Halluzinationen zu beobachten [50, 71]. Zudem haben langjährige klinische Erfahrungen gezeigt, dass Amantadin als Infusion zur Steigerung von Sensorik und Vigilanz bei Bewusstseinstrübungen, sogar bei Komata verschiedener Ursache positive Effekte zeigt. Amantadin-Infusionen werden deshalb auf Intensivstationen häufig verwendet. Aber auch psychomentale Verbesserungen durch eine orale Einnahme, beispielsweise beim Down-Syndrom oder bei M. Alzheimer konnten beobachtet werden [36]. Trotzdem waren die bisherigen (wenigen) Studien zu Erkrankungen des Bewusstseins in Bezug auf das klinische Outcome und die untersuchten Krankheitsbilder sehr heterogen [27, 43]. Vielversprechende positive Auswirkungen von Amantadin konnten insbesondere bei Patienten mit Schädel-Hirn-Traumata nachgewiesen werden. Eine neuere Placebo-kontrollierte randomisierte Studie (n = 184) konnte zeigen, dass vier bis 16 Wochen nach einem schweren Schädel-Hirn-Trauma mit vegetativem Zustand oder minimalem Bewusstseinszustand eine schnellere Erholung auf der Disability Rating Scale und auf der Coma Recovery Scale unter Amantadin nachweisbar war [22]. Auch wenn in einigen Studien keine positiven Effekte gezeigt werden konnten, kann trotzdem festgehalten werden, dass sich bei komatösen Patienten mit akuten Hirnverletzungen in verschiedenen Stadien sowohl die Vigilanz als auch einige Aspekte kognitiver Funktionen (z. B. Wachheit, Aufmerksamkeit) unter Amantadin verbessern können [12]. Diese Indikation hat inzwischen auch Eingang in die aktuellen neurologischen Leitlinien gefunden. Neuere Studienergebnisse deuten zudem auf positive Effekte bei zerebrovaskulären Erkrankungen, Subarachnoidalblutungen und anderen, zum Teil schweren Hirnblutungen bezüglich Vigilanz und sogar Verbesserung neurologischer – auch motorischer – Ausfälle hin [18, 19]. Über den Wirkungsmechanismus von Amantadin bei Verbesserungen der Vigilanz ist nur wenig bekannt. Präklinische Studien legen eine Kombination von antiglutamatergen Eigenschaften und eine indirekte dopaminerge Stimulation nahe, welche neuroprotektive Effekte und eine Arousalzunahme induzieren [12].
In präklinischen Untersuchungen wurde bei der experimentell induzierten Autoimmunenzephalomyelitis in Ratten unter Amantadin eine signifikante Reduktion einiger proinflammatorischer Zytokine nachgewiesen, jedoch konnte letztlich kein wesentlicher Effekt auf die Pathologie der multiplen Sklerose (MS) nachgewiesen werden [12]. Allerdings konnten bei MS-Patienten Verbesserungen der Vigilanz beobachtet werden, sodass gemäß den Leitlinien der deutschen MS-Gesellschaft Amantadin in Einzelfällen zur Verbesserung von Vigilanz, Müdigkeit und Konzentrationsstörungen als Therapieversuch erwogen werden kann [20]. Die Off-Label-Kommission des G-BA hat den Off-Label-Use von Amantadin zur Behandlung der Fatigue bei MS zu Lasten der GKV jedoch ausdrücklich ausgeschlossen.
Andere Anwendungsbereiche
Das Potenzial von Amantadin bei Depressionen wurde bereits in den frühen 70er-Jahren erkannt [70]. So konnte gezeigt werden, dass die Kombination von Imipramin mit Amantadin bei unipolar depressiven Patienten zu einer Verbesserung im Hamilton-Score führte [59]. In einer neueren Studie konnte eine positive Wirkung auf depressive Symptome bei vier Patienten mit einer bipolaren Erkrankung (Typ 1), bei denen herkömmliche Antidepressiva wirkungslos waren, erreicht werden [38]. Ob diese Effekte allein durch eine Vigilanzsteigerung oder durch andere Mechanismen, beispielsweise eine vermehrte Expression des neurotrophen Faktors GDNF erklärt werden können, bleibt aktuell spekulativ [68]. Eine generelle Anwendung von Amantadin als Antidepressivum ist nicht zu empfehlen.
Etabliert hat sich dagegen die Behandlung von Patienten mit extrapyramidalen Begleit- und/oder Folgeerscheinungen nach einer Neuroleptika-Therapie (EPMS). Bereits 1971 berichteten Kelly et al. nach Applikation von Amantadin über eine mäßige bis markante Reduktion von Rigor, Tremor, Dystonien und Akathisien bei EPMS-Patienten [30]. Eine bessere Wirkung im Vergleich zu Anticholinergika bei akuten EPMS konnte bisher jedoch noch nicht gezeigt werden. Präklinische Studien konnten belegen, dass Amantadin die dopaminerge Rezeptorhypersensitivität im Striatum nach Haloperidol-Applikation reduziert [2]. Möglicherweise könnte die beobachtete vermehrte Expression der neurotrophen Faktoren BDNF (Brain-derived neurotrophic factor) und GDNF ebenfalls eine Rolle spielen [12]. Diese Ergebnisse, wie auch die positiven Effekte von Amantadin bei Levodopa-induzierten Dyskinesien bei MP initiierten diverse Studien zu tardiven Dyskinesien. Die Ergebnisse und zahlreiche Beobachtungen belegen einen positiven Effekt von Amantadin. Deshalb hat die American Academy of Neurology Amantadin als mögliche Therapie von tardiven Dyskinesien in seine Leitlinien aufgenommen [5].
Virale Erkrankungen
Als erstes Amantadin-Präparat wurde das Hydrochloridsalz zur klinischen Anwendung zugelassen, nachdem es sich im Tierversuch und beim Menschen in der Verhinderung von A2-Virusgrippen bewährt hatte [29]. Auch spätere Studien und Beobachtungen in Pflegeheimen bestätigten den prophylaktischen antiviralen Wert von Amantadin [13, 63]. Als wirksame Dosis haben sich 100 mg/Tag über mindestens zwei Wochen als sinnvoll erwiesen. Zudem fanden sich auch positive Wirkungen auf den Verlauf von Herpes-simplex-Infektionen. Als Applikation in Salbenform und durch die frühzeitige orale Gabe konnten positive Wirkungen nicht nur bei der Erkrankung selbst, sondern auch bei der oft nachfolgenden postherpetischen Neuralgie erzielt werden [40, 42].
Eine wissenschaftliche Renaissance erlebt die antivirale Potenz von Amantadin seit Beginn der COVID-19-Pandemie Anfang 2020 [58]. Diverse präklinische Untersuchungen konnten seitdem einen hemmenden Effekt von Amantadin auf den SARS-CoV-2-Virus belegen. In früheren Studien fanden sich Hinweise auf eine antivirale Wirkung via einer Inhibition der Virusreplikation [31, 66]. Neuere In-vitro-Daten bestätigten zwar die Hemmung der Virusreplikation, die biochemischen Mechanismen sind aber noch nicht endgültig geklärt [17]. Molekulare Docking-Studien konnten einerseits eine Blockierung des viralen E-Protein-Kanals nachweisen. Zudem konnte beobachtet werden, dass es in der Wirtszelle zu pH-Veränderungen von Endosomen mit nachfolgender Inhibierung von Zellproteinen wie Cathepsin C kommt, wodurch der Eintritt des Virus behindert wird. Auch eine Wirkung via den bekannten NMDA-Antagonismus und eine Hemmung des Alpha-7-Subtyps von nikotinergen Acetylcholin-Rezeptoren an Bronchialzellen könnte den positiven Effekt bewirken [8]. Da Amantadin rasch die Blut-Hirn-Schranke überwindet, könnte sich diese Substanz insbesondere zur Behandlung viraler Infektionen mit ZNS-Beteiligung eignen. Bisher liegen jedoch nur wenige klinische Daten zur Wirksamkeit von Amantadin auf SARS-CoV-2 vor. In einer kleinen Studie wurden 15 COVID-19-Patienten mit Grunderkrankungen an MS oder MP in Quarantäne mit 100 mg/Tag Amantadin behandelt. Bei keinem der Patienten entwickelten sich klinische Symptome, auch eine Verschlechterung der Grunderkrankung konnte nicht beobachtet werden [57]. Zuverlässige Aussagen über die potenzielle Anti-COVID-19-Wirkung von Amantadin können jedoch erst nach Abschluss der aktuell geplanten oder bereits gestarteten klinischen Studien gemacht werden.
Ausblick
Das Indikationsspektrum von Amantadin wurde in den letzten Jahren zunehmend erweitert. Neben der etablierten Behandlung von MP und Vigilanzstörungen werden aufgrund der vielversprechenden präklinischen Daten diverse andere – überwiegend neurologisch-psychiatrische – Erkrankungen als therapeutisches Target diskutiert und zum Teil bereits klinisch überprüft. Hervorzuheben ist aufgrund der aktuellen COVID-19-Pandemie insbesondere die in vitro nachgewiesene hemmende Wirkung von Amantadin auf die Propagation des Virus. Hier bleiben die Ergebnisse aussagekräftiger klinischer Studien abzuwarten. Klinisch vielversprechend ist des Weiteren die Entwicklung von Amantadin-Varianten oder neuer Formulierungen der Grundsubstanz. So ist beispielsweise für Rimantadin – ein Alpha-Methyl-Derivat von Amantadin – in einer offenen Studie die Wirksamkeit bei Parkinson-Patienten nachgewiesen worden. Insbesondere traten Nebenwirkungen im Vergleich zur Grundsubstanz seltener auf [16]. In den letzten Jahren wurden neue Formulierungen von Amantadin untersucht. Es handelt sich dabei um Retard-Präparate mit verzögerter Freisetzung. In Studien konnten positive antidyskinetische Wirkungen belegt werden, weshalb das Präparat Gocovri® mit dieser Indikation in den USA zugelassen wurde. Dem zweiten Retardpräparat (Osmolex ER®) wurde bisher neben der klassischen Indikation für MP nur die Behandlung medikamentös induzierter Nebenwirkungen (EPMS) genehmigt [1, 54]. Die Vorteile dieser Applikationsformen für die klinische Praxis bleiben abzuwarten.
Interessenkonflikterklärungen
Wilfried Kuhn, Thomas Müller und Peter Riederer erklären, dass keine Interessenkonflikte vorliegen.
Anrdzej Dekundy und Wojciech Danysz sind Mitarbeiter der Firma Merz Pharmaceuticals GmbH.
Literatur
1. Adamas. GocovriTM (prescribing information, Stand 8/2017). https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/208944lbl.pdf (Zugriff am 09.09.2018).
2. Allen RM, Lane JD, Brauchi JT. Amantadine reduces haloperidol-induced dopamine receptor hypersensitivity in the striatum. Eur J Pharmacol 1980;65:313–5.
3. Aoki FY, Sitar DS. Clinical pharmacokinetics of amantadine hydrochloride. Clin Pharmacokinet 1988;14:5135–51.
4. Bailey EV, Stone TW. The mechanism of action of amantadine in parkinsonism: A review. Arch Int Pharmacodyn 1975;216:246–62.
5. Bhidayasiri R, Jitkritsadakul O, Friedman JH, Fahn S. Updating the recommendations for treatment of tardive syndromes: a systematic review of new evidence and practical treatment algorithm. J Neurol Sci 2018;389:67–75.
6. Butterworth RF. Amantadine for the treatment of traumatic brain injury and its associated cognitive and neurobehavioural complications. J Pharmacol Pharm Res 2020;3:1–5.
7. Butterworth RF. Amantadine treatment for Parkinson’s disease during COVID-19: bimodal action targeting viral replication and the NMDA receptor. J Parkinsons Dis Alzheimer Dis 2020;7:1–4.
8. Butterworth RF. Potential for the repurposing of adamantane antivirals for COVID-19. Drugs 2021;21:267–72.
9. Crosby NI, Deane KH, Clarke CE. Amantadine in Parkinson’s disease. Cochrane Database Syst Rev 2003;1:CD003468.
10. Danielczyk W. Therapy of akinetic crises. Med Welt 1973;24:1278–82.
11. Danielczyk W. Twenty-five years of amantadine therapy in Parkinson’s disease. J Neural Transm 1995;46(Suppl.):399–405.
12. Danysz W, Dekundy A, Scheschonka A, Riederer P. Amantadine: reappraisal of the timeless diamond – target updates and novel therapeutic potentials. J Neural Transm (Vienna) 2021;128:127–69.
13. Davies JR, Grilli EA, Swith AJ, Hoskins TW. Prophylactic use of amantadine in a boarding school outbreak of influenza A. J Roy Coll Gen Pract 1988;38: 346–8.
14. Davies WL, Grunert RR, Haff RF, McGahen JW, et al. Antiviral activity of 1-adamantanamine (amantadine). Science 1964;144:862–3.
15. Decker BL, Davis JM, Jonowsky DS, el-Yousef MK, et al. Amantadine hydrochloride treatment of tardive dyskinesia. N Engl J Med 1971;285:860.
16. Evidente VG, Adler CH, Caviness IN, et al. A pilot study on the motor effects of rimantadine in Parkinson’s disease. Clin Neuropharmacology 1999;22:30–2.
17. Fink K, Nitsche A, Neumann M, Grossegesse M, et al. Amantadine inhibits SARS-CoV-2 in vitro. Viruses 2021;13:539.
18. Gao Y, Zhang Y, Li Z, Ma L, et al. Persistent vegetative state after severe cerebral hemorrhage treated with amantadine: a retrospective controlled study. Medicine (Baltimore) 2020;99:e21822.
19. Gao Y, Ma L, Liang F, Zhang Y, et al. The use of amantadine in patients with unresponsive wakefulness syndrome after severe cerebral hemorrhage. Brain Inj 2020;34:1084–8.
20. Generali JA, Cada DJ. Amantadine: multiple sclerosis-related fatigue. Hosp Pharm 2014;49:710–2.
21. Gerzon K, Krumkalns EV, Brindle RL, Marshall FJ, et al. The adamantyl group in medicinal agents. I. Hypoglycemic N-arylsulfonyl-N’-adamantylureas. J Med Chem 1963;6:760–3.
22. Giacino JT, et al. Practice guideline update recommendations summary: disorders of consciousness: report of the guideline development, dissemination, and implementation Subcommittee of the American Academy of Neurology; the American Congress of Rehabilitation Medicine; and the National Institute on Disability Independent, Living, and Rehabilitation Research. Arch Phys Med Rehabil 2018;99:1699–709.
23. Greenamyre IT, O’Brien CF. N-methyl-D-aspartate antagonists in the treatment of Parkinson’s disease. Arch Neurol 1991;48:977–81.
24. Group PS. The glutamate antagonist remacide improves motor performance in levodopa-treated Parkinson’s disease. Neurology 1999;52(Suppl. 2):A262.
25. Gualteri T, Chandler M, Coons TB, Brown LT. Amantadine: a new clinical profite for traumatic brain injury. Clin Neuropharmacol 1989;4:258–70.
26. Hubsher G, Haider M, Okun MS. Amantadine: the journey from fighting flu to treating Parkinson disease. Neurology 2012;78:1096–9.
27. Hughes S, Colantonio A, Santaguida PL, Paton T. Amantadine to enhance readiness for rehabilitation following severe traumatic brain injury. Brain Inj 2005;19:1197–206.
28. Jörg I, Ringendahl H, Ischebeck W, Steube D, et al. Amantadinsufat-Infusion zur Behandlung von Vigilanz- und Antriebsstörungen. Nervenheilkunde 2000;19:512–28.
29. Juchson GG, Muldoon RL, Akers LW. Serological evidence for prevention of influenza infection in volunteers by an antiinfluenzal drug: adamantanamin hydrochloride. Antimicrob Agents Chemother 1968;3:703–7.
30. Kelly JT, Abuzzahab FS. The antiparkison properties of amantadine in drug-induced parkinsonism. J Clin Pharm 1971;11:211–4.
31. Kendal AP, Klenk HD. Amantadine inhibits an early, M2 protein-dependent event in the replication cycle of avian influenza (H7) viruses. Arch Virol 1991;119:265–73.
32. Kornhuber J, Bormann I, Hübers M, Rusche K, et al. Effects of the 1-amino-adamantanes at the MK-801-binding site of the NMDA-receptor-gated-ion channel. Eur J Pharmacol Mol 1991;206:297–300.
33. Kornhuber J, Bormann J, Retz W, Hubers M, et al. Memantine displaces [3H]MK-801 at therapeutic concentrations in postmortem human frontal cortex. Eur J Pharmacol 1989;166:589–90.
34. Kornhuber J, Schoppmeyer K, Riederer P. Affinity of 1-aminoadamantanes for the sigma binding site in post-mortem human frontal cortex. Neurosci Lett 1993;163:129–31.
35. Kornhuber J, Quack G, Danysz W, Jellinger K, et al. Therapeutic brain concentration of the NMDA receptor antagonist amantadine. Neuropharmacology 1995;34:713–21.
36. Kornhuber J, Streifler M. NMDA-Antagonisten. In: Riederer P, Laux G, Pöldinger W (Hrsg.). Neuro-Psychopharmaka. Band 5. Wien, New York: Springer, 1999:272–86.
37. Koller WC. Pharmacologic treatment of parkinsonian tremor. Arch. Neurol 1986;43:126–7.
38. Krzystanek M, Palasz A. Possibility of a new indication for amantadine in the treatment of bipolar depression-case series study. Pharmaceuticals (Basel) 2020;13:326.
39. Kulisevsky I, Tolosa E. Amantadine in Parkinson’s disease. In: Koller WC, Paulsen G (eds.). Therapy in Parkinson’s disease. New York: Marcel Dekker, 1987:309–16.
40. Kunzelmann V. Oral combination therapy of zoster neuralgia. Pain reduction by 1-amantadine sulfate and carbamazepine per os. Fortschr Med 1993;111:423–5.
41. Li XM, Juorio AV, Qi J, Boulton AA. Amantadine increases aromatic l-amino acid decarboxylase mRNA in PC12 cells. J Neurosci Res 1998;53:490–3.
42. Lieb W, May G. On the treatment of herpetic keratitis with a new amantadine derivative. Klin Monatsbl Augenheilkunde 1972;161:197–206.
43. Ma HM, Zafonte RD. Amantadine and memantine: a comprehensive review for acquired brain injury. Brain Inj 2020;34:299–315.
44. Malkani R, Zdikoff C, Melen O, et al. Amantadine for freezing of gait in patients with Parkinson’s disease. Clin Neuropharmakology 2012;35:266–8.
45. Manyam BV. Amantadine in essential tremor. Ann Neurol 1981;9:198–9.
46. Masand PS, Reddy N, Gregory R. SSRI-induced sexual dysfunction successfully treated with amantadine. Depression 1994;2:319–21.
47. Maugh TH 2nd. Panel urges wide use of antiviral drug. Science 1979;206: 1058–60.
48. Müller T. Medikamentöse Therapie des Morbus Parkinson. Bremen: UNI-MED-Verlag, 2015.
49. Müller T, Kuhn W, Schulte T, Przuntek H. Intravenous amantadine sulphate application improves the performance of complex but not simple motor tasks in patients with Parkinson’s disease. Neuroscience Lett 2003;339:25–8.
50. Muller SR, Dastoor DP, Klinger A, Boillat J. Amantadine in senile dementia: electroencephalographic and clinical effects. J Am Geriatr Soc 1979;27:9–16.
51. Nastuck WG, Pu PC, Donbilet P. Anticholinergic and membrane activities of amantadine in neuromuscular transmission. Nature 1976;264:76–9.
52. Obeso JA, Martinez-Lage IM. Anticholinergics and amantadine. In: Koller WC, Paulsen G (eds.). Handbook of Parkinson’s disease. New York: Marcel Dekker, 1987:309–16.
53. Papa SM, Chase TN. Levodopa-induced dyskinesias improved by a glutamate antagonist in parkinsonian monkeys. Ann Neurol 1996;39:574–8.
54. Pahwa R, Tanner CM, Hauser RA, et al. ADS-5102 (amantadine) extended release capsales for levodopa-induced dyskinesia in Parkinson’s disease (EASE LID study). A randomized clinical trial. JAMA Neurol 2017;74:941–9.
55. Quack G. Amantadin reduziert L-Dopa-induzierte motorische Fluktuationen – präklinische und klinische Ergebnisse. Aktuelle Neurologie 1998;25:S258–60.
56. Rajput A, Wallkait M, Rajput AH. 18 month prospective study of amantadine (Amd) for Dopa (LD) induced dyskinesias (DK) in idiopathic Parkinson’s disease. Can J Neurol Sci 1997;24:S23.
57. Rejdak K, Grieb P. Adamantanes might be protective from COVID-19 in patients with neurological diseases: multiple sclerosis, parkinsonism and cognitive impairment. Mult Scler Relat Disord 2020;42:102163.
58. Riederer P, Ter Meulen V. Coronaviruses: a challenge of today and a call for extended human postmortem brain analyses. J Neural Transm (Vienna) 2020;127:1217–28.
59. Rogoz Z, Skuza G, Legutko B. Repeated co-treatment with imipramine and amantadine induces hippocampal brain-derived neurotrophic factor gene expression in rats. J Physiol Pharmacol Off J Pol Physiol Soc 2007;58:219–34.
60. Savery F. Amantadine and a fixed combination of levodopa and carbidopa in the treatment of Parkinson’s disease. Dis Nerv Syst 1977;38:605–8.
61. Schwab RS, England AC, Poskanzer DC, Young RR. Amantadine in the treatment of Parkinson’s disease. JAMA 1969;208:1168–70.
62. Scotti G, Spinnler H. Amantadine and Huntington’s chorea. N Engl J Med 1971;285:1325–6.
63. Sears SD, Clements ML. Protective efficacy of low-dose amantadine in the treatment of Parkinson’s disease. J Am Med ASSOC 1987;208:1163–70.
64. Shannon KM, et al. Amantadine and motor fluctuations in chronic Parkinson’s disease. Clin Neuropharmacol 1987;10:522–6.
65. Stetter H, Mayer J, Schwarz M, Wulff K. Beiträge zur Chemie der Adamantyl-(1)-Derivate. Chem Ber 1960;93:226–30.
66. Tanner JA, et al. The adamantane-derived bananins are potent inhibitors of the helicase activities and replication of SARS coronavirus. Chem Biol 2005;12:303–11.
67. Thomas A, et al. Duration of amantadine benefit on dyskinesia of severe Parkinson’s disease. J Neurol Neurosurg Psychiatry 2004;75:141–3.
68. Tsybko AS, Ilchibaeva TV, Popova NK. Role of glial cell line-derived neurotrophic factor in the pathogenesis and treatment of mood disorders. Rev Neurosci 2017;28:219–33.
69. Utti RJ, Rajput AK, Ahlskog JE, et al. Amantadine treatment is an independent predictor of improved survival in Parkinson’s disease. Neurology 1996;46:1551–6.
70. Vale S, Espejel MA, Dominguez JC. Amantadine in depression. Lancet 1971;2:437.
71. Vardi I, Streifler M. On the synchronizing effect of amantadine-1-hydrochloride on pathological EEG activity. J Neural Transm 1975;37:73–80.
72. Weintraub D, Sohr M, Potenza MN, et al. Amantadine use associated with impulse control disorders in Parkinson’s disease in cross-sectional study. Ann Neurol 2010;68:963–8.
73. Weiser SD, et al. Stimulation of rat striatal tyrosine hydroxylase activity following intranigral administration of sigma receptor ligands. Eur J Pharmacol 1995;275:1–7.
74. Zimmermann M. Periodic safety update report for PK-Merz active: amantadine sulphate. Report. Frankfurt: Merz Pharmaceuticals, 1997.
Prof. Dr. rer. nat. Dr. med. habil. Wilfried Kuhn, Klinik f. Neurologie, Leopoldina-Krankenhaus, Gustav-Adolf-Straße 8, 97422 Schweinfurt
Prof. Dr. med. Thomas Müller, Klinik f. Neurologie, St. Joseph-Krankenhaus, Berlin-Weißensee, Gartenstraße 1, 13088 Berlin
Prof. Dr. Dr. h. c. Peter Riederer, Klinik und Poliklinik für Psychiatrie, Psychosomatik und Psychotherapie, Universitätsklinikum Würzburg, Margarete-Höppel-Platz 1, 97080 Würzburg und Psychiatrische Klinik, University of Southern Denmark, Odense, Denmark, E-Mail: peter.riederer@mail.uni-wuerzburg.de
Dr. Andrzej Dekundy, Prof. Dr. rer. nat. Wojciech Danysz, Merz Therapeutics, Merz Pharmaceutical GmbH, Eckenheimer Landstraße 100, 60318 Frankfurt
Amantadine – classic applications and antiviral potential in times of COVID-19
Antiparkinsonian activity of amantadine was first described in 1969 and was confirmed by several trials in later years. The improvement of parkinsonian symptoms is mild. However, in patients with motor fluctuations a clear reduction of dyskinesia and akinetic crisis could be observed. A possible neuroprotective impact is still under discussion, but lacking evidence. Moreover, amantadine is efficient in the treatment of disorders of vigilance, chronic fatigue (e. g. multiple sclerosis), tardive dykinesia and neurolepticas induced extrapyramidal motor symptoms. The clinical efficacy is caused by manifold mechanism of action. Initially, enhancement of dopaminergic transmission has been observed after amantadine and considered main mechanism of action. Currently, several direct targets are likely such as: (1) aromatic aminoacid decarboxylase, (2) Sigma-1 receptors, (3) nicotinergic receptors, (4) phosphodiesterase, (5) GDNF (glial-cell-derived neurotrophic factor). Dose dependently, there are also other probable targets like NMDA antagonism, serotoninergic-5-HT3 antagonism and potassium channel blockade. Preclinical data suggest an association of both neuroprotective potential and antidyskinetic properties with the antiglutamatergic activity of amantadine. Since the COVID-19 pandemic, the antiviral efficacy of amantadine generated increasing interest. Several in vitro studies detected inhibition of SARS-CoV-2 virus. These results could support clinical renaissance of this drug in the coming years.
Key words: Parkinson’s disease, antidyskinetic efficacy, neuroprotection, antiviral activity, Sigma-1, GDNF, aromatic amino acid decarboxylase (AADC), NMDA, disorders of vigilance, tardive dyskinesia, neuroleptics induced extrapyramidal motor disturbances, postherpetic pain, inhibition of SARS-CoV-2 virus
Psychopharmakotherapie 2021; 28(06):260-268
