Michael Paulzen, Tobias Schreckenbach und Miriam Kirchner, Aachen
Die Verordnung von Psychopharmaka hat sich in den letzten Jahren wiederholt verändert. So stiegen die verordneten „defined daily doses“, DDD, also definierte Tagesdosierungen, von Antidepressiva in den letzten zehn Jahren nochmals um mehr als 40 %. Getragen wurde dieser Anstieg vor allem von einer weiteren Zunahme der Verordnung von selektiven Serotonin-Rückaufnahme-Inhibitoren (SSRI) und Serotonin-Noradrenalin-Rückaufnahme-Inhibitoren (SNRI). Gleichzeitig stieg auch die Verordnung der atypischen Antipsychotika, die zunehmend auch außerhalb der ursprünglichen Indikationen verordnet werden [31].
Steigende Verordnungszahlen können einerseits durch die Indikationsausweitungen einzelner Stoffgruppen begründet sein, andererseits besteht ein Trend zur Dauertherapie, der mitunter durch eine Unfähigkeit oder manchmal auch Unerträglichkeit verursacht zu sein scheint, eine einmal begonnene Psychopharmakotherapie wieder zu beenden. So zeigte der Barmer Arzneimittelreport 2020 in einem 5-Jahres-Zeitraum eine Zunahme von 9,9 % der in der Facharztgruppe „Psychiatrie und Psychotherapie“ mit Arzneimitteln behandelten Patientenzahl [3].
Eine Langzeitanwendung von Antidepressiva oder Antipsychotika ist jedoch nicht immer die Folge mangelnder Bereitschaft, die Pharmakotherapie zu beenden. Oft ist sie sogar sinnvoll und notwendig – und leitlinienkonform –, wenn multiple Vorepisoden mit Wiederauftreten der Grunderkrankung (auch mit Suizidalität) nach Absetzen der Medikation den Krankheitsverlauf prägen.
Der Langzeitgebrauch von Psychopharmaka führt jedoch oft zu einer Polymedikation, also der gleichzeitigen Verordnung mehrerer Wirkstoffe, womit sich das Risiko für pharmakodynamische und pharmakokinetische Arzneimittelinteraktionen erhöht. Unweigerlich steigt damit die Gefahr von Psychopharmaka-assoziierten Nebenwirkungen [39].
Als Konsequenz steigender Verordnungszahlen und zunehmend häufiger existierender Dauertherapien rückte schon seit einiger Zeit das Thema Absetzen von Psychopharmaka verstärkt in den Fokus akademischer wie klinischer Diskussionen, denn viele Patienten befürchten eine Abhängigkeitsentwicklung bei längerer Verordnung von Psychopharmaka und manche berichten auch von als quälend erlebten Absetzsymptomen beim Versuch, eine bestehende Psychopharmakotherapie wieder zu beenden. Bereits im Jahr 2018 titelte die New York Times „Many People Taking Antidepressants Discover They Cannot Quit“ [8] und berichtete über die Unfähigkeit vieler mit Antidepressiva behandelter Patienten, eine einmal begonnene antidepressive Psychopharmakotherapie (nebenwirkungsarm) wieder zu beenden. Eine systematische Übersichtsarbeit, mit der die Autoren die Daten aus 14 Studien mit insgesamt mehr als 4000 Patienten analysierten, berichtete von Absetzsymptomen bei 27 bis 86 % der mit Antidepressiva behandelten Patienten. Im Mittel zeigten sich über alle Studien Absetzsymptome bei 56 % der Patienten. Von diesen Patienten berichteten wiederum 46 %, dass die Absetzsymptome als schwerwiegend wahrgenommen wurden [12].
Valide Daten über die Häufigkeit von Absetzphänomenen bei Beendigung einer Antidepressivatherapie sind Mangelware. Auch die Untersuchung von Davies und Read [12] unterlag in der Folge einer sehr kritischen Diskussion [27a] mit Zweifeln an den angegeben Häufigkeiten.
Ergebnisse einer sehr aktuellen Studie, basierend auf einer internetbasierten Umfrage (https://www.survivingantidepressants.org/), die zwar keine Aussage zur Auftretenswahrscheinlichkeit von Absetzphänomenen grundsätzlich macht, berichtet aber ausführlich über die Dauer protrahierter Absetzphänomene. Auch zum Spektrum angegebener Einzelsymptome stellen die Studienautoren interessante Ergebnisse vor. So zeigte sich einerseits ein sehr variables Spektrum der Dauer (5–166 Monate) des Auftretens von Absetzphänomenen (Mittelwert 37 Monate, Median 26 Monate), anderseits zeigten sich bei 81 % der Betroffenen somatische Symptome wie Kopfschmerzen, Müdigkeit, Schwindel Sehstörungen, Muskelschwäche, Tremor und Durchfall. 44 % der Betroffenen gaben Schlafstörungen an und 32 % berichteten von kognitiven Störungen [21a]. Häufigkeiten in Bezug auf eine Gesamtpopulation konnten indes aus der Studie nicht abgeleitet werden.
Interessant scheint auch die Beobachtung, dass Patienten, die im Rahmen einer Non-Adhärenz die verordnete Medikation ohne therapeutische Begleitung abrupt absetzen, weniger oft über Absetzphänomene berichten.
Für den Fall eines geordneten und planbaren Absetzens einer Pharmakotherapie bewerben aktuell beispielsweise niederländische Anbieter sogenannter „Tapering-Strips“ auch den deutschen Markt. Hierbei handelt es sich um industriell hergestellte, teils individualisierte Reduktionsschemata in Form vorgefertigter Blister mit Tabletten in abfallender Dosierung über unterschiedlich lange Zeiträume („to taper“ – ausschleichen; „strip“ – Streifen) [21]. Es handelt sich beispielsweise um 28 Tage umfassende Reduktionsschemata in Form von aufeinander folgenden Kapseln oder Tabletten, bei denen jede Einzelgabe nummeriert und mit einer Dosisangabe versehen ist. Unklar bzw. schwierig ist die aktuelle Rechtslage bezüglich der Einfuhr solcher individueller Rezepturen, da eine Einfuhrerlaubnis für Arzneimitteln gemäß § 73 Arzneimittelgesetz (AMG) zum aktuellen Zeitpunkt nur für Fertigarzneimittel besteht. Ebenso unklar ist eine Kostenübernahme durch die Krankenkasse. Erste Beobachtungsstudien scheinen jedoch positive Ergebnisse für eine solche Alternative zum bisherigen Vorgehen beim Absetzen von Antidepressiva zu zeigen [20].
Der vorliegende Beitrag verschafft einen Überblick über das Vorgehen beim Absetzen von Antidepressiva und Antipsychotika. Ziel ist es, dem Leser einen Überblick über das konkrete Vorgehen beim Absetzen der Substanzen zu geben und hierbei die aktuellen Leitlinien mit in den Fokus zu nehmen. Grundsätzlich besteht in der guten klinischen Praxis die einschlägige Meinung, dass der Verordner eines Psychopharmakons bereits zum Zeitpunkt des Behandlungsbeginns auch das Absetzen mit in die Behandlungsplanung einbeziehen sollte.
Absetzeffekte von Psychopharmaka im Tiermodell
Die meisten Versuche, Absetzeffekte von Psychopharmaka im Tiermodell zu untersuchen, wurden mit Fluoxetin unternommen [35]. Dabei sind unter Fluoxetin – möglicherweise aufgrund seiner langen Halbwertszeit und damit der langen Verweildauer im Körper – Absetzphänomene eher milder ausgeprägt. In einer älteren Studie an Ratten, die unter einer Fluoxetin-Behandlung eine Abnahme ihrer Bewegungsaktivität aufwiesen, zeigte sich bei der Beendigung der Fluoxetin-Gabe innerhalb der ersten vier Stunden nach einer ersten ausgelassenen Dosierung ein signifikanter Anstieg der Bewegungsaktivität, der aber nicht von langer Dauer war [5]. Als Erklärungsmodell diente die Wirkung von Fluoxetin auf das dopaminerge System des ventralen tegmentalen Areals (VTA) und im Nucleus accumbens. In einer weiteren Tierversuchsarbeit zeigten sich nach Beendigung einer Behandlung mit Fluoxetin dauerhaft erniedrigte striatale Dopaminkonzentrationen [16].
Die Habituation des sogenannten Startle-Reflexes, einer universell auftretenden motorischen Antwort auf unerwartete, stärkere sensorische Reize im Sinne einer willkürlich nicht unterdrückbaren protektiven Reaktion, zeigte sich in einer Gruppe von Ratten, bei denen eine konstante Citalopram-Gabe beendet worden war, signifikant vermindert gegenüber den Tieren, die weiterhin Citalopram infundiert bekamen. Unter der Annahme, dass eine Veränderung des Startle-Reflexes Repräsentant für Angst und/oder ängstliches Verhalten ist, scheint hierdurch das auftretende Phänomen der Ängstlichkeit beim Absetzsyndrom erklärbar zu sein.
Humanbefunde liefern Hinweise auf eine mögliche Beteiligung des C(-1019)G-Polymorphismus des 5-HT1A-Rezeptorgens an der Entstehung eines Paroxetin-Absetzsyndroms. Murata und Kollegen zeigten an einer japanischen Kohorte, dass Patienten mit dem -1019C-Allel signifikant häufiger ein Paroxetin-Absetzsyndrom entwickelten als solche Patienten, die homozygot für das -1019G-Allel waren [32].
Absetzen von Antidepressiva
Antidepressiva gehören in vielfältigen Indikationen (z. B. Depressionen, Angst- und Zwangserkrankungen, Schlafstörungen, Essstörungen, Schmerzerkrankungen) zu den fachdisziplinübergreifend am häufigsten verordneten Medikamenten in der ambulanten und stationären psychiatrischen Behandlung [31].
Die S3-Leitlinie/Nationale VersorgungsLeitlinie Unipolare Depression empfiehlt bereits bei Beginn einer antidepressiven Pharmakotherapie eine Aufklärung über die anzustrebende Behandlungsdauer und mögliche Absetzphänomene bei Beendigung der Medikation [38].
Nur ein geringer Prozentsatz der Patienten nimmt die einmal verordnete Medikation vom Zeitpunkt der Eindosierung an ununterbrochen für den Rest des Lebens ein [26]. Wesentlich häufiger erfolgt zu einem bestimmten Behandlungszeitpunkt ein Absetzen oder Umstellen der Medikation – entweder in Begleitung des behandelnden Arztes oder in Eigenregie der Patienten. Für Behandler und Patienten kann zu verschiedenen Zeitpunkten der Behandlung aus unterschiedlichen Gründen der Wunsch nach Beendigung oder Umstellung der Medikation entstehen. Gründe hierfür sind beispielsweise eine Unverträglichkeit der Medikation, nicht länger tolerierbare unerwünschte Arzneimittelwirkungen, unerwünschte Interaktionen mit anderen Substanzen, ein fehlendes Ansprechen bzw. eine unzureichende Wirksamkeit auf die Ziel-Symptomatik oder eine zufriedenstellende dauerhafte Remission der Symptome und der damit verbundene Wunsch nach Beendigung der Medikation.
Bei einem Großteil der verordneten Substanzen lassen sich Absetzphänomene unterschiedlicher Art, Ausprägung und Dauer beobachten. Diese sind bei unzureichendem Kenntnisstand nicht von einem „Rebound“ oder einer Rückkehr (oder einem Rezidiv) der Erkrankung zu unterscheiden, was zu einer Wiederaufnahme oder Umstellung einer eventuell nicht mehr notwendigen Medikation, aber auch zu einer zunehmenden Skepsis gegenüber den Substanzen vonseiten der Patienten führen kann. Eine genaue Kenntnis und Aufklärung über Absetzphänomene und das praktische Vorgehen bei Beendigung der Medikation ist daher auch bezüglich der weiteren Therapieentscheidung von hoher Relevanz.
In der klinischen Praxis sind umfassende Kenntnisse zu einem konkreten Vorgehen und möglichen Konsequenzen des Absetzens von Psychopharmaka erforderlich. Durch die zunehmend größere mediale Aufmerksamkeit hinsichtlich einer Langzeittherapie mit Psychopharmaka und die breitere Diskussion möglicher Absetzphänomene besteht diesbezüglich eine höhere Aufmerksamkeit bei Patienten mit Psychopharmakotherapie.
Praktisch bieten sich auch hier unterschiedliche Konzepte an: zum einen das Konzept des „micro-tapering“, bei dem täglich minimale Dosisreduktionen erfolgen, zum anderen das Konzept des „mini-tapering“, bei dem etwas größere Reduktionsschritte mit „Plateaus“ (Tagen mit gleicher Dosierung) erfolgen. Vorteil von Zweiterem ist die klarere Zuordnung von etwaigen Entzugssymptomen zum jeweiligen Reduktionsschritt im Vergleich zum „micro-tapering“.
Vielfältigkeit von Absetzsymptomen
Zu den möglichen Absetzsymptomen von Antidepressiva zählen beispielsweise Übelkeit, Antriebslosigkeit und Adynamie, Kopfschmerzen, Schwindel, Tinnitus, Parästhesien (also anomale Körperempfindungen wie ein Gefühl von Ameisenlaufen oder „stromschlagartigen“ Missempfindungen), Schlafstörungen, Unruhe, Zittern, Schwitzen, Magen-Darm-Beschwerden sowie Koordinationsstörungen oder Konzentrationsstörungen. Absetznebenwirkungen wie Depressivität, Affektdurchlässigkeit, Ängste oder Suizidideen sind oft schwierig von einem Rebound der Grunderkrankungen zu differenzieren (Tab. 1).
Tab. 1. Absetzsymptome von Antidepressiva (SSRI und SSNRI) [21]
|
|
|
|
|
|
|
|
Absetzphänomene vs. Rebound vs. Rückfall/Rezidiv
Unter Absetzphänomenen, einem Antidepressiva-Entzugssyndrom oder einem sogenannten „antidepressant discontinuation syndrome“ (Abb. 1) versteht man Symptome, die zeitlich im unmittelbaren Zusammenhang mit der Reduktion, dem Absetzen oder einem Präparatewechsel von Antidepressiva (meist innerhalb weniger Tage) auftreten. Je nach Halbwertszeit der jeweiligen Substanz und der damit zu erwartenden abfallenden Konzentration ergeben sich für verschiedene Substanzen unterschiedliche Zeitpunkte, wann Absetzphänomene auftreten können und wie lange diese anhalten. Darüber hinaus prägt das individuelle pharmakodynamische Wirkprofil einer Substanz die jeweils zu erwartenden Absetzsymptome. Hierbei ist zu berücksichtigen, dass der jeweilige Metabolismus sowohl durch „innere“ (sog. pharmakokinetischer Genotyp) als auch „äußere“ (pharmakokinetischer Phänotyp) Variablen beeinflusst sein kann.
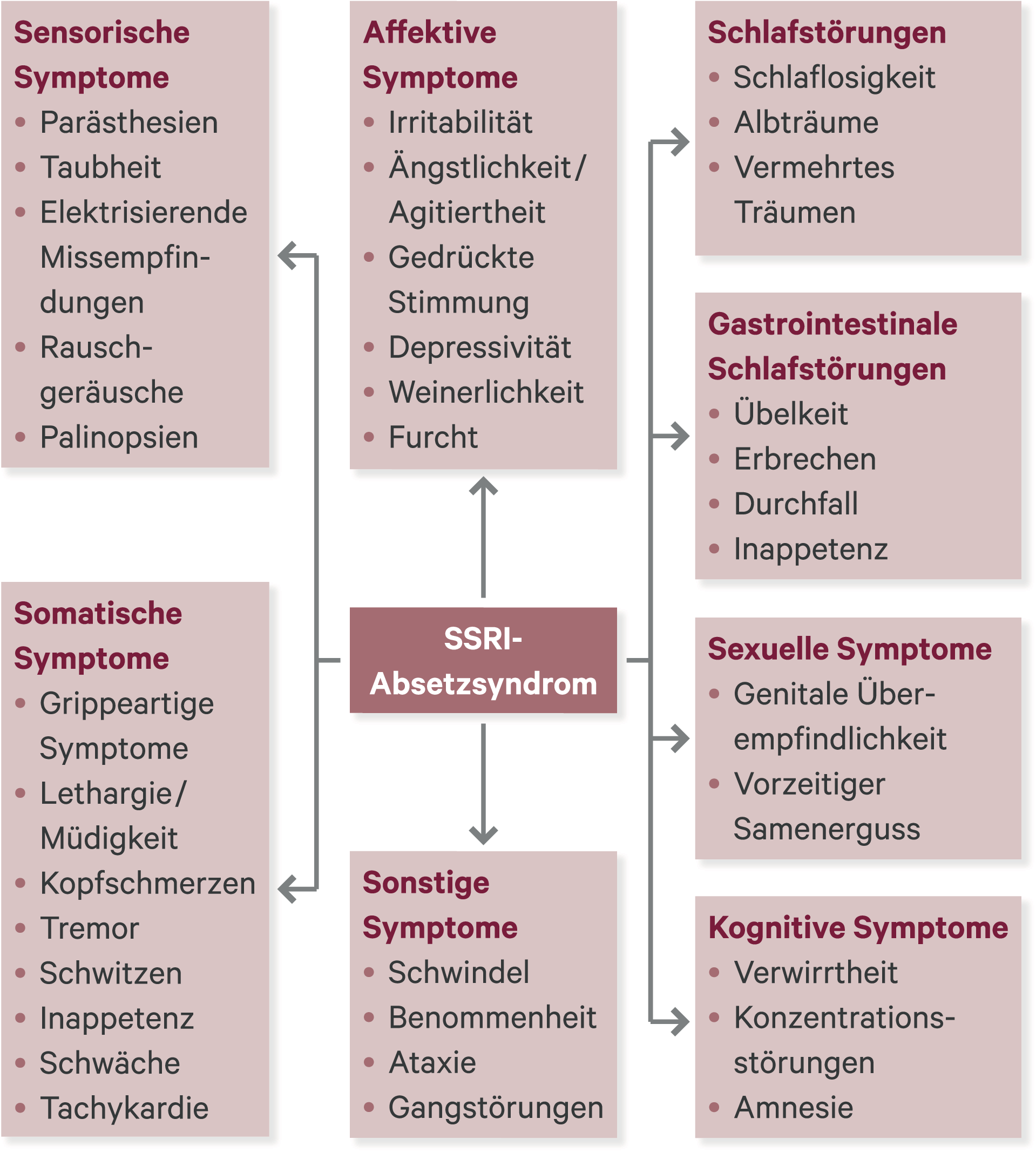
Abb. 1. Mögliche Absetzsymptome von selektiven Serotonin-Wiederaufnahmehemmern (SSRI) (nach [25])
Bezüglich der Bezeichnung des Syndroms tendiert die englische Literatur zur Benutzung des Begriffs „Entzugssymptome“ oder „Entzugssyndrom“, während die deutsche Leitlinie den Begriff „Absetzerscheinungen“ oder „Absetzphänomene“ verwendet [11].
Absetzphänomene sind in der Regel transient und in der Regel selbstlimitierend. Oft besteht eine rasche Besserung nach Wiederaufnahme der Medikation. Die Symptomatik von Absetzphänomenen ist abhängig von der jeweiligen Substanzklasse und kann der Grunderkrankung, beispielsweise einer Depression, ähneln (z. B. Ängstlichkeit), sich aber teilweise auch deutlich von der Grunderkrankung unterscheiden (z. B. „stromschlagartige“ Dysästhesien), weshalb eine möglichst genaue Zuordnung der Symptomatik in Hinblick auf das weitere Vorgehen essenziell ist. Teilweise können Absetzphänomene auch über einen längeren Zeitraum (mehr als zwei bis sechs Wochen je nach Halbwertszeit der Substanz) persistieren, hier ist die Rede von einem Post-Absetz-Syndrom oder Post-Entzugs-Syndrom [9].
Das klinische Bild von Absetzphänomenen beim Absetzen von SSRI ist gut erforscht und kann anhand von standardisierten Fragebögen erhoben werden, welche durch Abfrage von über 40 Symptomen („items“) eine Zuordnung der Symptomatik (vgl. Tab. 2) erleichtern können [2, 36].
Tab. 2. Discontinuation-Emergent Signs and Symptoms (DESS) – Fragebogen zur Erfassung von Absetzymptomen beispielsweise bei SSRI-Antidepressiva [36]
|
Discontinuation-Emergent Signs and Symptoms |
|
|
1. Nervosität/Ängstlichkeit 2. Gehobene Stimmung „High“ Gefühl 3. Reizbarkeit 4. Plötzliche Stimmungsverschlechterung 5. Wutausbrüche 6. Angst- oder Panikattacken 7. Tränen- bzw. Weinanfälle 8. Agitiertheit 9. Gefühl von Unwirklichkeit/Distanziertheit 10. Verwirrung/Konzentrationsstörungen 11. Vergesslichkeit oder Gedächtnisprobleme 12. Stimmungsschwankungen 13. Schlafstörungen/Schlaflosigkeit 14. Verstärktes Träumen/Albträume 15. Vermehrtes Schwitzen 16. Zittern 17. Muskelverspannung/Steifigkeit 18. Muskelschmerzen Schmerzen 19. Restless Legs 20. Muskelkrämpfe, Krämpfe oder Zuckungen |
21. Müdigkeit, Erschöpftsein 22. Gangstörungen/Koordinationsstörungen 23. Verschwommensehen 24. Trockener Mund 25. Unkontrollierbare Mund- und Zungenbewegungen 26. Sprach- oder Artikulationsschwierigkeiten 27. Kopfschmerzen 28. Erhöhter Speichelfluss 29. Schwindel, Benommenheit 30. Nasenlaufen 31. Kurzatmigkeit 32. Schüttelfrost 33. Fieber 34. Erbrechen 35. Übelkeit 36. Durchfall 37. Magenkrämpfe 38. Blähungen 39. Visuelle Sensationen 40. Brennen, Taubheitsgefühl, Kribbeln 41. Geräuschempfindlichkeit 42. Ohrgeräusche 43. Geruchs- oder Geschmacksveränderungen |
|
Die Patienten werden gefragt: „Haben Sie in den letzten sieben Tagen Veränderungen bei den folgenden Symptomen festgestellt?“ Dazu steht eine von vier Antworten zur Auswahl: neues Symptom; altes Symptom, aber schlimmer; altes Symptom, aber verbessert; altes Symptom, aber unverändert oder Symptom nicht vorhanden. |
|
Im englischen Sprachgebrauch hat sich zur orientierenden Abfrage von Absetzphänomenen bei SSRI das Akronym „FINISH“ etabliert: typische Absetzphänomene sind grippeähnliche Symptome (F: flu-like), Schlafstörungen (I: insomnia), Übelkeit und Erbrechen (N: nausea), Gleichgewichtsstörungen und Schwindel (I: imbalance), Dysästhesien und „stromschlagartige Phänomene“ (S: sensory disturbance), Ängstlichkeit, Agitation und Reizbarkeit (H: hyperarousal) [4].
In der Substanzklasse der SSRI bestehen Unterschiede in der Auftretenswahrscheinlichkeit von Absetzphänomenen zwischen den verschiedenen Substanzen. So treten Absetzphänomene beispielsweise im Rahmen einer Medikation mit Fluoxetin tendenziell selten auf (vergleichsweise lange Halbwertszeit) im Vergleich zu einer Medikation mit Paroxetin (vergleichsweise kurze Halbwertszeit).
Die Auftretenswahrscheinlichkeit und die Art der Absetzphänomene anderer Substanzklassen aus der Gruppe der Antidepressiva sind tendenziell weniger gut beforscht. Zusammenfassend scheinen Absetzphänomene beim Absetzen von SNRI, trizyklischen Antidepressiva und Monoaminoxidase-(MAO-)Inhibitoren häufiger und schwerer als bei SSRI zu sein. Beim Absetzen von Agomelatin scheinen Absetzphänomene hingegen nur selten aufzutreten. Für andere Antidepressiva (z. B. Mirtazapin oder Bupropion) liegen zum aktuellen Zeitpunkt noch keine belastbaren Daten vor. Ein umfassender Überblick hierzu findet sich bei Henssler et. al. [22].
Im Gegensatz zu Absetzphänomenen versteht man unter einem Rebound ein rasches und verstärktes Wiederauftreten der Grunderkrankung nach Beendigung oder Reduktion der Ziel-Symptom-beeinflussenden Medikation, meist innerhalb eines Zeitraums von sechs Wochen. Im Unterschied zu Absetzphänomenen, die eher körperlicher Natur (z. B. „Stromschläge“, „Gleichgewichtsstörungen“, „grippeähnlich“) sind, sich von Symptomen der Grunderkrankung anamnestisch differenzieren lassen und transient sind, sind die Symptome eines Rebounds länger anhaltend und beschreiben eine Verschlechterung des psychopathologischen Befunds [7, 9].
Unter einem Rückfall (Relapse) hingegen wird ein Wiederauftreten der Symptome der Episode der Grunderkrankung nach initial erfolgreicher Behandlung und Absetzen der Medikation verstanden. Die Symptome der Grunderkrankung treten zeitlich verzögert und meist mit schrittweiser Zunahme der Ausprägung wieder auf. Hiervon abzugrenzen ist der Begriff des Rezidivs, bei dem es sich um eine erneute Krankheitsepisode nach vorheriger Genesung, also eingetretener Remission handelt (Remission über sechs bis neun Monate).
Es existieren kaum Hinweise dafür, dass das Risiko eines Rückfalls durch die vorherige Einnahme eines Antidepressivums erhöht ist [1]. Anhand der aktuellen Studienlage ist davon auszugehen, dass eine gewisse Behandlungsdauer mit einem Antidepressivum notwendig ist, um die Auftretenswahrscheinlichkeit von Absetzphänomenen zu begünstigen (am ehesten vier bis acht Wochen). Bezüglich der Behandlungsdauer scheint es bislang keine eindeutigen Befunde zu geben, die einen Zusammenhang zwischen der Behandlungsdauer und der Auftretenswahrscheinlichkeit von Absetzphänomenen zeigen.
Abhängigkeit
Seit Bekanntwerden spezifischer Absetzsymptome bei der Beendigung einer Medikation mit Antidepressiva besteht die Diskussion über die begriffliche und ätiologische Zuordnung der Absetzerscheinungen als „Entzugssyndrom“ und entsprechend des Bestehens einer „Abhängigkeit“ von ebendiesen Substanzen. Bezieht man sich auf die diagnostischen Kriterien nach ICD-10, so liegt eine Abhängigkeit von einer Substanz vor, wenn mindestens drei der sechs Kriterien Toleranzentwicklung, starkes Verlangen nach der Substanz, Kontrollverlust über den Konsum, körperliches Entzugssyndrom nach Absetzen, Interessenverlust zugunsten der Substanz und fortgesetzter Konsum trotz schädlicher Folgen erfüllt sind. Die Toleranzentwicklung und Entzugssymptome können bei Einnahme von Antidepressiva vergleichbar mit der Einnahme anderer psychotroper Substanzen als gegenregulatorische adaptive Prozesse verstanden werden. Ein Kontrollverlust, ein starkes Verlangen nach der Substanz, Interessenverlust und fortgesetzter Konsum trotz körperlicher Schäden werden jedoch allenfalls in Einzelfällen beobachtet, wodurch die Kriterien der Diagnose einer Abhängigkeitserkrankung für den Großteil der Patienten nicht erfüllt sind.
Pharmakodynamische und pharmakokinetische Eigenschaften bedingen Absetzphänomene
Durch die Gabe von Antidepressiva über einen gewissen Zeitraum erfolgen neurobiologische Adaptationsprozesse, beispielsweise in Bezug auf die Rezeptoraktivierung und Rezeptordichte. Ein abruptes Absetzen der Substanz führt dementsprechend zu Ungleichgewichten in der Homöostase des jeweiligen Rezeptor- und Transmittersystems. Durch langsamere, kleinschrittige Dosisreduktion wird eine Anpassung des Rezeptor-Transmitter-Systems an die jeweils veränderte Beeinflussung durch die Substanz ermöglicht.
Phänomenologisch entsprechen Absetzphänomene häufig dem Resultat der anzunehmenden neuroadaptiven Gegenregulation mit anschließender „Überreaktion“ nach Wegfall der entsprechenden Substanz. So sind bei anticholinerg-wirksamen Substanzen (z. B. trizyklische Antidepressiva) Symptome zu beobachten, die einer cholinergen Überstimulation entsprechen. Ähnlich zeigen sich beim Absetzen von serotonerg wirksamen Substanzen (z. B. SSRI) durch Gegenregulationsprozesse „hyperserotonerge“ Symptome als Folge einer über die Blockade hinausgehenden adaptiven Reduktion von Serotonintransportern nach dauerhafter Einnahme eines SSRI.
Beim Vergleich verschiedener Substanzen und Substanzklassen von Antidepressiva zeigen sich Zusammenhänge zwischen der Halbwertszeit der jeweiligen Substanz und der Auftretenswahrscheinlichkeit, Dauer und Schwere von Absetzphänomenen. Zusammenfassend kann beobachtet werden, dass mit einer kürzeren Halbwertszeit die Auftretenswahrscheinlichkeit und die Schwere der Symptome zunehmen. Bisher wenig erforscht, aber immerhin denkbar, sind entsprechend auch Zusammenhänge und Unterschiedene hinsichtlich der individuellen Metabolisierung von Substanzen und Beeinflussung durch Induktions- und Inhibitionsprozesse bei Polymedikation. Die Berücksichtigung der individuellen Situation eines Patienten durch Bestimmung von Wirkstoffkonzentrationen und des individuellen Metabolismus-Profils könnte diesbezüglich einen positiven Effekt haben (vgl. Kasuistik 1).
Kasuistik 1
Der 45-jährige Herr S. erhielt vor 15 Jahren im Zusammenhang mit einer Gastroskopie, bei der er eine Panikattacke erlebt habe, kurzerhand Venlafaxin in einer Tagesdosierung von bis zu 150 mg. Passager wiederkehrende Symptome von Angst und Panik seien im Verlauf rückläufig gewesen. Schließlich sei die Dosierung schrittweise reduziert worden. Angst- und Paniksymptome traten nicht weiter auf.
Herr S. wünschte in der Folge ein vollständiges Absetzen der Medikation. Nach Reduktion auf 37,5 mg (kleinste verfügbare Tagesdosierung) erfolgten multiple Versuche eines vollständigen Absetzens, die jedoch allesamt scheiterten. Auch mithilfe eines Pendelschemas (tageweiser Wechsel der Einnahme von 37,5 mg und Nicht-Einnahme) gelang das Absetzen nicht. Herr S. bemerkte regelmäßig etwa 24 Stunden nach der letzten Einnahme subjektiv erheblich belastende Symptome in Form von stromschlagartigen Missempfindungen, Schwindel und Imbalancen, grippeartigen Ganzkörperschmerzen, Übelkeit und Schlafstörungen. Die Symptome zeigten sich bei erneuter Einnahme von Venlafaxin rasch rückläufig. Das vollständige Absetzen der Medikation gelang über Jahre nicht. Im Verlauf der folgenden 15 Jahre entwickelte Herr S. eine Alkoholabhängigkeit, die teilweise mit dem Auftreten der Absetzphänomene, insbesondere der Schlaflosigkeit, in Zusammenhang stand.
Nach der Aufnahme zur qualifizierten Entgiftung von Alkohol erfolgte ein neuerlicher Absetzversuch. In Wirkstoffspiegelkontrollen zeigte sich unter aktueller Medikation mit Venlafaxin 37,5 mg pro Tag eine Wirkstoffkonzentration von 87,7 ng/ml für Venlafaxin und eine Wirkstoffkonzentration des aktiven Metaboliten O-Desmethylvenlafaxin unterhalb der Nachweisgrenze. Phänotypisch lag damit ein „poor metabolizer“ für das hauptsächlich an der Metabolisierung beteiligte Cytochrom-P450-(CYP-)Isoenzym 2D6 vor.
Nach Aufklärung des Patienten erfolgte eine viertägige parallele Eindosierung von Escitalopram 5 mg in Tropfenform (1 Tropfen entspricht etwa 1 mg Escitalopram). Nach vier Tagen konnte die Medikation mit Venlafaxin unter Weiterführung der Medikation mit Escitalopram beendet werden. Der Patient beschrieb einzig ein leichtes Schwindelgefühl, das vorher beschriebene Vollbild der Absetzerscheinungen trat nicht mehr auf. Es erfolgte eine wochenweise Reduktion der Medikation mit Escitalopram um 1 mg. Nach Fortführung des letzten Reduktionsschritts von 1 mg über einen Zeitraum von vier Wochen konnte die Medikation vollständig abgesetzt werden.
Praxis des Absetzens und Ausblick
Aktuelle Strategien bezüglich des Absetzens von Antidepressiva orientieren sich an pharmakodynamischen und pharmakokinetischen Überlegungen, wobei das Instrument des therapeutischen Drug-Monitorings dabei helfen kann, durch eine Berücksichtigung der individuellen Pharmakokinetik Absetzphänomene abzumildern.
In den aktuellen Leitlinien wird ein schrittweises Absetzen der antidepressiven Medikation über einen Zeitraum von vier Wochen empfohlen [38]. Außer für eine Medikation mit Fluoxetin (kürzerer Zeitraum des Absetzens) gibt es keine substanzspezifischen Empfehlungen für den Prozess des Absetzens.
Absetzphänomene sind allerdings häufig, in Übersichtsarbeiten treten diese im Mittel bei etwa 56 % der Patienten auf und können über einen Zeitraum von Tagen bis Monaten persistieren [12]. Im Vergleich zu den in Leitlinien empfohlenen relativ kurzen Zeiträumen der Dosisreduktion scheinen kleinschrittigere Dosisreduktionen über einen längeren Zeitraum die Auftretenswahrscheinlichkeit und Schwere der Absetzphänomene zu reduzieren [25].
Hierbei haben sich verschiedene Ansätze zur Durchführung eines Absetzens von Antidepressiva etabliert. Während beispielsweise Fluoxetin angesichts der langen Halbwertszeit oft abrupt abgesetzt wird, ist es bei anderen Antidepressiva eher üblich, diese in mehreren Reduktionsschritten über einen längeren Zeitraum abzusetzen. Escitalopram wird beispielsweise pragmatisch über einen Zeitraum von vier Wochen in 5-mg-Reduktionsschritten abgesetzt, ehe der letzte Reduktionsschritt beispielsweise durch die Umstellung auf eine flüssige Darreichungsform milligrammweise ausgeschlichen wird (20-mg-, 15-mg-, 10-mg-, 5-mg-Tagesdosis).
In Hinblick auf neurobiologische Adaptationsprozesse ergeben sich zahlreiche Argumente dafür, verfügbarkeitsbasierte Schemata (aufgrund verfügbarer [kleinster] Einzeldosierungen) kritisch zu hinterfragen und alternative Ansätze zu prüfen. Darauf basierend konzentriert sich die aktuelle Forschung auf alternative, theoretisch-experimentell orientierte Verfahren, welche die Auftretenswahrscheinlichkeit und Schwere der Absetzphänomene positiv zu beeinflussen scheinen.
Ähnlich wie bei der Reduktion von Benzodiazepinen ist eine nicht-lineare Reduktion zu empfehlen, die die Adaptation des Systems in Hinblick auf die zu erwartende Transporter- bzw. Rezeptorbesetzung berücksichtigt (vgl. Abschnitt „Absetzen von Antipsychotika“). Die exponentielle Reduktion der Substanz führt zu einer linearen Reduktion der zu erwartenden Transporter- bzw. Rezeptorbesetzung, wodurch große Sprünge in der jeweiligen Besetzung vermieden werden. Dementsprechend erfolgen proportionale Reduktionsschritte von jeweils 10 % der aktuellen Dosis anstelle von Dosisreduktionen um jeweils eine fixe Milligramm-Einheit, wodurch zu Beginn in Bezug auf die Gesamtmenge größere Reduktionsschritte erfolgen als zum Ende der Reduktion („go slow when you go low“). Hierdurch entstehen zum Ende der Reduktion Dosierungen jenseits einer therapeutisch wirksamen Dosis, beispielsweise „0,8 mg Citalopram“ (eine Übersicht hierzu findet sich in [25]).
In der Praxis ergeben sich bei der Umsetzung solcher Reduktionsschemata Schwierigkeiten bezüglich der Verfügbarkeit kleinster Dosierungen in Tablettenform. Ist das jeweilige Antidepressivum alternativ in Tropfenform erhältlich, können gegebenenfalls über Verdünnung kleinste Dosierungen eingenommen werden (Beispiele für Antidepressiva in Tropfenform: Escitalopram, Trimipramin, Paroxetin, Fluoxetin, Sertralin, Amitriptylin, Doxepin, Mirtazapin).
Prävention von Absetzphänomen
Das Auftreten von Absetzphänomenen ist je nach Substanz oft nicht zu verhindern. Jedoch kann an mehreren Zeitpunkten im Rahmen der Therapie positiv darauf Einfluss genommen werden. Zentral hierbei ist eine kritische Prüfung der Indikation einer Medikation bereits vor Beginn einer medikamentösen Behandlung. Auch eine Aufklärung der Patienten bezüglich der Möglichkeit des Auftretens von Absetzphänomenen und deren Reversibilität im Sinne einer Psychoedukation kann den Prozess positiv beeinflussen. Anzunehmen ist zudem eine positive Beeinflussung der Symptomatik durch eine ausreichende Aufklärung der Angehörigen und niedrigschwellige psychotherapeutische Interventionen im Rahmen des Absetzversuchs. Gegebenenfalls ist eine symptomorientierte medikamentöse Behandlung, beispielsweise von Schlafstörungen, sinnvoll.
Optional ist, ähnlich zum Vorgehen in der Behandlung von Benzodiazepin-Entzugssyndromen, eine Umstellung einer kurzwirksamen Substanz auf eine langwirksame Substanz, im Falle einer Behandlung mit Antidepressiva, beispielsweise Fluoxetin, möglich, um dieses im Anschluss zu reduzieren („Fluoxetin Rescue“).
Dabei hat das Erkennen von Absetzphänomenen eine große klinische Relevanz für die korrekte Diagnose und Zuordnung der aktuellen Problematik und das weitere therapeutische Vorgehen. Bei Fehlinterpretationen kann dies zu einer Wiederaufnahme einer eventuell unnötigen Medikation, einem Absetzen einer grundsätzlich sinnvollen Medikation bei Umstellung des Antidepressivums oder einer Fehldiagnose (z. B. bei manisch oder hypoman anmutenden Symptomen mit der [Fehl-]Diagnose einer bipolaren affektiven Störung) führen. Zentral ist und bleibt die kritische Prüfung der Notwendigkeit einer Medikation bereits zu Therapiebeginn. Bezüglich des konkreten Vorgehens beim Absetzen von Antidepressiva existieren vielversprechende alternative Ansätze zum bisherigen Vorgehen.
Absetzen von Antipsychotika
Systematische Untersuchungen über Absetzphänomene bei einer Antipsychotikatherapie existieren kaum. Ein kürzlich erschienenes systematisches Review konnte aus mehr als 18 000 Studien lediglich fünf Studien mit nur 261 Patienten auswerten, um die Häufigkeiten von Absetzphänomenen bei Beendigung einer Antipsychotikatherapie zu bewerten. Hier zeigten sich Absetzphänomene bei 53 % der Patienten nach abrupter Beendigung einer Antipsychotikatherapie [6].
Die Frage nach der Dauer einer antipsychotischen Behandlung bei der Diagnose einer Erkrankung aus dem schizophrenen Formenkreis wird nach Erscheinen der Neufassung der S3-Leitlinie „Schizophrenie“ [14] anders beantwortet als zuvor. So hat sich die Empfehlung der vormals häufig geforderten lebenslangen Einnahme nach einer zweiten Krankheitsepisode hin zu einem individuellen Vorgehen gewandelt. Tiihonen und Kollegen zeigten, dass eine moderate bis hohe Antipsychotika-Exposition grundsätzlich mit niedrigeren Mortalitätsraten einhergeht, als dies bei unbehandelten Patienten gleicher Erkrankungen der Fall ist [44]. In einer naturalistischen Beobachtungsstudie über zehn Jahre aus Dänemark konnte gezeigt werden, dass der Anteil ersterkrankter Patienten mit einer Psychose, die medikamentös behandelt wurden, hinsichtlich ihrer Symptomfreiheit in etwa demjenigen Anteil entsprach, der auch ohne Dauertherapie symptomfrei war [19]. Gleichzeitig zeigten Takeuchi und Kollegen, dass sich die 50%-Response-Raten auf die gleiche Antipsychotikatherapie zwischen einer ersten und einer zweiten Episode signifikant unterschieden. So zeigten sich 50%-Response-Raten bei 48,7 % der Ersterkrankten vs. 10,4 % bei einer zweiten Episode nach Woche 7; bzw. bei 88,2 vs. 27,8 % in Woche 27 trotz deutlich höherer Antipsychotikadosierungen im Rahmen der Zweiterkrankung [43]. Diese Befunde zeigen, dass die Dauer und Dosishöhe einer Behandlung mit Antipsychotika sehr individuell gestaltet sein muss.
Bereits zu Beginn der Verordnung einer Antipsychotikatherapie ist die Aufklärung der Patienten über die mögliche individuelle Verordnungsdauer und mögliche Absetzphänomene der Medikation geboten und sinnvoll, um die langfristige Adhärenz zu fördern. Grundsätzlich sollte in der Aufklärung und Therapieplanung gemeinsam mit dem Patienten über das gewählte Präparat und die Behandlungsdauer im Sinn eines „shared decision makings“ entschieden werden [37].
Unter einer langfristigen Verordnung von Antipsychotika treten mehr unerwünschte Arzneimittelwirkungen, insbesondere Gewichtzunahme, Bewegungsstörungen und eine subjektive Sedierung auf als unter Placebo. Daher spielt in der Verordnungspraxis die Abwägung des Nutzens der antipsychotischen Medikation gegenüber der Belastung des Patienten durch unerwünschte Arzneimittelwirkungen eine wichtige Rolle [30].
Dauer der antipsychotischen Behandlung
Vor der Frage nach dem Absetzen der Antipsychotika steht zumeist die Frage nach der Dauer der Einnahme. Die aktuelle S3-Leitlinie Schizophrenie empfiehlt gegenüber der alten Fassung keine Zeiträume mehr für die Einnahme der antipsychotischen Medikation nach einer erstmaligen psychotischen Episode. Die englischen NICE-Guidelines hingegen empfehlen eine kontinuierliche antipsychotische Behandlung und fordern, die Patienten über ein hohes Risiko eines Rückfalls bei Absetzen der Medikation in den ersten beiden Jahren nach der psychotischen Episode aufzuklären [34].
Zeitpunkt des Absetzens
Eine Arbeitsgruppe um Tiihonen untersuchte über einen Zeitraum von bis zu 20 Jahren 9000 Patienten mit einer Erkrankung aus dem schizophrenen Formenkreis im Rahmen einer Follow-up-Studie. Hier gelang es nicht, einen sicheren Zeitpunkt zu ermitteln, zu dem das Absetzen der Antipsychotika nicht mit der Zunahme eines Rückfallrisikos einherging [45]. Der Expertenkonsensus der aktuellen Leitlinie Schizophrenie zur Behandlungsdauer wird daher durch individuelle Faktoren beeinflusst. Hier sollte durch die Behandler und Patienten unter anderem die Schwere der Erkrankungsepisode, komplementäre Therapieangebote, die soziale Situation und das Vorliegen unerwünschter Arzneimittelwirkungen berücksichtigt werden [14].
Neuroadaptation und Supersensitivitätspsychosen
Der Zusammenhang zwischen einer Antipsychotika-induzierten Supersensitivität und einem damit verbundenen Rebound-Phänomenen bei Reduktion und Absetzen einer antipsychotischen Medikation ist Gegenstand der aktuellen Forschung. Bereits seit den 70er-Jahren fand der Begriff der Supersensitivitätspsychose Eingang in Diskussion und Forschung zu Rezidiven bei Psychoseerkrankungen [18, 28]. Ein erneutes Auftreten einer psychotischen Episode nach Absetzen der Medikation steht hiernach in Zusammenhang mit Adaptationsprozessen nach langfristiger Einnahme von Antipsychotika [24]. Die Neuroadaptation, vermittelt durch eine dauerhafte Dopamin-Rezeptorblockade, führt zu einer dopaminergen Supersensitivität, die auch nach Absetzen von Antipsychotika anhält [42]. In tierexperimentellen Studien und funktioneller Bildgebung zeigen sich Hinweise dafür, dass der Effekt der dopaminergen Supersensitivität für den Zeitraum von mehreren Monaten bis hin zu einem Jahr anhält [24]. Diese Befunde lassen Rückschlüsse auf die klinischen Erfahrungen der Entstehung einer antipsychotischen Therapieresistenz, Spätdyskinesien und einer Abnahme der Wirksamkeit von Antipsychotika im Behandlungsintervall zu. Hieraus lassen sich weitere Empfehlungen bezüglich des praktischen Vorgehens beim Absetzen von Antipsychotika ableiten.
Einem Konzept von Seeman et al. zufolge besteht in verschiedenen Bereichen des menschlichen Gehirns eine erhöhte Anzahl von Dopamin-D2-Rezeptoren in einem Zustand hoher Affinität für Dopamin, dem sogenannten D2High-Zustand [40, 41]. Dieses Konzept wird unter anderem als pharmakologisches Erklärungsmodell für Antipsychotika-induzierte Supersensitivitätspsychosen angesehen. Demnach existiert der Dopamin-D2-Rezeptor entweder in einem Zustand niedriger Affinität für Dopamin (D2Low) oder eben in einem Zustand hoher Affinität (D2High). Die Langzeitanwendung von Antipsychotika erhöht dabei die Dichte von Dopaminrezeptoren im Striatum, wie es in einem Modell von Chouinard et al. vorgeschlagen wurde (Abb. 2) [10]. Demnach kommt es nicht zu einer signifikanten Veränderung von Dopaminsynthese, -freisetzung und -wiederaufnahme in die Präsynapse. Durch die erhöhte Anzahl von Dopamin-D2-Rezeptoren im Zustand hoher Affinität (D2High) kommt es zu einem verstärkten Dopamin-Signalling mit konsekutiver Supersensitivität (Abb. 2 rechts).
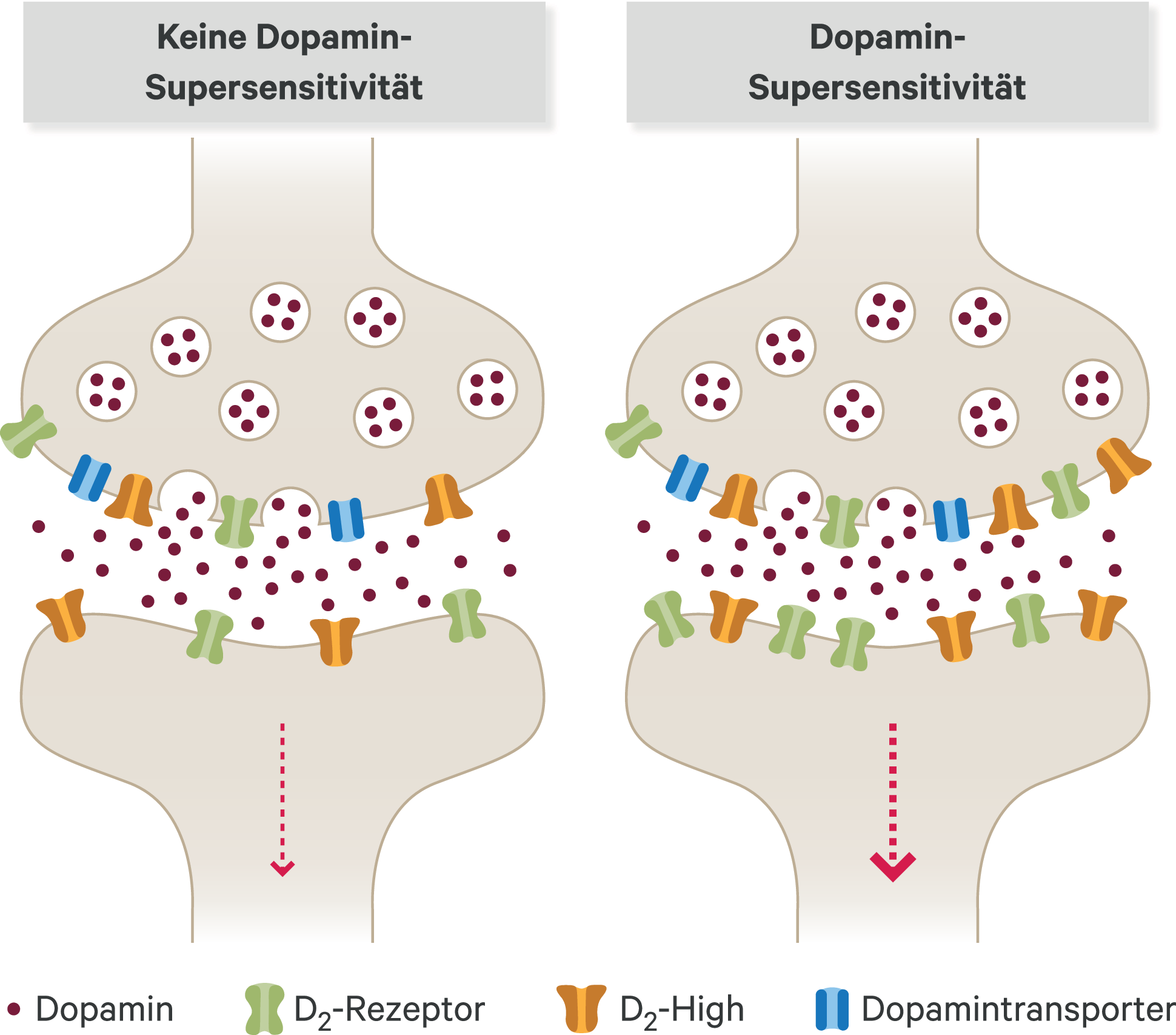
Abb. 2. Modell einer Supersensitivitätspsychose auf molekularer Ebene (eigene Darstellung nach [10])
Einstellung auf die minimale effektive Dosierung
Grundsätzlich wird eine Einstellung auf die niedrigste mögliche wirksame Dosierung, die sogenannte minimale effektive Dosierung (minimum effective dose) empfohlen [29]. Auch die deutsche Leitlinie empfiehlt in der Rezidivprophylaxe, die individuell niedrigste mögliche Dosierung der Medikation zu wählen, die mit einer guten Abwägung des Verhältnisses von Wirkung und möglichen unerwünschten Arzneimittelwirkungen einhergeht [14].
Im Verlauf einer Erkrankung aus dem schizophrenen Formenkreis entwickeln viele Patienten, insbesondere nach mehrfachen Krankheitsepisoden, hirnstrukturelle Veränderungen, die mit kognitiven Einschränkungen und einer lokalen Hirnvolumenminderung einhergehen [23a]. In Befunden aus funktioneller Bildgebung zeigte sich ein möglicher Zusammenhang zwischen der Dauer und Dosierung der verordneten antipsychotischen Medikation und dem Grad der Hirnvolumenminderung. Gleichzeitig bestehen weitere Umweltfaktoren, die neben der Erkrankung selbst und der antipsychotischen Medikation einen Einfluss auf Hirnvolumen und kognitive Funktionen bei Patienten mit schizophrenen Erkrankungen haben, sodass in diesem Feld weiterer Forschungsbedarf besteht [33]. Die bereits vorliegenden Befunde unterstreichen jedoch die Empfehlung der Einstellung auf eine möglichst niedrige antipsychotische Gesamtdosierung [27].
Minimale effektive Dosierungen sind in diesem Zusammenhang solche, die in zumindest einer Akutphase signifikant besser als Placebo abgeschnitten haben. Hierbei wurden auf Grundlage geeigneter Studien Äquivalenzdosen für Haloperidol, Chlorpromazin und atypische Antipsychotika festgelegt (Tab. 3) [29].
Tab. 3. Minimale effektive Dosierung ausgewählter Antipsychotika [14, 29]
|
Antipsychotikum |
Minimal effektive Dosis [mg] |
|
Aripiprazol |
10 |
|
Cariprazin |
1,5 |
|
Clozapin |
300 |
|
Haloperidol |
4 |
|
Olanzapin |
7,5 |
|
Quetiapin |
150 |
|
Risperidon |
2 |
|
Ziprasidon |
40 |
Darüber hinaus besteht eine Consensus-Empfehlung für eine 30 % niedrigere Dosierung für ersterkrankte Patienten und 50 % niedrigere Dosierung für ältere Patienten gegenüber den in der klinischen Praxis üblicherweise gewählten Dosierungen. In einer Expertenbefragung zeigten sich zudem Empfehlungen, die antipsychotische Medikation bei einer bipolaren Depression oder einer Langzeit-Erhaltungstherapie zur Stimmungsstabilisierung bei einer bipolaren Störung um durchschnittlich 25 % niedriger zu dosieren als bei einer akuten Manie oder eine akuten Episode einer Erkrankung aus dem schizophrenen Formenkreis. Dem gegenüber stehen die Befunde einer im Durchschnitt 25 % erhöhten Dosierung gegenüber der mittleren Verordnungsdosis bei schweren psychotischen Episoden oder unzureichender Response der psychotischen Symptome auf die Medikation [17].
Intermittierende vs. kontinuierliche Therapie
Die Entscheidung zu einer kontinuierlichen gegenüber einer intermittierenden Einnahme der antipsychotischen Medikation in der Erhaltungstherapie ist eine individuelle, die in der Praxis häufig auf den Patientenwunsch nach einer Medikamentenreduktion oder einem Absetzen der Medikation folgt. Eine Metaanalyse von de Hert et al. zeigt eine erhöhte Rezidivrate für Menschen mit mehrfachen Krankheitsepisoden, die intermittierend behandelt oder auf Placebo umgestellt wurden, gegenüber solchen, die eine kontinuierliche Behandlung erhalten. Zudem ist die Zeit bis zum Auftreten eines Rückfalls unter kontinuierlicher Erhaltungstherapie deutlich länger als unter intermittierender Therapie oder Placebo [13]. Insbesondere für Patienten mit chronischen Krankheitsverläufen und mehrfachen psychotischen Episoden kann die Empfehlung einer kontinuierlichen antipsychotischen Medikation in der ursprünglich eingestellten Dosierung gegeben werden, um das Risiko einer erneuten Krankheitsphase zu minimieren [28].
Andere Befunde zeigen sich bei Patienten nach einer ersten Erkrankungsphase. Hier finden sich ähnliche Befunde in der Rückfallhäufigkeit im Vergleich einer kontinuierlichen mit einer intermittierenden Therapie, bei der der psychische Befund der Patienten sorgfältig in Bezug auf Zeichen einer erneuten Krankheitsepisode überwacht und entsprechend die Medikation angepasst oder wieder begonnen wird. In dieser Patientengruppe besteht eine bessere Adhärenz bei Behandlungsplanung einer intermittierenden Medikation [15].
Es kam jedoch auch bei Patienten nach einer ersten Erkrankungsepisode bei einem Absetzen der antipsychotischen Medikation etwa doppelt so häufig zu einem Erkrankungsrückfall als unter einer kontinuierlichen Medikamentengabe [46]. Diese Befunde unterstreichen die Wichtigkeit des Symptommonitorings nach dem Absetzen und die Sinnhaftigkeit eines Wiederbeginns der Medikation bei Auftreten von Frühwarnzeichen, um für die Patienten die langfristig beste individuelle Behandlungsstrategie zu wählen.
Zusammenfassend ist festzustellen, dass bei ersterkrankten Patienten einer intermittierenden antipsychotischen Medikation der Vorrang gegeben werden kann. Bei wiederholten Krankheitsepisoden zeigen die Befunde eine deutlich erhöhte Rezidivgefahr beim Absetzen von Antipsychotika. Das Absetzen einer antipsychotischen Medikation sollte in einer gemeinsamen Entscheidungsfindung mit den Patienten unter Aufklärung über das Rezidivrisiko und Ausschöpfen nichtmedikamentöser Behandlungsoptionen erfolgen.
Therapeutisches Drug-Monitoring: Risikokontrolle, Therapieoptimierung und Absetzhilfe
Ein Instrument zur Steuerung von Wirkung, Vermeidung von Nebenwirkung und zur Unterstützung der Beendigung einer Psychopharmakotherapie ist das therapeutische Drug-Monitoring (TDM). TDM bedeutet Dosisoptimierung durch Quantifizierung von Arzneistoffkonzentrationen im Blut als Werkzeug einer individualisierten Psychopharmakotherapie [23].
Die Aufgabe von TDM ist es, herauszufinden, ob für die Therapie eines Patienten eine individuell wahrscheinlich wirksame Dosis ausgewählt wurde, bei der mit therapeutischem Ansprechen gerechnet werden kann und das Risiko des Auftretens von Nebenwirkungen minimal ist.
Die angestrebten Wirkstoffkonzentrationen des Psychopharmakons im Blut basieren auf dem Konzept des „therapeutischen Referenzbereichs“. Man geht davon aus, dass es für therapeutische und toxische Wirkungen jeweils eine minimal effektive Konzentration gibt. Der Bereich zwischen beiden Konzentrationen wird als therapeutischer Referenzbereich einer Substanz definiert. Etablierte therapeutische Referenzbereiche unterschiedlicher Psychopharmaka und die konsentierten Empfehlungsgrade zur Durchführung von TDM zeigt Tabelle 4.
Tab. 4. Therapeutische Referenzbereiche und Empfehlungsgrade zur Anwendung von TDM ausgewählter Psychopharmaka (nach [34a])
|
Substanz(en) |
Referenzbereich |
Empfehlungsgrad |
|
Antidepressiva |
||
|
Amitriptylin + Nortriptylin |
80–200 ng/ml |
1 |
|
Citalopram |
50–110 ng/ml |
1 |
|
Duloxetin |
30–120 ng/ml |
2 |
|
Escitalopram |
15–80 ng/ml |
2 |
|
Fluoxetin + N-Desmethylfluoxetin |
120–500 ng/ml |
3 |
|
Fluvoxamin |
60–230 ng/ml |
2 |
|
Mirtazapin |
30–80 ng/ml |
2 |
|
Milnacipran |
100–150 ng/ml |
2 |
|
Nortriptylin |
70–170 ng/ml |
1 |
|
Paroxetin |
20–65 ng/ml |
3 |
|
Sertralin |
10–150 ng/ml |
2 |
|
Venlafaxin + O-Desmethylvenlafaxin |
100–400 ng/ml |
2 |
|
Antipsychotika |
||
|
Amisulprid |
100–320 ng/ml |
1 |
|
Aripiprazol + Dehydroaripiprazol |
100–350 bzw. 150–500 ng/ml |
1 |
|
Cariprazin |
10–20 ng/ml |
2 |
|
Clozapin |
350–600 ng/ml |
2 |
|
Haloperidol |
1–10 ng/ml |
3 |
|
Olanzapin |
20–80 ng/ml |
2 |
|
Paliperidon |
20–60 ng/ml |
2 |
|
Quetiapin/N-Desalkylquetiapin |
100–500/100–250 ng/ml |
2 |
|
Risperidon + 9-Hydroxyrisperidon |
20–60 ng/ml |
1 |
|
Ziprasidon |
50–200 ng/ml |
3 |
|
Stimmungsstabilisierer |
||
|
Carbamazepin |
4–10 µg/ml |
1 |
|
Lamotrigin |
1–6 µg/ml |
2 |
|
Lithiumsalze |
0,5–1,2 mmol/l |
1 |
|
Valproinsäure |
50–100 µg/ml |
1 |
TDM: therapeutisches Drug-Monitoring; Empfehlungsgrade: 1: dringend empfohlen; 2: empfohlen; 3: nützlich
So wie therapeutisches Drug-Monitoring dazu genutzt werden kann, eine Pharmakotherapie erfolgreich zu gestalten, so ist es auch denkbar, das Beenden einer Psychopharmakotherapie durch die Anwendung von TDM zu begleiten. So lässt sich beispielsweise die schrittweise Abdosierung durch TDM begleiten oder es können – wie in Kasuistik 1 beschrieben – pharmakokinetische Besonderheiten aufgedeckt werden, die handlungsleitend für ein Absetzen einer bestehenden Pharmakotherapie sind.
Vorgehen beim Absetzen von Antipsychotika – Vermeidung von Absetzsymptomen
Horowitz et al. beschreiben einen an der D2-Rezeptorbesetzung sich orientierenden Vorteil einer hyperbolen Dosisreduktion (Abb. 3 rechts) gegenüber einer linearen Dosisreduktion (Abb. 3 links). Im Falle der linearen Dosisreduktion empfehlen die Autoren zudem ein sequenzielles Halbieren der Dosierung, das mit einem geringeren Rückfallrisiko einhergehen sollte anstelle eines schrittweise gleichförmigen Absetzens mit starren Dosisreduktionsschritten [24].
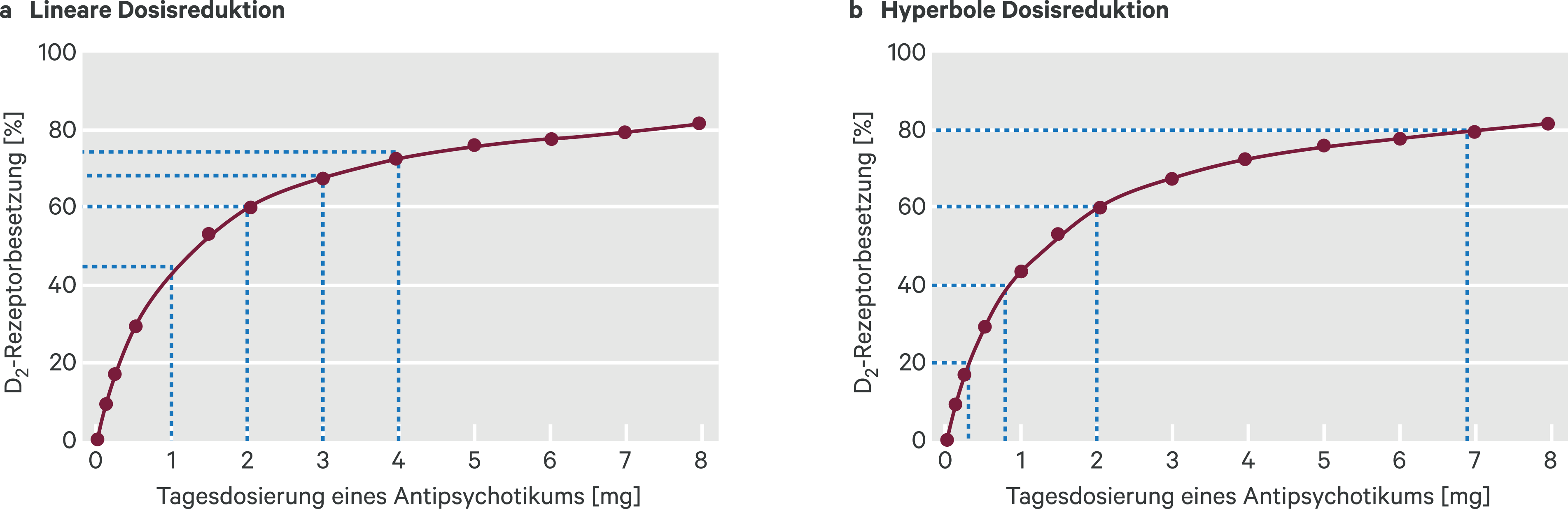
Abb. 3. Lineare Dosisreduktion (links) mit Reduktionsschritten gemäß den kleinsten verfügbaren Einheiten eines Antipsychotikums (hier: Risperidon); hyperbole Dosisreduktion (rechts) basierend auf einer schrittweisen Abnahme der Dopamin-D2-Rezeptorbesetzung (eigene Darstellung nach [24])
Am Beispiel der Reduktion von Risperidon zeigen die Autoren, dass bei einer linearen Dosisreduktion (Abb. 3a: Risperidon-Reduktion in den Schritten 4 mg zu 3 mg zu 2 mg zu 1 mg zu 0 mg) der Reduktionsschritt von 1 mg zum vollständigen Absetzen mit einer Reduktion der D2-Rezeptorblockade um 44,6 % einhergeht. Es kann angenommen werden, dass diese recht große relative Reduktion der Rezeptorblockade mit einer höheren Rückfallgefahr einhergehen kann. Dem gegenüber steht eine weniger schnelle Reduktion der D2-Rezeptorblockade, werden die Reduktionsschritte auch in geringeren Dosisbereichen durch sequenzielle Halbierung der Dosierung gewählt (Risperidon-Reduktion in den Schritten 4 mg zu 2 mg zu 1 mg zu 0,5 mg zu 0,25 mg zu 0,125 mg zu 0 mg) [24].
Das Konzept der hyperbolen Dosisreduktion (Abb. 3b) basiert auf der Verringerung der Tagesdosierung beispielsweise anhand einer berechneten 10%-Abnahme der Dopamin-D2-Rezeptorblockade alle drei bis sechs Monate. Hierdurch können abrupte Verringerungen der D2-Rezeptorblockade verhindert werden. Horowitz et al. berechnen beispielsweise Tagesdosierungen von Risperidon bei einer 80%igen D2-Blockade von 6,9 mg Risperidon. Eine 60%ige D2-Blockade werde demnach mit einer Tagesdosierung von 2,0 mg erreicht, für eine 40%ige D2-Blockade reichen 0,82 mg Risperidon pro Tag, entsprechend für eine 30%ige Blockade nur noch 0,30 mg pro Tag [24]. Allerdings scheint ein solches Vorgehen ausschließlich mit titrierbaren Flüssigkeitsgaben verfügbarer Antipsychotika denkbar.
Die praktische Empfehlung der aktuellen S3-Leitlinie sieht dementsprechend vor, Reduktionsschritte zu Beginn in größeren und am Ende in kleineren Schritten vorzunehmen. Die Reduktionsschritte sollten demnach etwa 5 bis 20 % der aktuellen Dosis betragen. Reduktionen sollten im Abstand von 6 bis 12 Wochen erfolgen. In der Praxis ist hier eine Behandlungsplanung anhand des psychischen Befundes des Patienten und der zur Verfügung stehenden Standarddosierungen der verordneten Präparate sinnvoll [14].
Kasuistik 2
Der 22-jährige Informatikstudent Herr D. erkrankte an einer ersten Episode einer paranoiden Schizophrenie und wurde aufgrund eines ausgeprägten Verfolgungswahns und der Überzeugung, sein Computer sei gehackt worden, zunächst auf einer geschützten Akutstation und später auf einer Spezialstation für „Psychosen“ behandelt. Es erfolgte die Einstellung auf eine Medikation mit Risperidon in einer Tagesdosis von 4 mg. TDM ergab für die aktive Wirkfraktion (Summe der Wirkstoffkonzentration von Risperidon und 9-Hydroxyrisperidon) einen Wert von 52 ng/ml (therapeutischer Referenzbereich: 20 bis 60 ng/ml; vgl. Tab. 4). Im Anschluss an die stationäre Behandlung wurde er in einer psychiatrischen Institutsambulanz weiterbehandelt. Herr D. berichtete bereits wenige Wochen nach der Entlassung von einer unangenehmen Müdigkeit über Tag und wünschte ein schnellstmögliches Absetzen der Medikation. Er hatte gleichzeitig sein Studium und Sozialkontakte wieder aufgenommen. Es erfolgte eine ausführliche Aufklärung über das Rezidivrisiko nach Absetzen der Medikation; individuelle Frühwarnzeichen des Patienten wurden ermittelt. Entsprechend der S3-Leitlinie wurde eine Reduktion der Medikation um zunächst 0,5 mg (Empfehlung 5 bis 20 % der aktuellen Dosis) und eine Wiedervorstellung nach sechs Wochen empfohlen. Beim nächsten Termin berichtete der Patient davon, die Medikation nun ganz abgesetzt zu haben und sich zu freuen, dass die Nebenwirkungen komplett weg seien. Die erneute Einnahme einer kleineren Risperidon-Dosierung wurde von ihm zu diesem Zeitpunkt nicht gewünscht.
Vier Wochen später kam es zu einer notfallmäßigen Vorstellung in Begleitung seiner Mutter. Er schlafe seit vier Tagen sehr schlecht, könne sich nicht mehr auf die Prüfungsvorbereitung konzentrieren und war der Überzeugung, in seiner Studentenwohnung sei etwas im Gange, woraufhin er die Wohnung seiner Eltern aufgesucht hatte. Aufgrund der deutlichen Frühwarnzeichen einer erneuten psychotischen Episode wurde die Medikation mit Risperidon bis zu einer Tagesdosierung von 2 mg (entsprechend der minimal effektiven Dosis) rasch eindosiert. Die Symptomatik war rückläufig. Der Summenspiegel von Risperidon und 9-Hydroxyrisperidon lag bei 34 ng/ml (20 bis 60 ng/ml), UAWs traten nicht mehr auf. In der Therapieplanung entschied sich Herr D., die Medikation nun zunächst für die Dauer von zwei Semestern einzunehmen, bevor er erneut über ein Absetzen entscheiden wollte. Für das Absetzen wurde eine sequenzielle Halbierung der Dosierung von Risperidon auch in geringeren Dosisbereichen vorbesprochen.
Vor einer Reduktion der Dosierung ist es sinnvoll zu überprüfen, ob es bereits erfolglose Versuche der Dosisreduktion gab. Zudem sollte mit den Patienten und den Angehörigen eine ausführliche Aufklärung über die Rezidivgefahr nach Absetzen der Antipsychotika und über Frühwarnzeichen der Psychose vorgenommen werden.
Absetzsymptome treten dabei meist innerhalb von Tagen bis Wochen nach deutlicher Dosisreduktion oder nach schnellem Absetzen der Antipsychotika auf [14]. Hier sind psychische Symptome (Unruhe, Reizbarkeit, Depression, Angst), vegetative Symptome (Übelkeit, Schwindel, Schwitzen, Tachykardie, übermäßige Schmerzempfindlichkeit) und kognitive Störungen zu nennen. Darüber hinaus kann es zur Entwicklung von Absetzdyskinesien in Form abnormer unwillkürlicher Bewegungen (orofaziale Muskulatur, obere Extremitäten, untere Extremitäten) kommen, die über Monate persistieren können. Metaanalysen zeigen allerdings keinen Unterschied in der Häufigkeit von Rückfällen bei abruptem gegenüber graduellem Absetzen. Es ist jedoch davon auszugehen, dass ein kleinschrittiges Absetzen mit einem geringeren Risiko von Absetzphänomenen einhergeht. Die Leitlinie bezeichnet das Vorgehen als eine „kontrollierte Dosisreduktion“.
Fazit
Die Diskussion über das richtige Vorgehen beim Absetzen von Psychopharmaka ist eine bereits lange bestehende Fragestellung mit einer kontroversen Diskussion möglicher Zusammenhänge bezüglich des besten Outcomes für die Patienten. In den aktuellen Leitlinien überwiegt die Empfehlung einer langsamen kleinschrittigen Dosisreduktion, die einen Vorteil in Bezug auf die Rückfallgefahr in eine Krankheitsepisode und die Reduktion von Absetzphänomenen mit sich bringt. Bereits in der Einstellung auf ein Psychopharmakon sollte die niedrigste wirksame Erhaltungsdosis für den Patienten erwogen werden.
In der Phase des Absetzens können insbesondere in den letzten Absetzschritten sehr kleine Dosierungen sinnvoll sein. Hierauf wird derzeit beispielsweise durch die Entwicklung und den Einsatz von „Tapering-Strips“ reagiert, die derzeit in einem Off-Label-Gebrauch zur Verfügung stehen und die Dosisreduktion bei Absetzphänomenen erleichtern sollen. In einigen Fällen entscheiden sich Patienten und Behandler für eine langfristige Erhaltungstherapie mit der niedrigsten verfügbaren Dosierung gegenüber einem kompletten Absetzen der Medikation, um die individuelle Rückfallgefahr zu minimieren. Ein hilfreiches Mittel beim Absetzen kann auch der Einsatz des therapeutischen Drug-Monitorings sein. Essenziell ist die Aufklärung der Patienten über Frühwarnzeichen und eine differenzierte Unterscheidung von wiederauftretenden Symptomen bei einem Rückfall von Absetzphänomenen bei Dosisreduktion.
Interessenkonflikterklärung
Dr. Paulzen erhielt 2020/2021 Honorare für Vorträge und Beratungsleitungen von Lundbeck, Neuraxpharm, Janssen Cilag, Novartis und Otsuka. Er ist Herausgeber von PSIAC, einem internetbasierten Interaktionsprogramm mit der Schwerpunktsetzung auf Psychopharmaka. Ein Interessenkonflikt bezüglich des Beitrags besteht nicht. Dr. Kirchner und Dr. Schreckenbach berichten keinen Interessenkonflikt.
Literatur
1. Andrews PW, Kornstein SG, Halberstadt LJ, Gardner CO, et al. Blue again: perturbational effects of antidepressants suggest monoaminergic homeostasis in major depression. Front Psychol 2011;2:159.
2. Baldwin DS, Cooper JA, Huusom AK, Hindmarch I. A double-blind, randomized, parallel-group, flexible-dose study to evaluate the tolerability, efficacy and effects of treatment discontinuation with escitalopram and paroxetine in patients with major depressive disorder. Int Clin Psychopharmacol 2006;21:159–69.
3. Barmer. BARMER Arzneimittelreport 2020.
4. Berber MJ. FINISH: remembering the discontinuation syndrome. Flu-like symptoms, insomnia, nausea, imbalance, sensory disturbances, and hyperarousal (anxiety/agitation). J Clin Psychiatry 1998;59:255.
5. Bjork JM, Gaytan O, Patt N, Swann AC, et al. Behavioral tolerance to and withdrawal from multiple fluoxetine administration. Int J Neurosci 1998;93:163–79.
6. Brandt L, Bschor T, Henssler J, Müller M, et al. Antipsychotic withdrawal symptoms: a systematic review and meta-analysis. Front Psychiatry 2020;11:569912.
7. Busche M, Bschor T. Absetzen von Antidepressiva. Neurotransmitter 2019;30:26–30.
8. Carey B, Gebeloff R. Many people taking antidepressants discover they cannot quit. (2018). https://www.nytimes.com/2018/04/07/health/antidepressants-withdrawal-prozac-cymbalta.html (Zugriff am 15.05.2021).
9. Chouinard G, Chouinard VA. New classification of selective serotonin reuptake inhibitor withdrawal. Psychother Psychosom 2015;84:63–71.
10. Chouinard G, Samaha AN, Chouinard VA, Peretti CS, et al. Antipsychotic-induced dopamine supersensitivity psychosis: pharmacology, criteria, and therapy. Psychother Psychosom 2017;86:189–219.
11. Cosci F, Chouinard G. Acute and persistent withdrawal syndromes following discontinuation of psychotropic medications. Psychother Psychosom 2020;89:283–306
12. Davies J, Read J. A systematic review into the incidence, severity and duration of antidepressant withdrawal effects: are guidelines evidence-based? Addict Behav 2019;97:111–21.
13. De Hert M, Sermon J, Geerts P, Vansteelandt K, et al. The use of continuous treatment versus placebo or intermittent treatment strategies in stabilized patients with schizophrenia: a systematic review and meta-analysis of randomized controlled trials with first- and second-generation antipsychotics. CNS Drugs 2015;29:637–58.
14. Gaebel W, Hasan A, Falkai P. S3-Leitlinie Schizophrenie. Berlin, Heidelberg: Springer, 2019.
15. Gaebel W, Janner M, Frommann N, Pietzcker A, et al. First vs multiple episode schizophrenia: two-year outcome of intermittent and maintenance medication strategies. Schizophr Res 2002;53:145–59.
16. Gardier AM, Lepoul E, Trouvin JH, Chanut E, et al. Changes in dopamine metabolism in rat forebrain regions after cessation of long-term fluoxetine treatment: relationship with brain concentrations of fluoxetine and norfluoxetine. Life Sci 1994;54:Pl51–6.
17. Gardner DM, Murphy AL, O’Donnell H, Centorrino F, et al. International consensus study of antipsychotic dosing. Am J Psychiatry 2010;167:686–93.
18. Gardos G, Cole JO. Maintenance antipsychotic therapy: is the cure worse than the disease? Am J Psychiatry 1976;133:32–6.
19. Gotfredsen DR, Wils RS, Hjorthøj C, Austin SF, et al. Stability and development of psychotic symptoms and the use of antipsychotic medication – long-term follow-up. Psychol Med 2017;47:2118–29.
20. Groot PC, Van Os J. How user knowledge of psychotropic drug withdrawal resulted in the development of person-specific tapering medication. Ther Adv Psychopharmacol 2020;10:2045125320932452.
21. Groot PC, Van Os J. Outcome of antidepressant drug discontinuation with taperingstrips after 1–5 years. Ther Adv Psychopharmacol 2020;10:2045125320954609.
21a. Hengartner MP, Schulthess L, Sorensen A, Framer A. Protracted withdrawal syndrome after stopping antidepressants: a descriptive quantitative analysis of consumer narratives from a large internet forum. Ther Adv Psychopharmacol 2020;10:2045125320980573.
22. Henssler J, Heinz A, Brandt L, Bschor T. Antidepressant withdrawal and rebound phenomena. Dtsch Arztebl Int 2019;116:355–61.
23. Hiemke C, Bergemann N, Clement HW, Conca A, et al. consensus guidelines for therapeutic drug monitoring in neuropsychopharmacology: update 2017. Pharmacopsychiatry 2018;51:9–62.
23a. Ho BC, Andreasen NC, Ziebell S, Pierson R, Magnotta V. Long-term antipsychotic treatment and brain volumes: a longitudinal study of first-episode schizophrenia. Arch Gen Psychiatry 2011;68:128–37.
24. Horowitz MA, Murray RM, Taylor D. Tapering antipsychotic treatment. JAMA Psychiatry 2021;78:125–6.
25. Horowitz MA, Taylor D. Tapering of SSRI treatment to mitigate withdrawal symptoms. Lancet Psychiatry 2019;6:538–46.
26. Hotopf M, Hardy R, Lewis G. Discontinuation rates of SSRIs and tricyclic antidepressants: a meta-analysis and investigation of heterogeneity. Br J Psychiatry 1997;170:120–7.
27. Huhn M, Leucht C, Rothe P, Dold M, et al. Reducing antipsychotic drugs in stable patients with chronic schizophrenia or schizoaffective disorder: a randomized controlled pilot trial. Eur Arch Psychiatry Clin Neurosci 2021;271:293–302.
27a. Jauhar S, Hayes J. The war on antidepressants: What we can, and can’t conclude, from the systematic review of antidepressant withdrawal effects by Davies and Read. Addictive behaviors 2019;97:122–5.
28. Leucht S, Davis JM. Do antipsychotic drugs lose their efficacy for relapse prevention over time? Br J Psychiatry 2017;211:127–9.
29. Leucht S, Samara M, Heres S, Patel MX, et al. Dose equivalents for second-generation antipsychotics: the minimum effective dose method. Schizophr Bull 2014;40:314–26.
30. Leucht S, Tardy M, Komossa K, Heres S, et al. Antipsychotic drugs versus placebo for relapse prevention in schizophrenia: a systematic review and meta-analysis. Lancet 2012;379:2063–71.
31. Lohse MJ. Psychopharmaka. In: Schwabe U, Ludwig W-D (Hrsg.). Arzneiverordnungs-Report 2020. Berlin, Heidelberg: Springer, 2020:781–814.
32. Murata Y, Kobayashi D, Imuta N, Haraguchi K, et al. Effects of the serotonin 1A, 2A, 2C, 3A, and 3B and serotonin transporter gene polymorphisms on the occurrence of paroxetine discontinuation syndrome. J Clin Psychopharmacol 2010;30:11–7.
33. Murray RM, Quattrone D, Natesan S, Van Os J, et al. Should psychiatrists be more cautious about the long-term prophylactic use of antipsychotics? Br J Psychiatry 2016;209:361–5.
34. NICE Clinical Guideline (2014). Psychosis and schizophrenia in adults: prevention and management. https://www.nice.org.uk/guidance/cg178 (Zugriff am 15.05.2021).
34a. Paulzen M, Liebe C, Gründer G. Labormonitoring vor und während Psychopharmakotherapie – Schritt für Schritt. PSYCH up2date 2021;15:187–96.
35. Renoir T. Selective serotonin reuptake inhibitor antidepressant treatment discontinuation syndrome: a review of the clinical evidence and the possible mechanisms involved. Front Pharmacol 2013;4:45.
36. Rosenbaum JF, Fava M, Hoog SL, Ascroft RC, et al. Selective serotonin reuptake inhibitor discontinuation syndrome: a randomized clinical trial. Biol Psychiatry 1998;44:77–87.
37. Rummer A, Scheibler F. Informierte Entscheidung als patientenrelevanter Endpunkt. Dtsch Ärztebl 2016;113:A322–44.
38. Schneider F, Härter M, Schorr S. S3-Leitlinie/Nationale VersorgungsLeitlinie Unipolare Depression. Berlin, Heidelberg: Springer-Verlag, 2017.
39. Schurig AM, Böhme M, Just KS, Scholl C, et al. Adverse drug reactions (ADR) and emergencies: the prevalence of suspected ADR in four emergency departments in Germany. Dtsch Ärztebl Int 2018;115:251.
40. Seeman P. All roads to schizophrenia lead to dopamine supersensitivity and elevated dopamine D2(high) receptors. CNS Neurosci Ther 2011;17:118–32.
41. Seeman P, Weinshenker D, Quirion R, Srivastava LK, et al. Dopamine supersensitivity correlates with D2high states, implying many paths to psychosis. Proc Natl Acad Sci U S A 2005;102:3513–8.
42. Servonnet A, Samaha AN. Antipsychotic-evoked dopamine supersensitivity. Neuropharmacology 2020;163:107630.
43. Takeuchi H, Siu C, Remington G, Fervaha G, et al. Does relapse contribute to treatment resistance? Antipsychotic response in first- vs. second-episode schizophrenia. Neuropsychopharmacology 2019;44:1036–42.
44. Tiihonen J, Mittendorfer-Rutz E, Torniainen M, Alexanderson K, et al. Mortality and cumulative exposure to antipsychotics, antidepressants, and benzodiazepines in patients with schizophrenia: an observational follow-up study. Am J Psychiatry 2016;173:600–6.
45. Tiihonen J, Tanskanen A, Taipale H. 20-year nationwide follow-up study on discontinuation of antipsychotic treatment in first-episode schizophrenia. Am J Psychiatry 2018;175:765–73.
46. Wunderink L, Nienhuis FJ, Sytema S, Slooff CJ, et al. Guided discontinuation versus maintenance treatment in remitted first-episode psychosis: relapse rates and functional outcome. J Clin Psychiatry 2007;68:654–61.
Priv.-Doz. Dr. med. Michael Paulzen, Dr. med. Tobias Schreckenbach, Dr. med. Miriam Kirchner, Alexianer Krankenhaus Aachen, Alexianergraben 33, 52062 Aachen, E-Mail: m.paulzen@alexianer.de
Withdrawal of psychotropic drugs. Antidepressants and antipsychotic drugs
The prescription of antidepressants and antipsychotics has grown considerably over the last years. Mostly, there are good reasons for long term prescriptions not only in the courses of a severe mental illness. However, whenever a new psychopharmacotherapy is started, a strategy for a treatment discontinuation should be considered as a matter of principle; otherwise, long term medications increase the risk of pharmacodynamic and pharmacokinetic interactions especially in the case of polymedication. Physicians and patients have to be aware that the cessation of an often long-lasting psychopharmacotherapy may provoke discontinuation- and/or withdrawal symptoms.
The article highlights antidepressant withdrawal symptoms and shows how they can be managed. Regarding antipsychotic pharmacotherapy, the concept of supersensitivity psychosis is presented. With a linear vs. a hyperbolic dose reduction, two fundamentally different approaches for antipsychotic dose reduction are introduced. Finally, the use of therapeutic drug monitoring (TDM) can help to alleviate the occurrence of withdrawal symptoms in the case of treatment discontinuation with psychotropic drugs via a stepwise decline of plasma concentrations.
Key words: Antidepressants, antipsychotics, withdrawal syndrome, rebound, supersensitivity psychosis, therapeutic drug-monitoring
Psychopharmakotherapie 2021; 28(04):155-167
