Anna Grunze, Wiesloch, Emanuel Severus, Dresden, Walter E. Müller, Worms/Frankfurt, und Heinz Grunze, Schwäbisch Hall/Nürnberg
In Rahmen des Weiterbildungscurriculums Psychopharmakologie/Pharmakotherapie berichteten die Autoren im letzten Jahr bereits zu Lithium [79]. Dieser Beitrag soll nun in erweiterter, ergänzter und aktualisierter Form weitere und vertiefende Informationen zur Lithium-Behandlung vermitteln.
Lithium ist das drittkleinste Atom unseres chemischen Ordnungssystems (Ordnungszahl 3, Ladungszahl 1). Es ist ein Leichtmetall und zählt zu den Alkalimetallen wie Natrium und Kalium. Innerhalb dieser Gruppe hat es die höchste elektrische Dichte mit der höchsten Affinität zur Hydratation, und auf der anderen Seite einen Ionenradius ähnlich den divalenten Kationen Magnesium und Calcium. In Form seiner Salze kommt es überall in der Natur vor und ist auch Bestandteil des menschlichen Körpers in sehr niedrigen Konzentrationen, allerdings ohne wohl eine physiologische Funktion aufzuweisen. Erst in sehr viel höheren Konzentrationen haben Lithiumionen spezifische pharmakologische, aber auch toxische Effekte.
Der erste medizinische Gebrauch von Lithiumsalzen liegt weit über hundert Jahre zurück, als man bei Gicht durch die Gabe von Lithiumbromid Harnsäure als Lithiumurat ausschwemmen wollte. In diesem Rahmen hat man auch symptomatische Effekte bei psychiatrischen Patienten gesehen, allerdings war man sich nicht sicher, ob diese eher durch die bekannten sedierenden Effekte von Bromid erklärt werden können.
Die Geschichte der Lithium-Behandlung speziell von affektiven Störungen beginnt im 19. Jahrhundert. Die dänischen Psychiater und Neurologen Frederik und Carl Lange beschrieben 1886 die Wirksamkeit von Lithium als Vorbeugung bei rezidivierenden Depressionen [110]. Danach geriet Lithium in der Psychiatrie etwas in Vergessenheit. Quasi wiederentdeckt wurde es 1949 in Australien durch John Cade, der die antimanische Wirkung von Lithium zunächst im Tierversuch an Nagern und anschließend an Patienten beschrieb [33]. Weitere Kasuistiken australischer und französischer Mediziner folgten [171]. Die systematische Forschung zu Lithium hinsichtlich seiner Indikationen, aber auch Nebenwirkungen ist dann in den Folgejahren hauptsächlich ein Verdienst zweier dänischer Psychiater, Mogens Schou und Poul Baastrup, die die prophylaktische Wirksamkeit bei bipolaren Störungen und rezidivierenden Depressionen beschrieben [10]. In den USA waren es zunächst Samuel Gershon [67] und George Winokur [40], die sich mit der Lithium-Therapie auseinandersetzten. Eine weitergehende Verbreitung und Etablierung in den USA ist vor allem dem Einsatz von Jeff Jefferson von der University in Madison, Wisconsin, zu verdanken [92]. Seitdem wird Lithium bei rezidivierenden affektiven Erkrankungen nicht nur weltweit klinisch eingesetzt, sondern ist auch unverändert Gegenstand weiterer wissenschaftlicher Forschung, insbesondere durch die International Group for the Study of Lithium Treated Patients (IGSLI, https://www.igsli.org). Zusätzlich werden durch den Umstand, dass Lithium als Referenzsubstanz in zahlreichen Phase-III-Studien zu neuen Stimmungsstabilisierern eingesetzt wird, neue Erkenntnisse zur Lithium-Therapie gewonnen, insbesondere auch im Vergleich zu anderen Behandlungsoptionen.
Psychopharmakologie
Medizinisch verwendet wird Lithium in Form verschiedener Salze (Aspartat, Carbonat, Sulfat), als Tabletten oder Retardtabletten (zur besseren Verträglichkeit durch Vermeidung von Serumspiegelspitzen). In Deutschland sind nur retardierte Lithiumcarbonat-Präparate auf dem Markt.
Wirkungsmechanismus
Trotz seiner großen Bedeutung ist der Wirkungsmechanismus von Lithium bis heute nicht final geklärt und auf alle Fälle komplex, beginnend mit Wirkungen auf die neuronale Erregbarkeit bis zu Effekten auf die gestörte Neuroplastizität als möglicher gemeinsamer Nenner aller Stimmungsstabilisierer.
Es wird angenommen, dass Lithiumionen die Homöostase von anderen Alkalimetallionen, besonders aber von Natrium über verschiedene Mechanismen direkt beeinflussen können, während Effekte auf die Calcium-Leitfähigkeit eher sekundär bzw. indirekt sind. Als Folge kann es zu hemmenden, aber auch aktivierenden Effekten auf die neuronale Aktivität kommen. Allerdings gibt es keine belastbaren Daten, dass diese direkten Effekte auf die neuronale Ionenhomöostase ursächlich an der Wirksamkeit bei affektiven Störungen beteiligt sind.
Auf der anderen Seite kann Lithium verschiedene Mechanismen der zentralen Neurotransmission auf Rezeptorebene aktivierend oder hemmend modulieren [111]. So kann beispielsweise Lithium die Ausbildung von Supersensitivität von Dopamin- und Acetylcholin-Rezeptoren hemmen. Von besonderer Bedeutung sind die Effekte von Lithium auf die intrazelluläre Signalweiterleitung. Lithium hemmt die Aktivität der Adenylatcyclase und der Guanylatcyclase als Schlüsselenzyme der intrazellulären Signaltransduktion. Die über Phospholipase C und Inositoltriphosphat (IP3) vermittelte intrazelluläre Übertragung wird durch eine Hemmung der Inositol-1-Phosphatase und eine daraus resultierende verringerte Bereitstellung des IP3-Bausteins Inositol nachhaltig reduziert. Diesen Effekt zeigen wahrscheinlich auch Carbamazepin und Valproinsäure [22]. Das serotonerge System scheint von diesem Mechanismus besonders betroffen zu sein. Darauf weisen auch Befunde hin, dass eine per Positronenemissionstomographie (PET) nachgewiesene erniedrigte Serotonin-(5-HT-)Bindungskapazität und geringere 5-HT1A-Rezeptorbindung vor Lithium-Behandlungsbeginn Prädiktoren einer höheren Remissionsrate bei der bipolaren Depression sind [7].
Während diese Mechanismen analog zu den anderen Stimmungsstabilisierern letztlich auf eine Beeinflussung der neuronalen Erregbarkeit durch Lithium hinweisen, konnte bis heute keiner dieser möglichen Mechanismen final als entscheidend identifiziert werden, auch nicht durch viele aktuelle pharmakogenetische Untersuchungen über mögliche Targets [146], und letztlich auch nicht durch die langjährige Forschung mit dem Ziel, die hohe erbliche Komponente bipolarer Erkrankungen auf spezifische Gene zurückführen zu können [71]. Darüber hinaus sind Effekte auf die neuronale Erregbarkeit eher mit den akuten antimanischen und gegebenenfalls auch antidepressiven Effekten von Lithium in Verbindung zu bringen als mit den rezidivprophylaktischen Eigenschaften.
Eine heute favorisierte Hypothese der prophylaktischen Wirksamkeit geht auf zum Teil schon länger bekannte neuroprotektive und antiapoptotische Eigenschaften von Lithium zurück. Diese werden stark unterstützt durch die im oberen therapeutischen Dosisbereich für Lithium gefundene Hemmwirkung auf Glykogen-Synthase-Kinase 3 (GSK-3). GSK-3 ist in viele intrazelluläre Signalkaskaden involviert; durch ihre Hemmung wird die Bildung neurotropher Faktoren wie des Transkriptionsfaktors CREB oder des Neurotrophins BDNF erhöht, aber auch des antiapoptotischen Faktors Bcl-2 (Abb. 1). Als wichtigste Zielorganelle hat man das endoplasmatische Retikulum [2] sowie die Mitochondrien identifiziert. Letzteres ist auch vor dem Hintergrund der sich immer deutlicher abzeichnenden Befunde über mitochondriale Funktionsstörungen bei bipolaren Erkrankungen von Bedeutung. Eine Verminderung der Anzahl mitochondrialer DNA-Kopien und Verkürzung der Telomere bei bipolaren Patienten werden als Ausdruck eines beschleunigten Alterungsprozesses gesehen [59]. In vitro zeigt Lithium eine Mitochondrien-schützende bzw. die mitochondriale Funktion verbessernde Wirkung [113]. Ähnliche Effekte hat man auch für Valproinsäure und mit Einschränkung für Carbamazepin gesehen. Man geht daher heute davon aus, dass positive Effekte auf gestörte Mechanismen der Neuroplastizität, ähnlich wie bei den Antidepressiva [129], eine zentrale Rolle in der Wirkung von Stimmungsstabilisierern spielen [36, 111, 160, 174]. Dieser Effekt wäre dann eine wichtige gemeinsame Endstrecke im Wirkungsmechanismus der rezidivprophylaktischen Wirkung aller klinisch eingesetzten Stimmungsstabilisierer, was auch bei einigen atypischen Antipsychotika, beispielsweise Quetiapin, mit von Bedeutung zu sein scheint (Abb. 1).
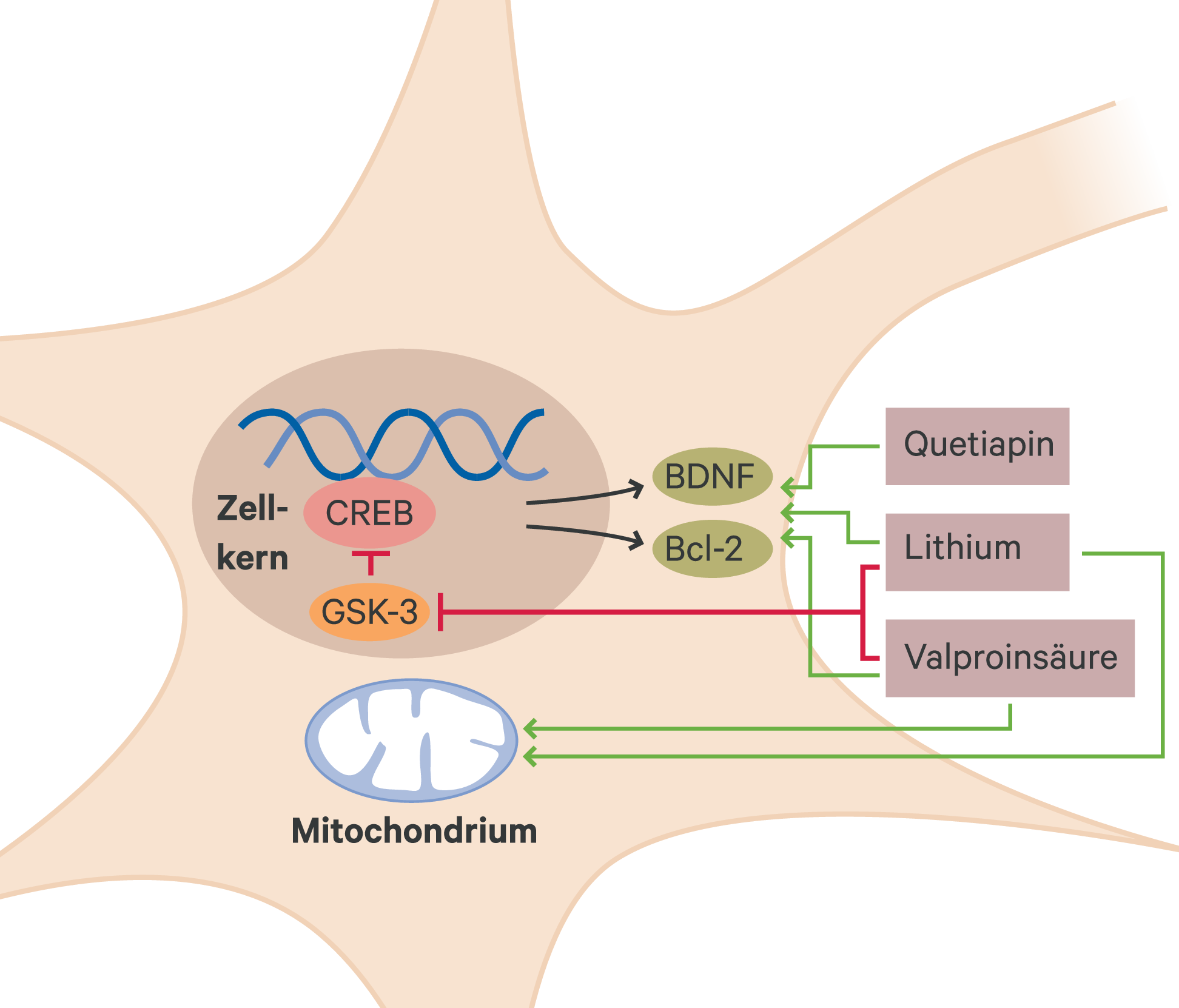
Abb. 1. Schematische Darstellung über die pharmakologische Beeinflussung von Neuroplastizität und mitochondrialer Dysfunktion als eine mögliche gemeinsame Endstrecke im biochemischen Wirkungsprofil von Stimmungsstabilisatoren (nach [130]); Bcl-2: „B-cell lymphoma“, ein antiapoptotischer Faktor; BDNF: brain-derived neurotrophic factor; CREB: cAMP response element-binding protein, ein Transkriptionsfaktor; GSK-3: Glykogen-Synthase-Kinase 3
Der neuroprotektive Effekt von Lithium ist mittlerweile in vitro [192] und in vivo, auch am Patienten, beschrieben. Magnetresonanztomographische (MRT-)Untersuchungen zeigen signifikant weniger Verluste grauer Hirnsubstanz, insbesondere im limbisch-kortikalen Bereich, bei bipolaren Patienten unter Lithium-Therapie im Vergleich mit nicht oder anderweitig behandelten Patienten [82, 89, 183].
Pharmakokinetik
Die Pharmakokinetik von Lithium wird durch den Ionencharakter und die damit verbundene primäre Beteiligung von transmembranösen Transportmechanismen bestimmt. Lithium wird nach oraler Einnahme relativ langsam (tmax 4 bis 5 Stunden), aber trotzdem vollständig resorbiert. Durch eine Einnahme der heute üblichen retardierten Tabletten wird die Zeit bis tmax noch einmal verlängert, um die Spitzen-Serumspiegel zu reduzieren. Die Gewebeverteilung ist im Organismus eher gleich, mit deutlich geringeren intra- als extrazellulären (Serum-)Konzentrationen, was sich auch in dem Verteilungsvolumen von 0,7 bis 0,9 l/kg) widerspiegelt, und Plasma- und Hirngewebe-Spiegel korrelieren miteinander [180]. Das Verhältnis des Lithium-Spiegels zwischen Hirngewebe und Blutserum beträgt etwa 0,76, sowohl bei kurz- als auch langfristiger Einnahme [156]. Dabei ist dieser Wert deutlich altersabhängig: Kinder und Heranwachsende wiesen in einer MR-Spektroskopie-Studie einen Mittelwert von 0,58 auf, Erwachsene hingegen 0,92 [127]. Der Konzentrations-Peak fällt im Gehirn aber weniger ausgeprägt aus als im Serum (Verhältnis 0,5) [93]. [93]. Dies liegt daran, dass Lithiumionen in Neuronen schneller aufgenommen (über spannungsabhängige Natriumkanäle) als ausgeschieden (über Li+/Na+-Kotransport) werden [111]. Die tägliche Einmalgabe sollte also ausreichen, um wirksame Spiegel im zentralen Nervensystem aufrecht zu erhalten [116, 148, 163] und so die affektive Stabilität zu garantieren. Interessanterweise scheint sich Lithium bei bipolaren Patienten dabei im limbischen System, insbesondere im Bereich des linken Hippocampus, stärker als in anderen Hirnbereichen anzureichern [180].
Die Eliminationshalbwertzeit (t1/2) liegt bei 14 bis 30 Stunden und ist bei Älteren leicht verlängert und bei Jugendlichen etwas verkürzt. Beim Absetzen schließt sich an die primäre Eliminationsphase noch eine verzögerte Phase mit einer t1/2 von 36 bis 48 Stunden bei niedrigeren Serumspiegeln an, die auf eine langsame Redistribution aus dem Gewebe (auch dem ZNS) ins Blut zurückzuführen ist.
Aufgrund der hohen konzentrationsabhängigen Toxizität von Lithium spielt eine exakte Einhaltung des relativ engen therapeutischen Serumspiegelfensters eine große Rolle, sodass Änderungen der Pharmakokinetik erhebliche Relevanz für die Therapie mit Lithium haben können [22]. Besonders erwähnenswert sind hier erhöhte Lithiumserumspiegel durch Störungen des Elektrolyt- und Wasserhaushalts. Vereinfacht kann man davon ausgehen, dass die Lithiumausscheidung verringert ist bei Hyponatriämie oder anderen Situationen, wo die Natriumausscheidung reduziert ist, wie Dehydratation, Ödeme bzw. die Behandlung mit Diuretika. Dies gilt allerdings nur für Diuretika vom Thiazid-Typ, während Carboanhydrase-Hemmer die Lithiumelimination beschleunigen können und Schleifendiuretika wie Furosemid eher wenig an der Lithiumelimination ändern [144]. Weiter können ACE-(Angiotensin-Konversionsenzym-)Inhibitoren sowie nonsteroidale antiinflammatorische Arzneistoffe (NSAR) durch Hemmung der Cyclooxygenase mit konsekutiver Reduktion des Prostaglandin E2 den Lithium-Spiegel deutlich erhöhen. Wird eine Gabe dieser Arzneimittel erforderlich, ist die Lithium-Dosis entsprechend anzupassen, daher ist es wichtig, dass der Patient alle behandelnden Ärzte über die Lithium-Einnahme informiert (Lithiumpass, zu beziehen z. B. über https://dgbs.de/fileadmin/cust/dgbs-materialien/DGBS-Lithiumpass-web02.pdf).
Klinische Anwendung
Bipolare Störung
Manische Episode
Die antimanische Wirksamkeit von Lithium ist seit langem gut etabliert [77] und wurde jüngst durch eine Cochrane-Metaanalyse noch einmal bestätigt [119]. Die Metaanalyse basierte auf 36 randomisierten kontrollierten Studien (RCTs) mit 4220 Studienteilnehmern im Zeitraum bis Mai 2018, darunter auch drei Studien mit Kindern und Jugendlichen. Lithium erwies sich als signifikant wirksamer als Placebo. Im Vergleich zu anderen antimanischen Standardtherapien ließen sich keine Wirkunterschiede feststellen, bis auf eine Tendenz einer noch besseren Wirksamkeit von Olanzapin im direkten Vergleich. Hinsichtlich Studienabbruchraten zeigte sich auch kein signifikanter Unterschied zwischen Lithium und anderen Therapien, bei den Nebenwirkungen trat ein milder Tremor unter Lithium häufiger auf. Die initiale Kombination von Lithium mit Quetiapin als atypischem Antipsychotikum scheint eine Steigerung der antimanischen Wirksamkeit zu bedingen [30]. Auch für Kinder als primäre Studienzielgruppe bestätigte eine weitere Metaanalyse die Wirksamkeit von Lithium bei akuter Manie [49].
Gemischte Episode
Lithium wird in Guidelines nicht als primäre Akutbehandlung gemischter Episoden empfohlen, da es keine beweiskräftigen Studien zur Wirksamkeit gibt [80]. Argument für einen zusätzlichen Gebrauch von Lithium kann gegebenenfalls die hohe Suizidgefährdung bei Mischzuständen sein [159], auch wenn sich die antisuizidale Wirkung von Lithium erst im langfristigen Gebrauch zeigt.
Bipolare Depression
Als Wirksamkeitsnachweis von Lithium zur Akutbehandlung bipolarer Depressionen wird oft eine ältere Metaanalyse kleiner Studien angeführt, die aber alle für sich methodologisch zweifelhaft sind und zahlenmäßig wenig Aussagekraft haben [4, 175] (siehe hierzu auch [78]). Die bisher größte und aussagekräftigste Studie mit einem doppelblinden Studiendesign konnte für Lithium in keinem depressionsbezogenen Zielparameter Überlegenheit gegenüber Placebo zeigen, ganz im Unterschied zu dem Atypikum Quetiapin, das Placebo in allen Zielparametern signifikant überlegen war [204]. Wenn jedoch unter einer bestehenden Lithium-Prophylaxe eine depressive Episode auftritt, insbesondere nach Dosisreduktion/Spiegelerniedrigung, sollte man den Lithium-Serumspiegel zunächst wieder auf 0,6 bis 0,8 mmol/l anheben. Diese Maßnahme kann für sich allein bereits zu einer Remission der depressiven Symptomatik führen [81]. Abgesehen davon, dass ohnehin bei bipolarer Depression eine Indikation für Lithium besteht, kann bei therapieresistenten bipolaren Depressionen die Lithium-Augmentation (analog zur unipolaren Depression [siehe dort]) helfen, auch wenn die Datenlage hierzu noch unzureichend ist [182].
Erhaltungstherapie und Prophylaxe
Die prophylaktische Wirksamkeit von Lithium ist schon seit über fünf Jahrzehnten beschrieben [10]. Auch wenn die ersten Daten wegen methodischer Mängel der Studien eher zurückhaltend zu beurteilen sind, wurde die Langzeitwirksamkeit von Lithium eindrucksvoll in mehreren neueren Studien bestätigt. In diesen wurde Lithium als Vergleichssubstanz zum Prüfmedikament sowie Placebo getestet. Zusammenfassend schützt Lithium im Serumspiegelbereich zwischen 0,4 und 1,2 mmol/l tendenziell besser vor neuen manischen als vor neuen depressiven Phasen [169]. Insgesamt sind die Studienergebnisse bei Lithium-Langzeittherapie bezüglich der Manieprophylaxe relativ einheitlich und positiv, hinsichtlich der Verhütung neuer Depressionen kommen sie aber zu zum Teil unterschiedlichen Ergebnissen, wobei verschiedene Faktoren, wie das untersuchte Kollektiv, aber auch Unterschiede im Design eine Rolle spielen können [168].
Metaanalysen bestätigen die Wirksamkeit der Lithium-Prophylaxe bei bipolaren Störungen. Geddes und Mitarbeiter fanden in einer Metaanalyse von fünf Studien, dass unter Lithium im Verlauf von zwei Jahren 20 % weniger Rückfälle als unter Placebo auftreten [63]. Die Metaanalyse von Severus et al. (2014), die sieben Studien einschloss [167], zeigte im Placebo-Vergleich ebenfalls den rückfallverhütenden Effekt von Lithium für Manie und Episoden jeglicher Polarität, verfehlte für depressive Rückfälle aber knapp die Signifikanz (Manie: Risikoquotient [RR] 0,52; 95%-Konfidenzintervall [KI] 0,38–0,71; Depression: RR 0,78; 95%-KI 0,59–1,03; alle Episoden: RR 0,66; 95%-KI 0,53–0,82). Auch im Vergleich zur Prophylaxe mit verschiedenen stimmungsstabilisierenden Antiepileptika schnitt Lithium hinsichtlich der Verhütung neuer Manie besser ab, keine signifikanten Unterschiede fanden sich jedoch hinsichtlich Depressionsverhütung, Prophylaxe gegenüber Episoden jeglicher Polarität, und Abbruchraten [167]. Trotz signifikant höherer Rate an Studienabbrechern aufgrund von Gründen, die nicht mit einer neuen affektiven Episode zusammenhängen, beispielsweise Nebenwirkungen, vollendeten insgesamt mehr Patienten die Studien unter Lithium- als unter Placebo-Gabe.
Auch ein Review neuerer Studien von 2014 bis 2018 bestätigte diese Ergebnisse [166].
Im Unterschied zur Akutbehandlung gibt es durchaus Evidenz aus Post-hoc-Analysen und großen Registerstudien für eine Wirksamkeit von Lithium in der Prophylaxe von Mischzuständen bzw. der Verhütung neuer Episoden jeglicher Polarität nach einer gemischten Indexepisode [80].
Im Vergleich zu anderen Stimmungsstabilisierern legen offene Studien [100] sowie Registerstudien [84, 95, 102, 103, 108] mindestens Gleichwertigkeit, meist aber Überlegenheit der Lithium-Prophylaxe nahe, insbesondere auch, was wichtige Sekundärparameter wie Suizide/Suizidversuche angeht [173].
Die Studienlage für randomisierte, kontrollierte Vergleichsstudien ist deutlich dünner. Die multnationale BALANCE-Studie mit 330 Teilnehmern verglich in einem pragmatischen, offenen, aber randomisierten Design die Effektivität von Lithium, Valproinsäure und der Kombination beider Stimmungsstabilisierer [62]. Sie zeigte die Überlegenheit von Lithium gegenüber Valproinsäure in der Rückfallverhütung über einen Zeitraum von bis zu zwei Jahren [64].
Bipolar-II-Störung. Die Wirksamkeit von Lithium in der Prophylaxe bei Bipolar-II-Patienten ist deutlich schlechter untersucht als bei Bipolar-I-Patienten. Es gibt drei ältere Studien zu Lithium, allerdings mit nur geringen Fallzahlen [54, 96, 154], die Wirksamkeit suggerieren, diese aber wegen der zu geringen Fallzahlen nicht statistisch belegen können. Zur Frage, ob Unterschiede im Ansprechen auf Lithium zwischen Bipolar-I- und -II-Patienten bestehen, gibt es gegensätzliche Meinungen. Naturalistische Studienergebnisse sehen durchaus einen Nutzen der Lithium-Therapie bei Bipolar-II-Störungen. Tondo et al. [186, 187] sahen sogar Vorteile zugunsten von Bipolar-II-Patienten im Vergleich zu Bipolar-I-Patienten, ein Befund, der sich auch in einer weiteren naturalistischen Untersuchung bestätigte [61]. Insgesamt erscheint also Lithium auch bei Bipolar-II-Störungen als eine wichtige Option, auch wenn mehr wissenschaftliche Evidenz wünschenswert ist. Eine Empfehlung für Lithium bei Bipolar-II-Störungen ist auch vor dem Hintergrund der exzessiven Suizidmortalität bei Bipolar-II-Patienten zu sehen (siehe Abschnitt „Suizidalität“).
Rapid Cycling. Mindestens 15 bis 20 % aller Patienten mit bipolaren Störungen erleiden mindestens vier Krankheitsepisoden in einem Jahr (Rapid Cycling, RC). Dunner und Fieve (1974) erwähnten diese operationalisierte Einteilung erstmals in ihrer Prophylaxe-Studie [50]. Aus ihren Untersuchungen ging bereits hervor, dass Lithium bei RC weniger wirksam ist als bei Patienten mit wenigen Episoden. Der Wert dieser operationalisierten Einteilung mit einem Schwellenwert von vier Episoden ist allerdings eher zweifelhaft. Kupka et al. konnten zeigen, dass das Kriterium von vier Episoden keine Trennschärfe aufweist, sondern dass sich alle prognostischen Parameter parallel zur Zunahme der Episodenhäufigkeit verschlechtern, einschließlich dem Ansprechen auf jegliche medikamentöse Prophylaxe [107]. Eine relativ schlechtere Wirksamkeit bei Patienten mit häufigen Episoden ist auch kein Lithium-spezifisches Phänomen, sondern tritt, wenn vielleicht auch in unterschiedlicher Ausprägung, ebenso mit anderen Medikamenten auf.
In einer kontrollierten doppelblinden Vergleichsstudie zeigte sich kein Unterschied zwischen Lithium und Valproinsäure in der Wirksamkeit bei RC-Patienten [34]; beide zeigten nur einen mäßigen Effekt. Auch die Kombination von Lithium und Valproinsäure erwies sich bei RC-Patienten mit gleichzeitiger Suchterkrankung gegenüber der Lithium-Monotherapie als nicht überlegen [98]. In Ermangelung wirklich überzeugender Alternativen ist also ein RC-Verlauf kein primäres Ausschlusskriterium einer Lithium-Therapie.
An- und Absetzen einer Lithium-Prophylaxe
Da das Risiko eines Rückfalls unmittelbar nach einer Index-Episode am größten ist, ist es wichtig, dass ein prophylaktisch gegebenes Medikament, in diesem Falle Lithium, eine relativ schnelle Wirksamkeit zeigt. Drei Studien, die in einer Metaanalyse zusammengefasst wurden [185], konnten zeigen, dass sich bereits innerhalb der ersten zwei Wochen der Behandlung eine rückfallprophylaktische Wirksamkeit zeigen kann. Dies scheint jedoch primär für manische Rückfälle zu gelten, Wirksamkeit gegen depressive Episoden scheint erst im weiteren Verlauf der Behandlung einzutreten.
Inwieweit bei einem Wiederansetzen von Lithium nach zwischenzeitlichem Pausieren ein Wirkverlust auftritt, wird weiter kontrovers beurteilt. Gut dokumentierte Einzelfallberichte [152] stehen hier Mittelwerten aus kontrollierten Studien gegenüber [16]. Eine Metaanalyse der vorhandenen Daten konnte jedenfalls einen Wirkverlust nach zwischenzeitlichem Absetzen von Lithium nicht bestätigen [45].
Schizoaffektive Störung
Insgesamt ist die Evidenz für eine leitliniengerechte Behandlung schizoaffektiver Störungen für alle Medikamente gering; in Deutschland haben nur Ziprasidon und Paliperidon eine explizite arzneimittelrechtliche Zulassung. Zur Akutbehandlung schizoaffektiver Störungen mit Lithium fand ein kürzlich publizierter Review-Artikel [131] nur eine einzige Studie, die Lithium im Vergleich zu Chlorpromazin und Amitriptylin in akuten Episoden schizoaffektiver Störung in einem doppelblinden Design untersuchte. Bei den 19 schizomanischen Patienten stellten die Autoren vergleichbare Wirksamkeit von Chlorpromazin und Lithium fest. Nur unwesentlich besser ist die Evidenzlage für Lithium in der Prophylaxe neuer schizoaffektiver Episoden. Eine Subgruppenanalyse der deutschen MAP-Studie [72] lieferte Hinweise ohne Signifikanzniveau, dass Carbamazepin bei schizoaffektiven Patienten der Lithium-Therapie möglicherweise vorzuziehen ist. Dieser Trend fand sich allerdings bei einer nachfolgenden Erhebung fünf Jahre später so nicht bestätigt [11]. Sowohl Lithium als auch Carbamazepin führten über den Beobachtungszeitraum von durchschnittlich 6,8 Jahren zu einer deutlichen Reduktion der Tage im Krankenhaus (von 71 auf 11 Tage pro Jahr). Weitere Subgruppenanalysen der ursprünglichen über 2,5 Jahre gehenden MAP-Studie zeigten sowohl eine bessere Verträglichkeit und Patientenzufriedenheit als auch einen Trend für ein besseres Ansprechen des schizodepressiven Typs auf Carbamazepin. Dies bestätigt die Ergebnisse einer älteren Verlaufsuntersuchung mit insgesamt 62 Patienten mit schizoaffektiver Störung und Lithium-Prophylaxe [114]. Patienten, die prominente Schizophrenie-Symptome aufwiesen oder im Langzeitverlauf als überwiegend schizodepressiv beurteilt wurden, zeigten ein schlechteres Ansprechen auf Lithium. Umgekehrt war ein bipolarer Verlauf der schizoaffektiven Störung ein Prädiktor für ein besseres Ansprechen auf Lithium. Weiterhin stellten die Autoren fest, dass Lithium-Spiegel im Bereich zwischen 0,45 und 0,60 mmol/l zumeist ineffektiv waren, jedoch ein Anheben des Lithium-Spiegels auf 0,6 bis 1,0 mmol/l im zweiten Jahr der Untersuchung einen deutlichen positiven Effekt zeigte.
Zusammenfassend kann man also sagen, dass die Evidenzlage für Lithium sowohl in der Akut- als auch Langzeittherapie schizoaffektiver Störung durchaus noch ausbaufähig erscheint. Klinische Prädiktoren für ein Ansprechen können eine bipolare bzw. eine schizomanische Verlaufsform sowie nur gering ausgeprägte Schizophrenie-typische Symptome sein.
Unipolare Depression
Lithium-Monotherapie
Im Unterschied zu der Evidenzlage für Lithium-Augmentation und Langzeitbehandlung in der unipolaren Depression ist die Evidenzlage für Lithium als Monotherapie der akuten unipolaren Depression eher gering. Sie basiert in erster Linie auf kleinen Studien in den 70er- und 80er-Jahren, die jedoch an geringen Patientenzahlen (maximal 45 Patienten) sowie oft an gemischten Kollektiven aus unipolar und bipolar depressiven Patienten durchgeführt wurden [78]. In den insgesamt sieben Studien erwies sich Lithium trizyklischen Antidepressiva als gleichwertig bzw. besser als Placebo in zwei Placebo-kontrollierten Untersuchungen [4]; in einer 2013 publizierten Studie [32] hingegen war Lithium Citalopram als Akutbehandlung unterlegen. Aktuelle Leitlinien empfehlen daher Lithium nicht als Monotherapie der unipolaren Depression, sondern primär als Augmentationstherapie [20].
Augmentation bei Therapieresistenz
Neben zahlreichen offenen Studien identifizierten zwei Metaanalysen [42, 134] zehn bzw. neun kontrollierte, randomisierte Studien zur Lithium-Augmentation bei unipolarer behandlungsresistenter Depression. Beide kommen zu dem Schluss, dass Lithium-Augmentation bei Therapieresistenz gegenüber klassischen Trizyklika ebenso wie gegenüber selektiven Serotonin-Wiederaufnahmehemmern (SSRI) effektiv ist. Allerdings weisen auch beide Metaanalysen auf ihre Limitierung aufgrund der nicht sehr hohen Qualität der eingeschlossenen Studien hin. Insgesamt war die Lithium-Augmentation im Vergleich zu Placebo hoch effektiv (Number needed to treat [NNT] = 5) [42]. Die Empfehlung in diesen beiden Metaanalysen sowie eines weiteren Reviews [19] lautet, Lithium-Spiegel im Bereich zwischen 0,6 und 0,9 mmol/l anzustreben. Zeigt sich innerhalb von zwei Wochen kein Hinweis auf Besserung bei suffizienten Lithium-Plasmaspiegeln, so sollte Lithium wieder abgesetzt werden und es sollten Alternativen wie atypische Antipsychotika oder Schilddrüsenhormone evaluiert werden. Bei einer Besserung sollte jedoch die Augmentationstherapie in jedem Fall für sechs bis zwölf Monate fortgesetzt werden.
Eine große Metaanalyse von Zhou und Mitarbeitern [205], die die Effektivität von insgesamt elf Substanzen als Augmentationstherapie zu Antidepressiva verglich, zeigte keinen signifikanten Wirksamkeitsunterschied der unterschiedlichen Strategien, einschließlich der Lithium-Augmentation. Sowohl Quetiapin, Aripiprazol, Schilddrüsenhormon als auch Lithium waren signifikant wirksamer als Placebo.
Erhaltungstherapie und Prophylaxe
Das Medikament der ersten Wahl zur Erhaltungstherapie nach einer depressiven Episode ist entweder das Antidepressivum, das die Besserung herbeigeführt hat, oder – im Falle einer vorausgegangenen erfolgreichen Augmentationsbehandlung – Lithium. Sollte sich unter dieser Behandlung wieder eine Verschlechterung einstellen, so sollte in Kombination mit dem Antidepressivum und Lithium weiterbehandelt werden [20].
Hinsichtlich der Prophylaxe bestätigen mehrere Metaanalysen den Nutzen einer Lithium-Langzeittherapie. Zum einen ist Lithium vergleichbar effektiv wie Antidepressiva in der Prophylaxe unipolarer Depressionen [39], des Weiteren hat es einen deutlichen antisuizidalen Effekt [37] und führt zu einer Verringerung der Gesamtmortalität, unabhängig von der Ursache [29, 38]. In diesem Zusammenhang sei an das hohe Risiko kardiovaskulärer Erkrankungen bei affektiven Störungen erinnert [176].
Die Empfehlung lautet, eine Lithium-Prophylaxe spätestens nach zwei Episoden einer wiederkehrenden Depression innerhalb von fünf Jahren zu beginnen. Als therapeutisch wirksame Lithium-Spiegel in der Langzeittherapie werden 0,6 bis 0,8 mmol/l empfohlen [1]. Die Chance eines Ansprechens auf Lithium-Prophylaxe scheint bei bestimmten Gruppen unipolar depressiver Patienten höher als bei anderen zu sein. Patienten mit dem „endogenen“ Subtyp einer unipolaren Depression, psychotischen Merkmalen sowie Patienten, die Symptome einer bipolaren Spektrumstörung oder eine entsprechende Familienanamnese vorweisen, scheinen auf eine Lithium-Prophylaxe besser anzusprechen [1].
Tabelle 1 gibt einen Überblick über die Indikationsstellung einer Lithium-Prophylaxe bei den verschiedenen psychischen Störungen.
Tab. 1. Indikationsstellung einer Lithium-Prophylaxe (ergänzt und modifiziert nach [8])
|
Bipolare Störung |
Rezidivierende unipolare manische Episoden |
Schizoaffektive Störung |
Unipolare Depression |
|
≥ 2 Episoden in 4 Jahren oder ab der ersten manischen Episode bei entsprechender Schwere |
Ab der ersten manischen Episode bei entsprechender Schwere, sonst ab der zweiten Episode |
≥ 2 Episoden in 3 Jahren |
≥ 2 Episoden in 5 Jahren |
Unabhängig von der Episodenhäufigkeit sollte eine Lithium-Prophylaxe aber auch bei wiederkehrender Eigen- oder Fremdgefährdung in der Vorgeschichte (insbesondere suizidale Handlungen) in Erwägung gezogen werden.
Spezielle Patientengruppen
Indikatoren für eine Lithium-Response
Erfahrungswerte der letzten Jahrzehnte zeigen, dass bei bipolaren Patienten etwa zwei Drittel auf eine Lithium-Prophylaxe ansprechen, davon etwa die Hälfte völlige Symptomfreiheit erlangen, wohingegen ein Drittel kein oder nur sehr mäßiges Ansprechen zeigen [88]. Klinisch ist es daher bedeutsam, möglichst vor Beginn einer Lithium-Prophylaxe den wahrscheinlichen Erfolg besser abschätzen zu können.
Genom-weite Assoziationsstudien (GWAS) haben verschiedene Gene mit einer Lithium-Response in Verbindung bringen können [88], darunter Gene, die für spannungsabhängige Calciumkanäle kodieren [126] sowie die Mitochondrienaktivität [178], Immunaktivität [5], Stressreaktion [184] und den zirkadianen Rhythmus [66] regulieren. Von einer Art „Lithium-Response-Chip“ als genetischem Schnelltest sind wir aber noch weit entfernt. Hilfreicher kann hier die Beobachtung sein, dass als Ausdruck der Genetik auf der Persönlichkeits- und Verhaltensebene ein hyperthymes Grundtemperament Hinweis auf eine potenzielle Lithium-Response sein kann [157].
Vor allem der bisherige Krankheitsverlauf kann wertvolle Hinweise auf eine mögliche Lithium-Response liefern: Indexepisode Manie und nachfolgende manische Polarität bzw. ein Episodenmuster Manie–Depression–Euthymie, keine psychotischen Symptome, späterer Erkrankungsbeginn und kürzere Erkrankungsdauer vor Beginn der Lithium-Prophylaxe, positive Familienanamnese für bipolare Störungen [90]. Zusätzlich werden als positive Prädiktoren das Fehlen psychiatrischer Komorbidität [177], klar abgrenzbare Episoden mit vollständiger Remission [73], kein Rapid-Cycling-Verlauf [137] sowie eine Familienanamnese einer guten Lithium-Response [74] genannt. Ob dies nun alles Lithium-spezifische Charakteristika sind oder generell Indikatoren für ein besseres Ansprechen auf medikamentöse Prophylaxe, ist nicht bekannt.
Umgekehrt zeigte eine retrospektive Studie, dass eine Bipolar-II-Diagnose im Vergleich zu einer Bipolar-I-Diagnose eher ein Prädiktor für ein schlechteres Ansprechen ist. Dies steht in einem gewissen Gegensatz zu den bereits zitierten großen Studien, die dies nicht bestätigen [61, 186]. Weiterhin sollen komorbide Suchterkrankung und gehäufte Mischzustände ungünstig für ein Ansprechen auf Lithium-Prophylaxe sein [200].
Tabelle 2 fasst, ohne Anspruch auf Vollständigkeit, bekannte Prädiktoren zusammen, die für oder gegen den Beginn einer Lithium-Prophylaxe sprechen können.
Tab. 2. Prädiktoren, die für oder gegen den Erfolg einer Lithium-Behandlung sprechen können. Nicht alle Merkmale konnten in Metaanalyse [90] bestätigt werden und zum Teil gibt es auch abweichende Studienergebnisse
|
Für einen möglichen Erfolg kann sprechen: |
Gegen einen möglichen Erfolg kann sprechen: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Eine Form der Quantifizierung der unterschiedlichen Prädiktoren und damit einer Einteilung nach potenziellen Respondern/Nonrespondern anhand eines Summenwerts stellt die „Retrospective Assessment of the Lithium Response Phenotype Scale“ (sog. „Alda-Scale“) dar. Im klinischen Alltag kommt sie jedoch nur begrenzt zum Einsatz, auch erscheint die sogenannte B-Unterskala irrtumsanfällig [164].
Kinder- und Jugendliche
Eine Lithium-Therapie der akuten Manie scheint auch bei Kindern und Jugendlichen eine vergleichbare Wirksamkeit wie bei Erwachsenen zu haben, wobei in dieser Altersgruppe die Symptomatik oft diffuser anmutet, Fehldiagnosen wie Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) häufiger sind und generell Mischzustände und psychotische Symptome die Behandlung erschweren [25, 49, 68]. Ein kürzlich publizierter systematischer Review fand insgesamt 12 RCTs zu Lithium bei Kindern und Jugendlichen mit bipolarer Störung. Alle drei RCTs zur akuten Manie bestätigten die Wirksamkeit von Lithium, wobei mit dem Alter der Patienten auch die Ansprechrate stieg. Bei gleichzeitigem ADHS hingegen war die Wirksamkeit von Lithium schlechter [181]. Lithium-Therapie bei akuter bipolarer Depression wurde hingegen nur in einer offenen, sechswöchigen Studie untersucht; 48 % der Kinder und Jugendlichen zeigten ein Ansprechen, 30 % erreichten eine Remission [142]. Auch unser Wissen zur Lithium-Prophylaxe bei bipolaren Heranwachsenden basiert nur auf offenen Studien; drei stellen eine Verringerung der Rückfallrate unter Lithium fest, eine vierte Studie konnte allerdings keinen überzeugenden Lithium-Effekt feststellen [6].
Was bei der Lithium-Behandlung von Kindern und Jugendlichen nicht vergessen werden darf, ist die unterschiedliche Pharmakokinetik mit kürzerer Eliminationshalbwertzeit. Trotz geringerer Körpermasse werden in der Regel Dosierungen wie im Erwachsenenalter angewendet, es können aber eher Flüssigkeitsschwankungen vorkommen, beispielsweise durch exzessives Schwitzen. Da die Lithium-Konzentration im Hirn in Relation zum Serum bei Kindern etwas geringer ist, empfehlen einige Autoren etwas höhere Spiegelbereiche (0,6 bis 1,2 mmol/l) und schnellere Aufdosierung bei Heranwachsenden [55]. Bei Vorhandensein sicherer Alternativen zur Maniebehandlung ist aber eine solche Empfehlung eher kritisch zu sehen.
Alterspatienten
Bipolare Störungen sind im Alter mindestens so häufig wie in der Jugend; 19 % der affektiven Störungen im Alter sind bipolar. Etwa 10 % der bipolaren Patienten hatten eine erste manische Episode mit > 45 Jahren [99]. Bipolare Störungen mit Beginn im Alter (Old age bipolar disorder, OABD) machen bereits 25 % aller bipolaren Störungen aus [158] und werden bis 2030 auf 50 % steigen [94]. In der OABD-Gruppe treten Manien häufiger bei Frauen auf (Verhältnis 2 : 1), vollständige Remissionen sind seltener, dafür residuale kognitive Defizite häufiger. OABD, noch mehr als schwere unipolare Depression im Alter, stellt einen Risikofaktor einer späteren Demenzentwicklung dar [140, 191]; so erhöht die Diagnose einer OABD das Demenzrisiko etwa dreifach. Das Ausmaß der Risikozunahme korreliert zudem mit der Anzahl der Lebenszeit-Episoden [191]. In diesem Zusammenhang sei nun das mögliche Potenzial von Lithium bei neurodegenerativen Erkrankungen einschließlich Demenz erwähnt [56, 117, 138, 196]. Eine Metaanlayse erster Studien berichtet eine Reduktion des Demenzrisikos bei OABD um 49 % bei Lithium-behandelten vs. Nicht-Lithiumbehandelten Patienten [191], und es bestehen Überlegungen zu einer prophylaktischen Gabe von Mikro-Dosen Lithium auch bei nicht affektiv erkrankten, demenzgefährdeten, älteren Menschen [138] und Down-Syndrom-Patienten [153].
OABD-Patienten weisen durchschnittlich drei bis vier Komorbiditäten auf, darunter mit bis zu 50 % ein metabolisches Syndrom, arterielle Hypertonie (45–69 %), Diabetes mellitus (18–31 %), koronare Herzkrankheit (9–49 %), Lungenerkrankungen (4–15 %), Arthritis (16–21 %), endokrine Störungen (17–22 %), und atopische Störungen wie Heuschnupfen und Asthma bronchiale (6–20 %) [158].
Erstaunlicherweise ist diese Patientengruppe bis heute von Leitlinien völlig vernachlässigt worden [48]. Hinsichtlich der akuten und prophylaktischen Wirksamkeit unterscheiden sich Lithium und stimmungsstabilisierende Antiepileptika bei älteren nicht von jüngeren Patienten. Die Expertenempfehlung der International Society for Bipolar Disorders (ISBD) lautet daher, Lithium als Mittel der ersten Wahl in der Prophylaxe bei älteren bipolaren Patienten einzusetzen, vorausgesetzt Nieren- und Schilddrüsenfunktion lassen es zu. Für die Altersgruppe 60 bis 79 Jahre werden Serumspiegel von 0,4 bis 0,8 mmol/l empfohlen, ab dem 80. Lebensjahr dann 0,4 bis 0,7 mmol/l [172]. Generell gilt auch hier die Empfehlung der langsameren Titration beim älteren Menschen, und mit den niedrigeren maximalen Serumspiegeln wird der langsameren Elimination des Lithiums bei älteren Patienten Rechnung getragen. Jedoch kann die Lithium-Behandlung im Einzelfall aufgrund der veränderten Pharmakokinetik schwierig sein: Lithium-Intoxikationen traten vor der Zeit regelmäßiger Spiegelkontrollen mindestens einmal bei 11 bis 23 % der älteren Lithium-behandelten bipolaren Patienten auf [58].
Schwangerschaft und Stillzeit
Schwangerschaft per se stellt kein erhöhtes Risiko für einen Rückfall bei einer bipolaren Erkrankung dar [179], wohingegen das Absetzen von Lithium in der Schwangerschaft natürlich zu einem erhöhten Rückfallrisiko führt [194]. Die peri- und postpartale Zeit hingegen ist per se mit einem hohen Rückfallrisiko assoziiert [121], weswegen auch hier eine medikamentöse Prophylaxe dringend indiziert erscheint. Dem entgegen stehen die bekannten Risiken von Lithium in der Schwangerschaft und in der Stillzeit, weswegen im Einzelfall eine sorgfältige Abwägung zu treffen ist. Hinsichtlich des Risikos der Lithium-Behandlung in der Schwangerschaft gibt es unterschiedliche Einschätzungen, so wurde kürzlich über ein etwa doppelt so hohes Risiko von Fehlgeburten berichtet [151]. Eine jüngst publizierte Metaanalyse [57] schloss 29 Studien ein, von denen 13 eine quantitative Analyse erlaubten. Im Vergleich zu Schwangerschaften ohne Lithium-Exposition zeigten Schwangerschaften mit Lithium-Exposition eine signifikant erhöhte Rate an Missbildungen, insbesondere bei Expositionen im ersten Trimester, und insbesondere für Herzmissbildungen. Die Rate an Spontanaborten und Herzmissbildungen nach dem ersten Trimester war hier jedoch nicht höher, ebenso wenig war das Risiko für Frühgeburten oder zu geringes Geburtsgewicht erhöht. Im Gegenteil, Lithium scheint das fötale Wachstum zu beschleunigen und das Geburtsgewicht eher zu erhöhen [149]. Bezüglich kardialer Fehlbildung bleibt zudem festzustellen, dass eine signifikant höhere Rate zwar im Vergleich zur Gesamtbevölkerung bestand, jedoch nicht im Vergleich zu anderen Schwangerschaften von Patientinnen mit affektiven Störungen ohne Lithium-Einnahme, die Erkrankung also offenbar per se einen Beitrag leistet. Zudem ist das absolute Risiko als eher gering einzustufen, insbesondere bei Betrachtung prospektiver Studien [202]. Eine Ultraschall-Untersuchung des Fötus im ersten Trimester zur Abklärung einer möglichen Fehlbildung ist unter Lithium-Therapie aber in jedem Fall anzuraten [150, 195]. Weiterhin konnte die Metaanalyse zeigen, dass eine Fortführung der Lithium-Behandlung bezüglich des Auftretens von postpartalen affektiven Psychosen einen deutlichen Vorteil (NNT = 3) gegenüber dem Aussetzen einer Lithium-Behandlung zeigte. Basierend auf dieser Metaanalyse wird eine Fortführung der Lithium-Behandlung mit einem optimalen Lithium-Spiegel von 0,64 mmol/l beziehungsweise einer Tagesdosis von 600 mg pro Tag empfohlen. Durch den eher niedrig gewählten Spiegel lässt sich offensichtlich das Risiko kardialer Malformationen minimieren und das sogenannte Floppy-Infant-Syndrom (apathische Babys mit geringem Muskeltonus, Hypothermie, insuffizienter Atmung, Zyanose, Arrhythmie und vermindertem Saugreflex) vermeiden [65].
In den ersten beiden Trimestern können die höhere glomeruläre Filtrationsrate sowie die Blut- und Flüssigkeitsvolumenzunahme einen Abfall des Lithium-Spiegels bewirken; ein durchschnittlicher Abfall des Lithium-Spiegels von 24 % im ersten Trimester, 36 % im zweiten Trimester und 21 % im dritten Trimester wurden beschrieben [150]. Eine temporäre Anpassung der Dosis kann dann erforderlich werden [198, 199]. Eine engmaschige (zwei- bis vierwöchentliche) Kontrolle des Lithium-Spiegels ist in dieser Phase zu empfehlen [150], falls die Patientin eine Präeklampsie, Erbrechen oder Fieber entwickelt, entsprechend engmaschiger. Im dritten Trimester nähern sich die Lithium-Plasmaspiegel wieder den Ausgangswerten an, hier besteht dann eher die Gefahr der Überdosierung nach temporärer Dosiserhöhung. Sollte die Patientin bisher Lithium als tägliche Einmaldosis genommen haben, so wird eine Umstellung auf eine Zweimal-Gabe empfohlen, um Serumspitzen, vor allem beim Fötus, zu vermeiden [150]. Ab Schwangerschaftswoche 34 werden dann wöchentliche Spiegelkontrollen empfohlen [198].
Aufgrund der starken Schwankungen des Volumens der Körperflüssigkeit um und nach der Geburt wurde früher empfohlen, die Lithium-Behandlung temporär auszusetzen. Da dies aber das Risiko postpartaler Psychosen deutlich erhöht, wird heute eher eine Fortführung der Therapie mit engmaschigen Spiegelkontrollen vor und nach der Geburt empfohlen [198]. Wird für einen Kaiserschnitt oder andere Komplikationen eine Vollnarkose notwendig, so ist die Potenzierung der Wirkung von Succinylcholin und Pancuronium durch Lithium zu beachten; die Wirkung lokaler oder spinaler Anästhesie hingegen wird durch Lithium nicht beeinflusst [26].
Postpartum werden zur Prophylaxe höhere therapeutische Spiegel (bis zu 1 mmol/l) empfohlen, unter zweimal wöchentlicher Spiegelkontrolle in den ersten zwei Wochen [150].
Hinsichtlich des Stillens unter Lithium-Therapie gibt es wenig zuverlässige Daten, insgesamt sind nur 36 Fälle in der Literatur beschrieben [60]. Aus diesem Grunde raten Guidelines und Experten primär vom Stillen ab [86, 150]. Dennoch ist die Lithium-Einnahme keine absolute Kontraindikation für das Stillen und kann in manchen Fällen auch nützlich sein [141]. Lithium-Spiegel bei Säuglingen stillender Mütter betragen etwa 25 bis 50 % des mütterlichen Lithium-Spiegels. Bei den Babys wurde eine leichte Erhöhung des TSH, Harnstoffs und Creatinins beschrieben, was sich jedoch bei Beendigung des Stillens normalisierte [193]. Größer als die Risiken für das Kind ist wohl das Risiko einer postpartalen Psychose für die stillende Mutter durch den gestörten Nachtschlaf einzuschätzen. Zu empfehlen ist daher, regelmäßig Milch abzupumpen, einen Vorrat anzulegen und die Fütterung zur Nachtzeit dem Partner zu überlassen.
Die Frage, ob Lithium-Exposition im Mutterleib ähnlich wie Valproinsäure zu späteren Reifungsstörungen und Intelligenzdefiziten führt, lässt sich mangels aussagekräftiger prospektiver Untersuchungen nicht klar beantworten. Die bisher vorhandene Evidenz lässt aber eher vermuten, dass dies nicht der Fall ist [150].
Suizidalität
In der Medizin im Allgemeinen ist die Senkung des Mortalitätsrisikos das wichtigste Therapieziel; in der Psychiatrie im Speziellen geht es insbesondere um die Verhinderung des Suizids. Laut WHO 2018 starben in den letzten Jahrzehnten jährlich etwa 800 000 bis 1 000 000 Menschen durch Suizid, Tendenz steigend: 2020 erwartet die WHO 1,5 Millionen Suizide [201]. Von allen psychiatrischen Erkrankungen gehen bipolare Störungen mit dem höchsten Suizidrisiko einher [17]. Die absolute Größe kann jedoch variieren und wird durch Faktoren wie bipolarer Subtyp, Geschlecht, Altersgruppe und Krankheitsschwere beeinflusst. Es wird geschätzt, dass im Mittel ungefähr 0,9 % aller bipolaren Patienten in einem Jahr einen Suizidversuch durchführen, was etwa 30- bis 60-fach häufiger als in der Allgemeinbevölkerung ist [188]. Die Suizidrate ist etwa 20- bis 30-fach höher als die Rate in der Allgemeinbevölkerung [147]. Anders ausgedrückt, begehen ein Drittel bis die Hälfte der bipolaren Patienten mindestens einen Suizidversuch während ihres Lebens, ungefähr 10 bis 20 % versterben am Suizid [43, 85, 125]. Als Risikofaktoren identifizierte die Suizidforschung männliches Geschlecht, alleinlebend, geschieden, keine Kinder, kaukasische Rasse, jüngeres (< 35 Jahre) oder älteres Alter (> 75 Jahre), Arbeitslosigkeit, Eigen- oder Familienanamnese von vorausgegangenen Suizidversuchen oder Suiziden sowie im Krankheitsverlauf eine vorwiegend depressive Polarität. Auch ein Bipolar-II-Verlauf sowie gehäufte Mischzustände stellen Risikofaktoren für Suizidversuche dar [41].
Eine Metaanalyse ökologischer Studien legt nahe, dass selbst die Lithium-Zufuhr über das Trinkwasser konzentrationsabhängig einen protektiven Effekt hinsichtlich Suiziden in der Allgemeinbevölkerung haben kann [124]. Interessanterweise wird auch fremdaggressives Verhalten reduziert [105]. Die antisuizidale Wirksamkeit von Lithium ist aber auch in epidemiologischen Untersuchungen und kontrollierten Studien [75] deutlich belegt. Sehr gut ist die Datenlage für affektive Störungen [12, 17, 37, 52, 53, 128, 173] einzustufen, aber auch bei anderen Krankheitsbildern lässt sich, wenn auch bei der deutlich schwächeren Datenlage nicht so eindeutig, ein antisuizidaler Effekt im weitesten Sinne feststellen. Im weitesten Sinne deshalb, weil vollendeter Suizid als Zielparameter einer kontrollierten Studie nicht nur ethisch fragwürdig ist, sondern zum Glück doch noch ein eher seltenes Ereignis, zumindest im Zusammenhang mit kontrollierten Studien. So dienen auch Surrogatparameter wie Verringerung von Suizidgedanken, selbstbeschädigendem Verhalten und schließlich Suizidversuchen als Nachweis antisuizidaler Wirksamkeit.
Der antisuizidale Effekt von Lithium ist durchaus eindrucksvoll und klinisch relevant. So berichten kontrollierte Studien von einer fünf- bis sechsfachen Verringerung der Anzahl suizidaler Akte [17]. Diese Effekte zeigen sich bei der Behandlung mit anderen stimmungsstabilisierenden Medikamenten nicht bzw. nicht in vergleichbarem Ausmaß [9, 13, 17]. Die für Clozapin beschriebenen antisuizidalen Effekte bei der Schizophrenie [123] sind bei affektiv erkrankten Patienten bisher noch nicht näher untersucht worden. Der antisuizidale Effekt von Lithium stellt sich dabei wahrscheinlich erst nach einer gewissen Behandlungsdauer ein, ist also kein Akuteffekt [46].
Allerdings gibt es auch nicht nur Vorteile einer Suizidprophylaxe mit Lithium: Abruptes Absetzen einer Lithium-Prophylaxe kann zu einer ausgeprägten „Rebound“-Suizidalität mit bis zu 13-fach erhöhter Mortalität führen [15], weswegen die Therapiezuverlässigkeit ganz entscheidend ist [69].
Während bei affektiven Störungen die Verhinderung von Rückfällen und Stimmungsstabilisierung sicher wichtig, wenn auch nicht ausschließlich verantwortlich für die suizidprophylaktische Wirksamkeit von Lithium ist, spielen bei anderen Störungsbildern wohl auch andere, mit dem serotonergen System in Zusammenhang stehende Mechanismen eine Rolle, wie eine generelle Verminderung von Aggression und Impulsivität [37, 38].
Unerwünschte Wirkungen und Gegenanzeigen
Kontraindikationen
Kontraindikationen für eine Lithium-Therapie sind akutes Nierenversagen sowie schwere Niereninsuffizienz, ausgeprägte Hyponatriämie und akuter Herzinfarkt. Relative Kontraindikationen sind eine leichte bis mäßige Niereninsuffizienz, eine Psoriasis, Morbus Addison sowie bestehende Schwangerschaft. Ein vorbestehender Hypothyreoidismus ist keine primäre Kontraindikation, sollte aber durch Levothyroxin-Therapie ausgeglichen werden.
Nebenwirkungen
Subjektiv belastende, aber nicht schwerwiegende Nebenwirkungen einer Lithium-Therapie sind nicht selten [31]. Häufige dosisabhängige, und auch bei Lithium-Spiegeln im therapeutischen Bereich auftretende Nebenwirkungen sind Tremor, Polyurie bei gesteigerter Trinkmenge (Polydipsie), Diarrhö, Gewichtszunahme, und, häufiger bei Frauen, Hypothyreoidismus und Ausbildung eines Kropfes. Der Tremor ist typischerweise hochfrequent und feinschlägig, normalerweise nur von leichter Ausprägung, kann jedoch in Einzelfällen Verrichtungen des täglichen Lebens erheblich beeinträchtigen. Eine Gewichtszunahme tritt typischerweise zu Beginn der Lithium-Therapie auf und ist zumindest teilweise auch auf anfängliche Flüssigkeitsretention zurückzuführen. Eine Metaanalyse ergab, dass die Lithium-Patienten ein etwa 1,9-fach erhöhtes Risiko einer klinisch bedeutsamen (> 7 % des Ausgangsgewichts) Gewichtszunahme im Vergleich zur Placebo-Behandlung aufweisen [118]. Im Regelfall hat die Gewichtszunahme aber nicht das Ausmaß, wie es beispielsweise bei einigen atypischen Antipsychotika oder bei Valproinsäure beobachtet wird.
Bis auf Hypothyreoidismus und Kropfbildung sind die genannten Nebenwirkungen zumeist nur passager und unter Reduktion der Lithium-Dosis, sofern therapeutisch verantwortbar, reversibel. Lithium-induzierter Tremor spricht zudem in Einzelfällen gut auf die zusätzliche Gabe von Betablockern an, Polydipsie und Gewichtszunahme bedürfen der Verhaltensmodifikation: Vermeiden kalorienhaltiger Flüssigkeiten zum Stillen des Durstes infolge Polyurie, kalorienreduzierte Kost, sportliche Betätigung.
Auswirkungen auf Organfunktionen
Eine funktionelle Einschränkung oder Organschädigung unter langfristiger Lithium-Therapie kann die Schilddrüse, die Nebenschilddrüsen, seltener das Herz, aber insbesondere die Nieren betreffen.
Schilddrüse. Die thyreostatische Wirkung von Lithium ist gut bekannt. Lithium blockiert die Iodid-Aufnahme in die Schilddrüse, die Kopplung von Mono- und Diiodtyrosin zu Triiodthyronin (T3) und Thyroxin (T4) und die Freisetzung (Proteolyse) von T3 und T4 aus Thyreoglobulin. Die Schilddrüsensuppression stellt im klinischen Alltag in aller Regel keinen Grund für die Beendigung einer Lithium-Therapie dar. Eine Lithium-induzierte Hypothyreose tritt in etwa 20 bis 30 % der Lithium-behandelten Patienten, häufiger bei Frauen, auf und ist nach Absetzen von Lithium in fast allen Fällen reversibel [112]. Durch die frühzeitige Gabe von Levothyroxin kann die Ausbildung eines Kropfes verhindert werden.
Eine Lithium-induzierte Hyperthyreose und Thyreotoxikose ist hingegen eine sehr seltene Nebenwirkung (etwa 1 %, [118]), eine Behandlung mit Carbimazol mit oder ohne zusätzliche Steroidgabe kann erforderlich werden.
Tierexperimentell gibt es Hinweise, dass gleichzeitige Zink-Gabe Schilddrüsenfehlfunktion unter Lithium verhindern kann [144].
Nebenschilddrüse. Die Prävalenz einer Hyperparathyreose mit konsekutiver Hyperkalzämie betrug bei Patienten nach über 15 Jahren Lithium-Therapie 2,7 % und war damit etwa 7,5-mal höher als in der Gesamtbevölkerung [21]. Aufgrund seiner strukturellen Ähnlichkeit mit Calcium bindet Lithium an Calcium-Sensing-Rezeptoren (CaSR) nicht nur an den Nierenglomeruli, sondern auch den Nebenschilddrüsen. Der dadurch bedingte Hyperparathyreoidismus führt in bis zu 50 % der Fälle zu einer generellen Hyperplasie, und in bis zu 80 % der Fälle zur Bildung einzelner Adenome [91], die zumeist chirurgisch angegangen werden müssen.
Niere. Der mit Abstand häufigste Grund, eine Lithium-Therapie nicht zu beginnen bzw. eine bestehende Therapie infrage zu stellen, ist die Auswirkung von Lithium auf die Nierenfunktion. Renale Nebenwirkungen einer Lithium-Therapie kommen häufig vor [31]. Kausale Verbindungen zwischen den anfänglichen Symptomen wie Polyurie, Polydipsie und einem nephrogenen Diabetes insipidus scheinen klar zu sein [76, 162]. Unklar bleibt der Zusammenhang von Lithium und der Entwicklung einer chronischen Nephropathie (Chronic kidney disease, CKD) mit strukturellen Veränderungen, die schließlich in einigen Fällen zu einem Nierenversagen führen kann. Hier wird das Risiko eines Nierenversagens auf etwa 0,5 % (zum Vergleich: 0,2 % in der Normalbevölkerung) bei Patienten mit Lithium-Therapie eingeschätzt [118]. Auch in einer großen dänischen Bevölkerungs-Registerstudie zeigte sich eine signifikant erhöhte Inzidenz einer möglichen und manifesten CKD unter Lithium, aber nicht einer CKD im Endstadium (Langzeitdialyse oder erforderliche Nierentransplantation) [101]. Sollte sich jedoch eine CKD im Endstadion entwickeln, so scheint es unterhalb eines Schwellenwerts der geschätzten glomerulären Filtrationsrate (eGFR) von 45 ml/min/1,73 m2 keinen Unterschied für das Fortschreiten mehr zu machen, ob Lithium in verminderter Dosis fortgeführt oder gestoppt wird [28].
Häufiger kann eine milde bis moderate CKD unter Lithium auftreten, deren Konsequenzen im Einzelfall beurteilt werden müssen. Es wird geschätzt, dass mit jedem Jahr Lithium-Behandlung die eGFR im Mittel um 0,64 ml/min abnimmt [27], wobei aber unklar ist, ob dies eher ein initialer Effekt ist oder er sich auch über Jahrzehnte weiter fortsetzt. Geschätzt wird weiter, dass etwa die Hälfte der Lithium-Patienten im Verlauf von 20 Jahren Lithium-Einnahme eine moderate Nierenfunktionseinschränkung mit einer eGFR < 60 ml/min/1,73 m² entwickeln [28, 101]. Lebensalter, weibliches Geschlecht und Dauer der Lithium-Einnahme scheinen dabei mit diesem Risiko zu korrelieren. Umstritten ist, ob auch die Lithium-Spiegel über die Jahre mit dem Ausmaß einer CKD korrelieren. Während einige Studien einen Zusammenhang zwischen Lithium-Spiegeln [170] und einer CKD sehen, so fanden andere diese Korrelation nicht [155]. Tierversuche deuten allerdings darauf hin, dass auch innerhalb therapeutischer Blutspiegel eine lineare Korrelation zwischen der Höhe des Lithium-Spiegels und einer späteren Nierenschädigung besteht [139]. Überwiegender Konsens der Studien und Reviews der letzten Jahre ist jedoch, dass insgesamt der therapeutische Nutzen einer Lithium-Therapie gegenüber dem Risiko eine CKD im Endstadium deutlich überwiegt. Werneke und Mitarbeiter [197] stellten ein Modell vor, welches bei der Entscheidung helfen soll. Die Autoren stellen das Suizid- und Rückfallrisiko bei bipolaren Patienten unter Lithium-Therapie dem Risiko eines Nierenversagens gegenüber. So schließen die Autoren aus ihrer auf einer Literaturrecherche basierenden Modellrechnung, dass das Absetzen von Lithium bei Auftreten eines CKD nur dann eine Option ist, wenn die Wahrscheinlichkeit, ein Nierenversagen zu entwickeln, größer als 41,3 % ist.
Aktuelle Leitlinien halten sich jedoch mit konkreten Empfehlungen, wie bei eingeschränkter Nierenfunktion mit der Lithium-Therapie zu verfahren sei, eher bedeckt. Die US Food and Drug Administration (FDA) empfiehlt eine Dosisanpassung bei eingeschränkter Nierenfunktion, ohne dabei aber klare Schwellenwerte und Dosierungen zu nennen. Bei leichter bis moderater Nierenfunktionseinschränkung (Creatinin-Clearance [CrCl] 30 bis 89 ml/min) „begin with lower doses and titrate slowly; closely monitor serum concentrations and signs/symptoms of lithium toxicity”. Bei Patienten mit starker Funktionseinschränkung (CrCl < 30 ml/min) „lithium therapy is not recommended” [189].
Für eine ausführlichere Anleitung, wie bei eingeschränkter Nierenfunktion eine Lithium-Therapie möglich ist, sei daher auf einschlägige Übersichtsarbeiten (z. B. [161, 165]) und Monographien [24] verwiesen.
Herz. Lithium ist im Regelfall kardial gut verträglich (Ausschlussindikation akuter Myokardinfarkt), kann aber in Einzelfällen aufgrund seines Wirkungsmechanismus mit einer Blockade der spannungsabhängigen Natrium- und Calciumkanäle zu einer kritischen Verlängerung des QTc-Intervalls führen. Aufgrund dieser Reizleitungsstörung sind auch Einzelfälle von Arrhythmien, beispielsweise das Brugada-Syndrom, beschrieben [120]. Erhöhter systolischer Blutdruck erhöht dabei das Risiko von Herzrhythmusstörungen auch bei therapeutischen Spiegeln von Lithium [35].
Lithium-Intoxikation
Eine Lithium-Intoxikation kann akut auftreten, beispielsweise bei Überdosierung in suizidaler Absicht, oder sich chronisch-schleichend entwickeln. Zeichen einer Lithium-Intoxikation, die zu einem sofortigen Pausieren der Lithium-Einnahme und gegebenenfalls zu weiteren Maßnahmen, zum Beispiel Magenspülung, Hämodialyse und gleichzeitiger Ausgleich der Dehydrierung und Hyponatriämie, führen müssen sind: Apathie und psychomotorische Verlangsamung bis zur Somnolenz, verschiedenste Kleinhirnzeichen (verwaschene Sprache, Ataxie, Nystagmus, Dysdiadochokinese, verstärkter Tremor) und gastrointestinale und vegetative Symptome, wie Übelkeit, Erbrechen, Inappetenz und Durchfall (Abb. 2). Diese Symptome sind meist erst ab einem Lithium-Spiegel von > 1,5 mmol/l zu beobachten und entstehen bei Überdosierung oder Natrium-Mangelzuständen, beispielsweise durch vermehrtes Schwitzen, Infektionserkrankungen (insbesondere mit Erbrechen oder Diarrhö) oder Gabe von Schleifendiuretika oder Thiaziden, sowie Nierenfunktionsstörungen. Bei weiter ansteigenden Lithium-Konzentrationen können zusätzlich Krampfanfälle, Herzrhythmusstörungen wie bereits beschrieben, sowie zunehmende Bewusstseinseintrübungen bis hin zum Koma und schließlich Tod eintreten. Eine intensivmedizinische Überwachung ist daher bei entsprechender klinischer Symptomatik, sowie in jedem Fall bei Lithium-Spiegeln über 2 mmol/l erforderlich, Hämodialyse sollte ab Spiegeln > 2,5 mmol/l bei entsprechenden Intoxikationssymptomen erwogen und bei Spiegeln > 4 mmol/l in jedem Fall durchgeführt werden [83].
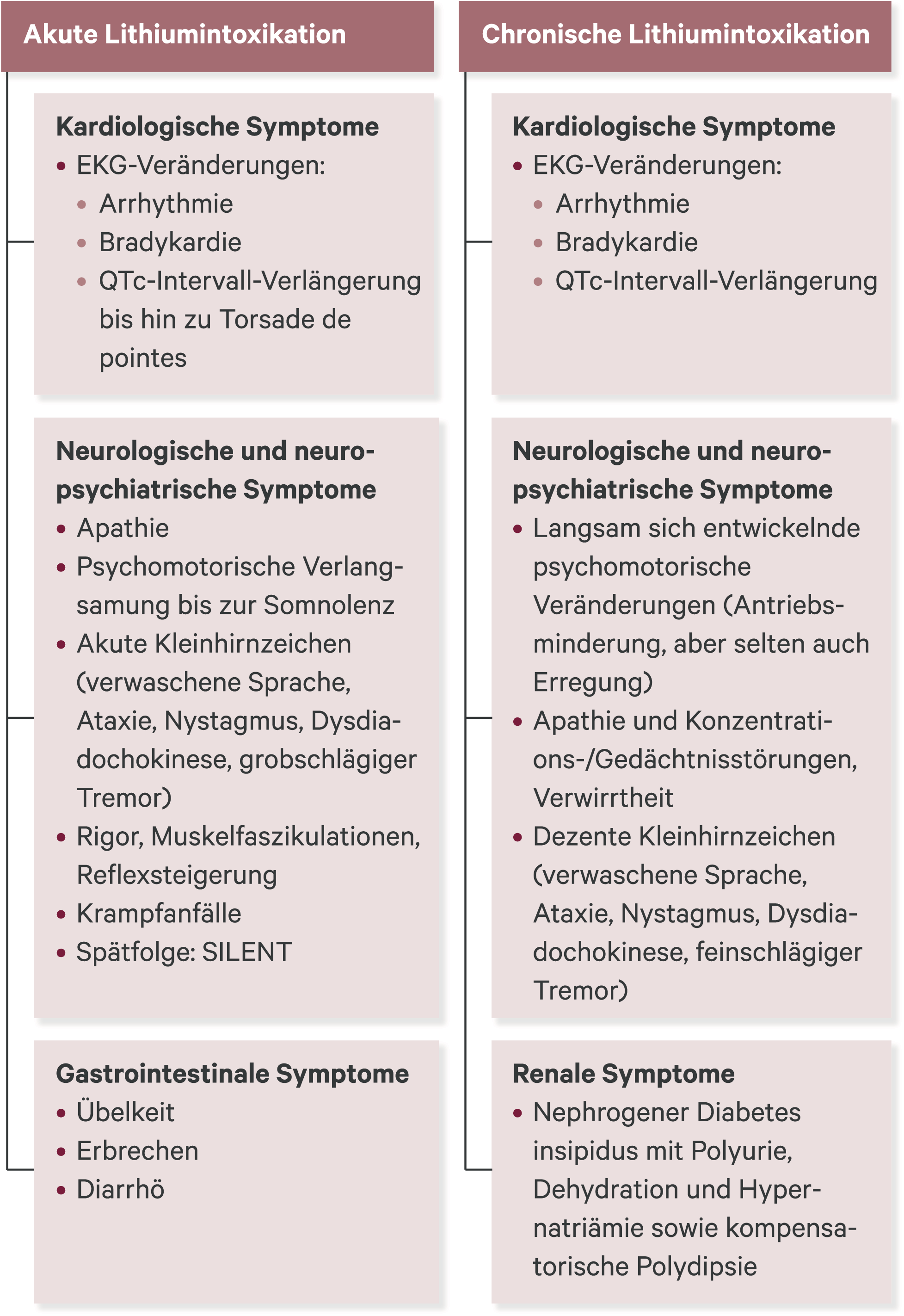
Abb. 2. Symptomatik der akuten und chronischen Lithiumintoxikation; SILENT: Syndrome of lithium-effectuated neurotoxicity
Als Spätfolge einer Lithium-Intoxikation wird das „Syndrome of irreversible lithium-effectuated neurotoxicity (SILENT)“ in zahlreichen Kasuistiken beschrieben, wobei eine persistierende zerebelläre Dysfunktion Leitsymptom ist. Zusätzlich wird öfters die Entwicklung extrapyramidal-motorischer Symptome sowie einer Demenz beschrieben [3].
Erwähnt werden sollte aber auch, dass vereinzelte Fälle schwerer Lithium-Toxizität auch unter therapeutischen Spiegeln beschrieben wurden, meist in Kombinationstherapien mit Antipsychotika [122, 135].
Kontrolluntersuchungen
Der Nutzen von Lithium im klinischen Alltag kann durch verschiedene Faktoren limitiert sein, wie Nebenwirkungen, relativer Aufwand der Spiegelkontrollen sowie mögliche Organschäden (Schilddrüse, Niere). Entsprechend ist eine gute körperliche Untersuchung sowie Überprüfung der Laborparameter vor und während der Lithium-Therapie unumgänglich.
Grundsätzlich gilt, dass vor Beginn jeglicher Psychopharmakotherapie eine umfangreiche Labordiagnostik und körperliche Untersuchung zu erfolgen hat, wie in der S3-Leitlinie der DGPPN und DGBS angegeben [47]. Psychiatrische Patienten nehmen in der Regel weniger Kontakte mit dem Hausarzt sowie Gesundheitsvorsorge wahr, sind aber mit einem wesentlich höheren Risiko für endokrinologische, Herz-Kreislauf- sowie Tumorerkrankungen behaftet [203]. So bieten die vorbereitenden Untersuchungen vor einer Pharmakotherapie gleichzeitig die Chance eines umfassenden Gesundheits-Checks.
Speziell zur Lithium-Therapie werden folgende Empfehlungen gegeben [31, 47]: Vor Beginn einer Lithium-Therapie wird der Ausgangswert der Nierenfunktion ermittelt. Zur genauen Messung der Creatinin-Clearance ist eine 24-Stunden-Urinsammlung erforderlich, was im klinischen Alltag selten korrekt gelingt. Daher wird die Creatinin-Clearance zumeist mithilfe von Formeln wie der MDRD(Modification of diet in renal disease)-Formel oder der Methode von Cockcroft und Gault aus dem Serumcreatinin abgeschätzt, wobei mit wichtigen Einflussgrößen wie Alter, Geschlecht und Körpergewicht korrigiert wird:
Creatinin-Clearance [ml/min]= {(140 – Alter) × Körpergewicht [kg]}/{Creatinin im Serum [mg/dl] × 0,72}
Bei Frauen ist das Ergebnis anschließend noch mit 0,85 zu multiplizieren.
Die S3-Leitlinien sehen weiter für die Ausgangsdiagnostik umfangreiche laborchemischen Untersuchungen und eine Sonographie der Schilddrüse vor. Letztere identifiziert zahlreiche Fälle einer vergrößerten Schilddrüse unter Lithium-Therapie [44], kann sich aber in der niedergelassenen Praxis zeitnah als nur schwer umsetzbar erweisen, weswegen ein stufenweises Vorgehen sinnvoller erscheint. Für die Erfassung der Schilddrüsenfunktion ist es im klinischen Alltag meist ausreichend, das Thyreoidea-stimulierende Hormon (TSH) im Serum zu bestimmen und bei der körperlichen Untersuchung Halsumfang und eventuelles Vorhandensein einer Kropf- oder Knotenbildung zu erfassen. Bei veränderten TSH-Werten bzw. körperlichem Untersuchungsbefund sollten aber weitere laborchemische (fT3, fT4, Thyrotropin Releasing Hormone [TRH], gegebenenfalls TRH-Stimulationstest) und technische (Schilddrüsensonographie) Untersuchungen erfolgen. Da Lithium über eine Stimulierung der B-Lymphozyten Autoimmunerkrankungen der Schilddrüse fördern kann, sollten bei entsprechendem klinischem Verdacht (oder Familienanamnese) auch die Titer von Schilddrüsenantikörpern bestimmt werden.
Serumelektrolyte, insbesondere Calcium im Serum sollten vor Therapiebeginn und in regelmäßigen Abstanden kontrolliert werden, um einen Hyperparathyreoidismus rechtzeitig zu erkennen. Allerdings scheint es auch Fälle eines Hyperparathyreoidismus unter Lithium zu geben, ohne dass der Calcium-Serumspiegel erhöht ist; Häufigkeit und klinische Relevanz sind aber noch unklar [23].
Bei stabil eingestellter Lithium-Dosis sind Kontrollen des Lithium-Spiegels im vierteljährlichen Abstand in der Regel ausreichend, sofern nicht besondere Umstände (interkurrente Erkrankungen, starker Flüssigkeitsverlust beispielsweise durch Diarrhö oder Erbrechen) hinzukommen.
Mindestens einmal jährlich sollte eine gründliche körperliche Untersuchung mit Messung des Halsumfangs und Gewichts erfolgen, selbstverständlich ist dabei besonders auf Zeichen eingeschränkter Nierenfunktion (Ödeme) bzw. Schilddrüsenfehlfunktion (Kropfbildung, Exophthalmus) zu achten. Eine EKG-Kontrolle ist bei den zwar seltenen, aber möglichen Reizleitungsstörungen durch Lithium ebenfalls indiziert [203], vor allem bei Polypharmazie.
Zur Häufigkeit der weiteren laborchemischen Kontrollen bei stabil eingestellten Lithium-Patienten gibt es unterschiedliche Empfehlungen. Die deutsche S3-Leitlinie empfiehlt, Schilddrüsen- und Nierenwerte im halbjährlichen Abstand zu kontrollieren. In angelsächsischen Guidelines werden nach erfolgreicher Einstellung zum Teil auch jährliche Kontrollen, auch des Lithium-Spiegels, als ausreichend empfunden [115, 132], was bei dem relativ engen therapeutischen Fenster von Lithium, der einfachen Verfügbarkeit von Labors und den geringen Kosten einer Lithium-Bestimmung eigentlich im Sinne der Patientensicherheit nicht nachvollziehbar ist.
Dosierung
Die übliche tägliche Anfangsdosis von Lithium beträgt bei Erwachsenen 450 bis 600 mg als Retardtablette, selten 900 mg, wobei der höhere Dosisbereich eher bei der akuten Manie zur Anwendung kommt (meist in Kombination mit einem weiteren antimanischen Arzneimittel oder Sedativum). Nach drei bis sieben Tagen erfolgt dann zumeist eine erste Serumspiegelkontrolle 12 Stunden nach der letzten Einnahme, und in Abhängigkeit vom Ergebnis und klinischen Eindruck (Wirkung, Nebenwirkungen) wird die Dosis angepasst (üblicher therapeutischer Bereich 0,6 bis 1,0 mmol/l).
Während im Erwachsenenalter die tägliche Einmalgabe ausreichend ist, um einen relativ gleichbleibenden therapeutischen Plasmaspiegel zu erzielen, wird bei Kindern und Jugendlichen aufgrund der kürzeren Halbwertszeit und höheren Clearance die zweimal tägliche Gabe empfohlen [109].
Analog zur Loading-Therapie mit Valproinsäure gibt es auch frühe Studien zu einem Lithium-Loading unter engmaschigen Spiegelkontrollen bei akuter Manie [97]. Bei Vorhandensein gleich wirksamer, aber sicherer Alternativen ist dies aber sicher nur in Ausnahmefällen eine Option.
Die Frage, welcher Serumspiegelbereich optimal für die Prophylaxe bipolarer Störungen ist, lässt sich rein evidenzbasiert nur sehr eingeschränkt beantworten. Ein systematisches Review einschließlich eines Delphi-Survey internationaler Experten ergab als Konsensus-Empfehlung für Erwachsene einen Serumspiegel von 0,6 bis 0,8 mmol/l, mit der Option einer Reduktion auf 0,4 bis 0,6 mmol/l bei guter Wirksamkeit, aber schlechter Verträglichkeit, bzw. eines Anhebens auf 0,8 bis 1,0 mmol/l bei guter Verträglichkeit, aber unzureichender Wirksamkeit [136]. Erwähnt werden muss auch, dass insbesondere manische Episoden selbst Auswirkungen auf die Lithium-Konzentration haben könnten. So muss die Lithium-Dosis bei einem Patienten mit einer akuten Manie bei Besserung der Symptomatik nicht selten reduziert werden, um ein Ansteigen der Lithium-Konzentration zu verhindern [106]. Dies bedeutet auch, dass eher niedrige Lithium-Spiegel bei Patienten mit einer Lithium-Prophylaxe, die sich mit einer akuten Manie vorstellen, nicht zwangsläufig ein Zeichen von mangelnder Adhärenz sein müssen.
Ebenso besteht eine gewisse Unsicherheit, wie mit der Lithium-Einnahme bei nachlassender Nierenfunktion zu verfahren ist. Hier ist es im Einzelfall sicherlich auch sinnvoll, einen Nephrologen zu konsultieren. Zur Reduktion der nierentoxischen Wirkung von Lithium werden vor der letzten Option, dem vollständigen Ausschleichen der Substanz, verschiedene Therapiemodifikationen beschrieben. Eine Möglichkeit ist die generelle Reduktion der Dosis und damit der Lithium-Spiegel mit der Gefahr eines Wirkverlusts. Die andere beschriebene Option ist die Einmalgabe zur Nacht mit Dosisreduktion bei gleichbleibenden Serumspiegeln. Mehrere Vergleichsstudien zeigten eine positive Korrelation zwischen dem Wechsel auf eine Einmaldosis und besserer glomerulärer Funktion [87]. Unter diesem Regime wurde kasuistisch auch eine strukturelle Erholung des Nierenparenchyms beobachtet [104]. Andererseits warnen Experten bei der nächtlichen Einmalgabe vor einer höheren Gefahr von Sub-Intoxikationen und somit einem höheren Risiko der Nierenschädigung [24]. Das Verhältnis des Lithium-Spiegels zwischen Hirngewebe und Blutserum beträgt, wie eingangs erwähnt, etwa 0,76, und so sollte die Einmalgabe ausreichen, um wirksame Spiegel im zentralen Nervensystem aufrecht zu erhalten. In Anbetracht dieser Tatsache und in Anbetracht einer um 10 bis 30 % reduzierten nächtlichen Lithium-Clearance über die Nieren gibt es die Empfehlung, bei einer nächtlichen Einmalgabe die Dosis um 25 % zu reduzieren [133].
Beendigung der Lithium-Therapie
Bei sehr guten Lithium-Respondern und keinen oder nur geringen Nebenwirkungen sollte Lithium insbesondere bei bipolaren Patienten in der Regel eine lebenslange Therapie darstellen. Was ist jedoch zu beachten, wenn Wirkverlust oder Nebenwirkungen einen Therapiewechsel erforderlich machen?
Das Absetzen von Lithium nach längerfristiger Therapie kann problematisch sein und sollte unter regelmäßigen ärztlichen Kontrollen über einen längeren Zeitraum erfolgen. Sofern keine notfallmäßige Indikation besteht, sollte Lithium über mindestens ein Jahr ausgeschlichen werden [14]. Lithium erzeugt keine körperliche Abhängigkeit, aber als psychische Absetzphänomene werden vermehrte Angst, Schlafstörungen und Nervosität beschrieben und können eine symptomatische Behandlung erforderlich machen. Darüber hinaus kann ein abruptes Abbrechen der Lithium-Behandlung oder eine starke Dosisreduktion ein erhebliches Rückfallrisiko, insbesondere manische Episoden, nach sich ziehen [70, 145]. So erleiden etwa 50 % der Patienten nach abruptem Absetzen von Lithium einen Rückfall innerhalb von drei Monaten. Erst wenn Lithium länger als zwei Jahre zuverlässig genommen wird, überwiegt nach der Modellrechnung von Goodwin der Nutzen den potentiellen Schaden durch ein Absetzen [70]. Dies unterstreicht die Wichtigkeit einer guten Psychoedukation und eines vertrauensvollen Verhältnisses zwischen Therapeuten und Lithium-Patient.
Auch wenn sich keine zufriedenstellende Affektstabilisierung mit Lithium erreichen lässt, kann manchmal die Fortführung, auch mit geringeren Serumspiegeln, zusätzlich zu einer anderen Therapie sinnvoll sein. Synergistische Effekte in der Phasenprophylaxe sind beispielsweise für Lithium und Lamotrigin beschrieben [190]; auch ist unklar, ob für die antisuizidale Wirkung von Lithium unter Umständen auch subtherapeutische Spiegel schon ausreichend sind [18]. Schließlich scheint es eine Subgruppe von Patienten zu geben, bei denen der therapeutische Erfolg der Lithium-Therapie erst über einen längeren Zeitraum und bei Veränderung der Krankheitsdynamik (z. B. zunehmendes Alter, kein Rapid-Cycling-Muster mehr) evident wird.
Interessenkonflikterklärung
AG: Keine Interessenkonflikte
ES: Mitglied in IGSLI und Co-Chair der „ISBD/IGSLI Task Force on treatment with lithium“
WEM: Keine Interessenkonflikte
HG: Forschungsunterstützung oder Honorare für Beratung oder Vorträge von folgenden Firmen oder Institutionen: Janssen-Cilag, Sage, und Sanofi-Aventis.
Literatur
1. Abou-Saleh MT, Muller-Oerlinghausen B, Coppen AJ. Lithium in the episode and suicide prophylaxis and in augmenting strategies in patients with unipolar depression. Int J Bipolar Disord 2017;5:11.
2. Abu-Hijleh FA, Prashar S, Joshi H, Sharma R, et al. Novel mechanism of action for the mood stabilizer lithium. Bipolar Disord 2020 October 9; https://doi.org/10.1111/bdi.13019.
3. Adityanjee, Munshi KR, Thampy A. The syndrome of irreversible lithium-effectuated neurotoxicity. Clin Neuropharmacol 2005;28:38–49.
4. Adli M, Bschor T, Canata B, Döpfmer S, et al. Lithium in der Behandlung der akuten Depression. Fortschr Neurol Psychiatr 1998;66:435–41.
5. Amare AT, Schubert KO, Hou L, Clark SR, et al. Association of polygenic score for schizophrenia and HLA antigen and inflammation genes with response to lithium in bipolar affective disorder: A genome-wide association study. JAMA Psychiatry 2018;75:65–74.
6. Amerio A, Ossola P, Scagnelli F, Odone A, et al. Safety and efficacy of lithium in children and adolescents: A systematic review in bipolar illness. Eur Psychiatry 2018;54:85–97.
7. Ananth M, Bartlett EA, DeLorenzo C, Lin X, et al. Prediction of lithium treatment response in bipolar depression using 5-HTT and 5-HT1A PET. Eur J Nucl Med Mol Imaging 2020;47:2417–28.
8. Angst J. Ungelöste Probleme bei der Indikationstellung zur Lithiumprophylaxe affektiver und schizoaffektiver Erkrankungen. Biblthca psychiat 1981;161:32–44.
9. Antolín-Concha D, Lähteenvuo M, Vattulainen P, Tanskanen A, et al. Suicide mortality and use of psychotropic drugs in patients hospitalized due to bipolar disorder: A Finnish nationwide cohort study. J Affect Disord 2020;277:885–92.
10. Baastrup PC, Schou M. Lithium as a prophylactic agents. Its effect against recurrent depressions and manic-depressive psychosis. Arch Gen Psychiatry 1967;16:162–72.
11. Baethge C, Gruschka P, Berghöfer A, Bauer M, et al. Prophylaxis of schizoaffective disorder with lithium or carbamazepine: outcome after long-term follow-up. J Affect Disord 2004;79:43–50.
12. Baldessarini RJ, Pompili M, Tondo L. Suicide in bipolar disorder: Risks and management. CNS Spectr 2006;11:465–71.
13. Baldessarini RJ, Tondo L. Suicidal risks during treatment of bipolar disorder patients with lithium versus anticonvulsants. Pharmacopsychiatry 2009;42:72–5.
14. Baldessarini RJ, Tondo L, Floris G, Rudas N. Reduced morbidity after gradual discontinuation of lithium treatment for bipolar I and II disorders: a replication study. Am J Psychiatry 1997;154:551–3.
15. Baldessarini RJ, Tondo L, Hennen J. Effects of lithium treatment and its discontinuation on suicidal behavior in bipolar manic-depressive disorders. J Clin Psychiatry 1999;60:77–84.
16. Baldessarini RJ, Tondo L, Viguera AC. Discontinuing lithium maintenance treatment in bipolar disorders: risks and implications. Bipolar Disord 1999;1:17–24.
17. Baldessarini RJ, Vazquez GH, Tondo L. Bipolar depression: a major unsolved challenge. Int J Bipolar Disord 2020;8:1.
18. Barjasteh-Askari F, Davoudi M, Amini H, Ghorbani M, et al. Relationship between suicide mortality and lithium in drinking water: A systematic review and meta-analysis. J Affect Disord 2020;264:234–41.
19. Bauer M, Adli M, Ricken R, Severus E, et al. Role of lithium augmentation in the management of major depressive disorder. CNS Drugs 2014;28:331–42.
20. Bauer M, Pfennig A, Severus E, Whybrow PC, et al. World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for biological treatment of unipolar depressive disorders, part 1: update 2013 on the acute and continuation treatment of unipolar depressive disorders. World J Biol Psychiatry 2013;14:334–85.
21. Bendz H, Sjodin I, Toss G, Berglund K. Hyperparathyroidism and long-term lithium therapy – a cross-sectional study and the effect of lithium withdrawal. J Intern Med 1996;240:357–65.
22. Benkert O, Hippius H (Hrsg.). Kompendium der Psychiatrischen Pharmakotherapie. 12. Auflage. Heidelberg: Springer, 2018.
23. Berger M, Riedel M, Tomova N, Obermeier M, et al. Do current screening recommendations allow for early detection of lithium-induced hyperparathyroidism in patients with bipolar disorder? Int J Bipolar Disord 2013;1:7.
24. Berghöfer A, Grof P, Müller-Oerlinghausen B. Recommendations for the safe use of lithium. In: Bauer M, Grof P, Müller-Oerlinghausen B (Hrsg.). Lithium in Neuropsychiatry – The Comprehensive Guide. Boca Raton: CRC Press, 2006: 443–64.
25. Birmaher B, Axelson D, Strober M, Gill MK, et al. Clinical course of children and adolescents with bipolar spectrum disorders. Arch Gen Psychiatry 2006;63:175–83.
26. Blake LD, Lucas DN, Aziz K, Castello-Cortes A, et al. Lithium toxicity and the parturient: case report and literature review. Int J Obstet Anesth 2008;17:164–9.
27. Bocchetta A, Ardau R, Carta P, Ligas F, et al. Duration of lithium treatment is a risk factor for reduced glomerular function: a cross-sectional study. BMC Med 2013;11:33.
28. Bocchetta A, Ardau R, Fanni T, Sardu C, et al. Renal function during long-term lithium treatment: a cross-sectional and longitudinal study. BMC Med 2015;13:12.
29. Borjesson J, Gotzsche PC. Effect of lithium on suicide and mortality in mood disorders: A systematic review. Int J Risk Saf Med 2019;30:155–66.
30. Bourin MS, Severus E, Schronen JP, Gass P, et al. Lithium as add-on to quetiapine XR in adult patients with acute mania: a 6-week, multicenter, double-blind, randomized, placebo-controlled study. Int J Bipolar Disord 2014;2:14.
31. Bschor T, Bauer M. Nebenwirkungs- und Risikoprofil von Lithium: Kritische Bewertung einer systematischen Übersicht und Metaanalyse. Nervenarzt 2013;84:860–3.
32. Bschor T, Uhr M, Baethge C, Lewitzka U, et al. Acute antidepressive efficacy of lithium monotherapy, not citalopram, depends on recurrent course of depression. J Clin Psychopharmacol 2013;33:38–44.
33. Cade JF. Lithium salts in the treatment of psychotic excitement. Med J Aust 1949;12:349–52.
34. Calabrese JR, Shelton MD, Rapport DJ, Youngstrom EA, et al. A 20-month, double-blind, maintenance trial of lithium versus divalproex in rapid-cycling bipolar disorder. Am J Psychiatry 2005;162:2152–61.
35. Chen PH, Kao YH, Chang CK, Lin YK, et al. Clinical risk factors for therapeutic lithium-associated electrocardiographic changes in patients with bipolar disorder. J Clin Psychopharmacol 2020;40:46–53.
36. Cikankova T, Sigitova E, Zverova M, Fisar Z, et al. Mitochondrial dysfunctions in bipolar disorder: Effect of the disease and pharmacotherapy. CNS Neurol Disord Drug Targets 2017;16:176–86.
37. Cipriani A, Hawton K, Stockton S, Geddes JR. Lithium in the prevention of suicide in mood disorders: updated systematic review and meta-analysis. BMJ 2013;346:f3646.
38. Cipriani A, Pretty H, Hawton K, Geddes JR. Lithium in the prevention of suicidal behavior and all-cause mortality in patients with mood disorders: a systematic review of randomized trials. Am J Psychiatry 2005;162:1805–19.
39. Cipriani A, Smith K, Burgess S, Carney S, et al. Lithium versus antidepressants in the long-term treatment of unipolar affective disorder. Cochrane Database Syst Rev 2006;(4):CD003492.
40. Clayton PJ. Training at Washington University School of Medicine in Psychiatry in the late 1950‘s, from the perspective of an affective disorder researcher. J Affect Disord 2006;92:13–7.
41. Costa Lda S, Alencar AP, Nascimento Neto PJ, dos Santos Mdo S, et al. Risk factors for suicide in bipolar disorder: a systematic review. J Affect Disord 2015;170:237–54.
42. Crossley NA, Bauer M. Acceleration and augmentation of antidepressants with lithium for depressive disorders: two meta-analyses of randomized, placebo-controlled trials. J Clin Psychiatry 2007;68:935–40.
43. Crump C, Sundquist K, Winkleby MA, Sundquist J. Comorbidities and mortality in bipolar disorder: a Swedish national cohort study. JAMA Psychiatry 2013;70:931–9.
44. Dar SA, Bhat BA, Khanam A, Wani ZA, et al. Thyroid hormone levels and thyroid hormone levels and ultrasonographic changes in the thyroid gland of patients on long-term lithium treatment for affective disorders: A controlled study. J Med Ultrasound 2020;28:104–10.
45. de Vries C, van Bergen A, Regeer EJ, Benthem E, et al. The effectiveness of restarted lithium treatment after discontinuation: reviewing the evidence for discontinuation-induced refractoriness. Bipolar Disord 2013;15:645–9.
46. Del Matto L, Muscas M, Murru A, Verdolini N, et al. Lithium and suicide prevention in mood disorders and in the general population: A systematic review. Neurosci Biobehav Rev 2020;116:142–53.
47. DGBS e. V. und DGPPN e. V. S3-Leitlinie zur Diagnostik und Therapie Bipolarer Störungen. Langversion 2.0. http://www.leitlinie-bipolar.de/wp-content/uploads/2019/11/S3_Leitlinie-Bipolar_V2_Update_20191018.pdf (Zugriff am 08.02.2020).
48. Dols A, Kessing LV, Strejilevich SA, Rej S, et al. Do current national and international guidelines have specific recommendations for older adults with bipolar disorder? A brief report. Int J Geriatr Psychiatry 2016;31:1295–300.
49. Duffy A, Heffer N, Goodday SM, Weir A, et al. Efficacy and tolerability of lithium for the treatment of acute mania in children with bipolar disorder: A systematic review: A report from the ISBD-IGSLi joint task force on lithium treatment. Bipolar Disord 2018;20:583–93.
50. Dunner DL, Fieve RR. Clinical factors in lithium carbonate prophylaxis failure. Arch Gen Psychiatry 1974;30:229–33.
51. Eysenck H. Psychophysiology and personality: Extraversion, neuroticism and psychoticism. In: Edvar D (ed.). Physiological Correlates of Human Behaviour. London: Academic Press Inc., 1983:13–30.
52. Felber W, Bauer M, Lewitzka U, Müller-Oerlinghausen B. Lithium clinics in Berlin and Dresden: a 50-year experience. Pharmacopsychiatry 2018;51:166–71.
53. Felber W, Kyber A. Suizide und Parasuizide während und außerhalb einer Lithiumprophylaxe. In: Müller-Oerlinghausen B, Berghoefer A (Hrsg.). Ziele und Ergebnisse der medikamentösen Prophylaxe affektiver Psychosen. Stuttgart: Thieme, 1994:53–9.
54. Fieve RR, Kumbaraci T, Dunner DL. Lithium prophylaxis of depression in bipolar I, bipolar II, and unipolar patients. Am J Psychiatry 1976;133:925–9.
55. Findling RL, Kafantaris V, Pavuluri M, McNamara NK, et al. Dosing strategies for lithium monotherapy in children and adolescents with bipolar I disorder. J Child Adolesc Psychopharmacol 2011;21:195–205.
56. Forlenza OV, Radanovic M, Talib LL, Gattaz WF. Clinical and biological effects of long-term lithium treatment in older adults with amnestic mild cognitive impairment: randomised clinical trial. Br J Psychiatry published online April 5, 2019: 1–7; doi:10.1192/bjp.2019.76
57. Fornaro M, Maritan E, Ferranti R, Zaninotto L, et al. Lithium exposure during pregnancy and the postpartum period: A systematic review and meta-analysis of safety and efficacy outcomes. Am J Psychiatry 2020;177:76–92.
58. Foster JR, Gershell WJ, Goldfarb AI. Lithium treatment in the elderly. I. Clinical usage. J Gerontol 1977;32:299–302.
59. Fries GR, Zamzow MJ, Andrews T, Pink O, et al. Accelerated aging in bipolar disorder: A comprehensive review of molecular findings and their clinical implications. Neurosci Biobehav Rev 2020;112:107–16.
60. Galbally M, Bergink V, Vigod SN, Buist A, et al. Breastfeeding and lithium: is breast always best? Lancet Psychiatry 2018;5:534–6.
61. Garnham J, Munro A, Slaney C, MacDougall M, et al. Prophylactic treatment response in bipolar disorder: results of a naturalistic observation study. J AffectDisord 2007;104:185–90.
62. Geddes J, Goodwin G, Rendell J, Hainsworth J, et al. New trial should clarify lithium use in bipolar disorder. BMJ 2002;325:441.
63. Geddes JR, Burgess S, Hawton K, Jamison K, Goodwin GM. Long-term lithium therapy for bipolar disorder: systematic review and meta-analysis of randomized controlled trials. AmJ Psychiatry 2004;161:217–22.
64. Geddes JR, Goodwin GM, Rendell J, Azorin JM, et al. Lithium plus valproate combination therapy versus monotherapy for relapse prevention in bipolar I disorder (BALANCE): a randomised open-label trial. Lancet 2010;375: 385–95.
65. Gentile S. Lithium in pregnancy: the need to treat, the duty to ensure safety. Expert Opin Drug Saf 2012;11:425–37.
66. Geoffroy PA, Etain B, Sportiche S, Bellivier F. Circadian biomarkers in patients with bipolar disorder: promising putative predictors of lithium response. Int J Bipolar Disord 2014;2:28.
67. Gershon S, Yuwiler A. Lithium ion: a specific psychopharmacological approach to the treatment of mania. J Neuropsychiatr 1960;1:229–41.
68. Gonzalez-Pinto A, Gutierrez M, Mosquera F, Ballesteros J, et al. First episode in bipolar disorder: misdiagnosis and psychotic symptoms. J AffectDisord 1998;50:41–4.
69. Gonzalez-Pinto A, Mosquera F, Alonso M, Lopez P, et al. Suicidal risk in bipolar I disorder patients and adherence to long-term lithium treatment. Bipolar Disord 2006;8:618–24.
70. Goodwin GM. Recurrence of mania after lithium withdrawal. Implications for the use of lithium in the treatment of bipolar affective disorder. Br J Psychiatry 1994;164:149–52.
71. Gordovez FJA, McMahon FJ. The genetics of bipolar disorder. Mol Psychiatry 2020;25:544–59.
72. Greil W, Ludwig-Mayerhofer W, Erazo N, Engel RR, et al. Lithium vs carbamazepine in the maintenance treatment of schizoaffective disorder: a randomised study. Eur Arch Psychiatry Clin Neurosci 1997;247:42–50.
73. Grof P. Responders to long-term lithium treatment. In: Bauer M, Grof P, Müller-Oerlinghausen B (Hrsg.). Lithium in neuropsychiatry: the comprehensive guide. London: Informa Healthcare, 2006: 157–78.
74. Grof P, Duffy A, Cavazzoni P, Grof E, et al. Is response to prophylactic lithium a familial trait? J Clin Psychiatry 2002;63:942–7.
75. Grof P, Müller-Oerlinghausen B. A critical appraisal of lithium‘s efficacy and effectiveness: the last 60 years. Bipolar Disord 2009;11(Suppl 2):10–9.
76. Grünfeld JP, Rossier BC. Lithium nephrotoxicity revisited. Nat Rev Nephrol 2009;5:270–6.
77. Grunze H. Lithium in the acute treatment of bipolar disorders – a stocktaking. Eur Arch Psychiatry Clin Neurosci 2003;253:115–9.
78. Grunze H, Schlösser S, Walden J. Leserbrief zu: M. Adli, T. Bschor, B. Canata. S. Dopfmer, M. Bauer: Lithium in der Behandlung der akuten Depression. Fortschr Neurol Psychiat 1998;66:435–41. Fortschr Neurol Psychiatr 1999;67:384–6.
79. Grunze H, Severus E, Laux G, Müller WE. Weiterbildungs-Curriculum Psychopharmakologie/ Pharmakotherapie, Teil 12: Stimmungsstabilisierer – II: Lithium. Psychopharmakotherapie 2020;27:149–55.
80. Grunze H, Vieta E, Goodwin G, Bowden C, et al. The World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for the biological treatment of bipolar disorders: Acute and long-term treatment of mixed states in bipolar disorder. World J Biol Psychiatry 2018;19:2–58.
81. Grunze H, Vieta E, Goodwin GM, Bowden C, et al. The World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for the biological treatment of bipolar disorders: Update 2010 on the treatment of acute bipolar depression. World J Biol Psychiatry 2010;11:81–109.
82. Haukvik UK, Gurholt TP, Nerland S, Elvsåshagen T, et al. In vivo hippocampal subfield volumes in bipolar disorder – A mega-analysis from the enhancing neuro imaging genetics through meta-analysis bipolar disorder working group. Hum Brain Mapp 2020 Oct 19, doi: 10.1002/hbm.25249.
83. Haussmann R, Bauer M, von Bonin S, Grof P, et al. Treatment of lithium intoxication: facing the need for evidence. Int J Bipolar Disord 2015;3:23.
84. Hayes JF, Marston L, Walters K, Geddes JR, et al. Lithium vs. valproate vs. olanzapine vs. quetiapine as maintenance monotherapy for bipolar disorder: a population-based UK cohort study using electronic health records. World Psychiatry 2016;15:53–8.
85. Hayes JF, Miles J, Walters K, King M, et al. A systematic review and meta-analysis of premature mortality in bipolar affective disorder. Acta Psychiatr Scand 2015;131:417–25.
86. Hermann A, Gorun A, Benudis A. Lithium use and non-use for pregnant and postpartum women with bipolar disorder. Curr Psychiatry Rep 2019;21:114.
87. Hetmar O, Brun C, Ladefoged J, Larsen S, et al. Long-term effects of lithium on the kidney: functional-morphological correlations. J Psychiatr Res 1989;23:285–97.
88. Hou L, Heilbronner U, Degenhardt F, Adli M, et al. Genetic variants associated with response to lithium treatment in bipolar disorder: a genome-wide association study. Lancet 2016;387:1085–93.
89. Hozer F, Sarrazin S, Laidi C, Favre P, et al. Lithium prevents grey matter atrophy in patients with bipolar disorder: an international multicenter study. Psychol Med published online Jan 27, 2020:1–10; doi: 10.1017/S0033291719004112.
90. Hui TP, Kandola A, Shen L, Lewis G, et al. A systematic review and meta-analysis of clinical predictors of lithium response in bipolar disorder. Acta Psychiatr Scand 2019;140:94–115.
91. Ibrahim Y, Mohamed SE, Deniwar A, Al-Qurayshi ZH, et al. Lithium-associated hyperparathyroidism: A pooled analysis. ORL J Otorhinolaryngol Relat Spec 2015;77:273–80.
92. Jefferson JW, Greist JH, Ackerman DL, Caroll JA (Hrsg.). Lithium encyclopedia for clinical practice. Washington D.C.: American Psychiatric Press Inc., 1984.
93. Jensen HV, Plenge P, Stensgaard A, Mellerup ET, et al. Twelve-hour brain lithium concentration in lithium maintenance treatment of manic-depressive disorder: daily versus alternate-day dosing schedule. Psychopharmacology (Berl) 1996;124:275–8.
94. Jeste DV, Alexopoulos GS, Bartels SJ, Cummings JL, et al. Consensus statement on the upcoming crisis in geriatric mental health: research agenda for the next 2 decades. Arch Gen Psychiatry 1999;56:848–53.
95. Joas E, Karanti A, Song J, Goodwin GM, et al. Pharmacological treatment and risk of psychiatric hospital admission in bipolar disorder. Br J Psychiatry 2017;210:197–202.
96. Kane JM, Quitkin FM, Rifkin A, Ramos-Lorenzi JR, et al. Lithium carbonate and imipramine in the prophylaxis of unipolar and bipolar II illness: a prospective, placebo-controlled comparison. Arch Gen Psychiatry 1982;39:1065–9.
97. Keck PE, McElroy SL, Bennett JA. Pharmacologic loading in the treatment of acute mania. Bipolar Disord 2000;2:42–6.
98. Kemp DE, Gao K, Ganocy SJ, Elhaj O, et al. A 6-month, double-blind, maintenance trial of lithium monotherapy versus the combination of lithium and divalproex for rapid-cycling bipolar disorder and co-occurring substance abuse or dependence. J Clin Psychiatry 2009;70:113–21.
99. Kennedy N, Everitt B, Boydell J, Van Os J, et al. Incidence and distribution of first-episode mania by age: results from a 35-year study. Psychol Med 2005;35:855–63.
100. Kessing LV, Bauer M, Nolen WA, Severus E, et al. Effectiveness of maintenance therapy of lithium vs other mood stabilizers in monotherapy and in combinations: a systematic review of evidence from observational studies. Bipolar Disord 2018;20:419–31.
101. Kessing LV, Gerds TA, Feldt-Rasmussen B, Andersen PK, et al. Use of lithium and anticonvulsants and the rate of chronic kidney disease: A nationwide population-based study. JAMA Psychiatry 2015;72:1182–91.
102. Kessing LV, Hellmund G, Andersen PK. An observational nationwide register based cohort study on lamotrigine versus lithium in bipolar disorder. J Psychopharmacol 2012;26:644–52.
103. Kessing LV, Hellmund G, Geddes JR, Goodwin GM, et al. Valproate v. lithium in the treatment of bipolar disorder in clinical practice: observational nationwide register-based cohort study. Br J Psychiatry 2011;199:57–63. Corrections in: Br J Psychiatry 2011;199:343.
104. Kilts CD. In vivo imaging of the pharmacodynamics and pharmacokinetics of lithium. J Clin Psychiatry 2000;61:41–6.
105. Kohno K, Ishii N, Hirakawa H, Terao T. Lithium in drinking water and crime rates in Japan: cross-sectional study. B J Psych Open 2020;6:e122.
106. Kukopoulos A, Minnai G, Muller-Oerlinghausen B. The influence of mania and depression on the pharmacokinetics of lithium. A longitudinal single-case study. J Affect Disord 1985;8:159–66.
107. Kupka RW, Luckenbaugh DA, Post RM, Suppes T, et al. Comparison of rapid-cycling and non-rapid-cycling bipolar disorder based on prospective mood ratings in 539 outpatients. Am J Psychiatry 2005;162:1273–80.
108. Lahteenvuo M, Tanskanen A, Taipale H, Hoti F, et al. Real-world effectiveness of pharmacologic treatments for the prevention of rehospitalization in a Finnish nationwide cohort of patients with bipolar disorder. JAMA Psychiatry 2018;75:347–55.
109. Landersdorfer CB, Findling RL, Frazier JA, Kafantaris V, et al. Lithium in paediatric patients with bipolar disorder: Implications for selection of dosage regimens via population pharmacokinetics/pharmacodynamics. Clin Pharmacokinet 2017;56:77–90.
110. Lange C (Hrsg.). Om periodiske Depressionstilstande og deres Patogenese. Kopenhagen: Jacob Lunds Forlag, 1886.
111. Lenox RH, Manji H. Lithium. In: Schatzberg AF, Nemeroff C (Hrsg.). The American Psychiatry Press Textbook of Psychopharmacology. Washington DC: American Psychiatric Press, Inc., 2005: 379–429.
112. Lieber I, Ott M, Ohlund L, Lundqvist R, et al. Lithium-associated hypothyroidism and potential for reversibility after lithium discontinuation: Findings from the LiSIE retrospective cohort study. J Psychopharmacol 2020;34: 293–303.
113. Lundberg M, Millischer V, Backlund L, Martinsson L, et al. Lithium and the interplay between telomeres and mitochondria in bipolar disorder. Front Psychiatry 2020;11:586083.
114. Maj M. Lithium prophylaxis of schizoaffective disorders: a prospective study. J Affect Disord 1988;14:129–35.
115. Malhi GS, Bell E, Outhred T, Berk M. Lithium therapy and its interactions. Aust Prescr 2020;43:91–3.
116. Malhi GS, Tanious M, Das P, Berk M. The science and practice of lithium therapy. Aust N Z J Psychiatry 2012;46:192–211.
117. Matsunaga S, Kishi T, Annas P, Basun H, et al. Lithium as a treatment for Alzheimer‘s disease: A systematic review and meta-analysis. J Alzheimers Dis 2015;48:403–10.
118. McKnight RF, Adida M, Budge K, Stockton S, et al. Lithium toxicity profile: A systematic review and meta-analysis. Lancet 2012;379:721–8.
119. McKnight RF, de La Motte de Broons de Vauvert S, Chesney E, Amit BH, et al. Lithium for acute mania. Cochrane Database Syst Rev 2019;6:CD004048.
120. Mehta N, Vannozzi R. Lithium-induced electrocardiographic changes: A complete review. Clin Cardiol 2017;40:1363–7.
121. Meltzer-Brody S, Jones I. Optimizing the treatment of mood disorders in the perinatal period. Dialogues Clin Neurosci 2015;17:207–18.
122. Meltzer H. Antipsychotic agents and lithium. In: Katzung B, Masters S, Trevor A (Hrsg.). Basic and Clinical Pharmacology. 11. Auflage. New York: McGraw Hill, 2009: 487–507.
123. Meltzer HY, Alphs L, Green AI, Altamura AC, et al. Clozapine treatment for suicidality in schizophrenia: International Suicide Prevention Trial (InterSePT). Arch Gen Psychiatry 2003;60:82–91.
124. Memon A, Rogers I, Fitzsimmons S, Carter B, et al. Association between naturally occurring lithium in drinking water and suicide rates: systematic review and meta-analysis of ecological studies. Br J Psychiatry 2020;217:667–78.
125. Miller JN, Black DW. Bipolar disorder and suicide: A review. Curr Psychiatry Rep 2020;22:6.
126. Miranda A, Shekhtman T, McCarthy M, DeModena A, et al. Study of 45 candidate genes suggests CACNG2 may be associated with lithium response in bipolar disorder. J Affect Disord 2019;248:175–9.
127. Moore CM, Demopulos CM, Henry ME, Steingard RJ, et al. Brain-to-serum lithium ratio and age: an in vivo magnetic resonance spectroscopy study. Am J Psychiatry 2002;159:1240–2.
128. Müller-Oerlinghausen B, Ahrens B, Felber W. The suicide-preventive and mortality reducing effect of lithium. In: Bauer M, Grof P, Müller-Oerlinghausen B (Hrsg.). Lithium in Neuropsychiatry: The Comprehensive Guide. Oxfordshire, UK: Informa Healthcare, 2006: 179–92.
129. Müller WE, Laux G. Weiterbildungs-Curriculum Psychopharmakologie/Pharmakotherapie, Teil 1: Allgemeine Psychopharmakotherapie, allgemeine Pharmakologie, Antidepressiva-Pharmakologie. Psychopharmakotherapie 2017;24:276–82.
130. Müller WE, Müller JK. Bipolare Störungen: Basiswissen. Aktueller Forschungsstand zu Genetik, Neurobiologie und Pharmakologie. Med Mo Pharm 2016;39:371–87.
131. Munoz-Negro JE, Cuadrado L, Cervilla JA. Current evidences on psychopharmacology of schizoaffective disorder. Actas Esp Psiquiatr 2019;47:190–201.
132. National Collaborating Centre for Mental H. Bipolar disorder.The management of bipolar disorder in adults, children and adolescents, in primary and secondary care. CG38: NICE Guideline. National Institute for Health and Clinical Excellence, 2006.
133. National Kidney F. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis 2002;39:S1–266.
134. Nelson JC, Baumann P, Delucchi K, Joffe R, et al. A systematic review and meta-analysis of lithium augmentation of tricyclic and second generation antidepressants in major depression. J Affect Disord 2014;168:269–75.
135. Netto I, Phutane VH, Ravindran B. Lithium neurotoxicity due to second-generation antipsychotics combined with lithium: A systematic review. Prim Care Companion CNS Disord 2019;21:17r02225;.doi: 10.4088/PCC.17402225.
136. Nolen WA, Licht RW, Young AH, Malhi GS, et al. What is the optimal serum level for lithium in the maintenance treatment of bipolar disorder? A systematic review and recommendations from the ISBD/IGSLI Task Force on treatment with lithium. Bipolar Disord 2019;21:394–409.
137. Nunes A, Ardau R, Berghofer A, Bocchetta A, et al. Prediction of lithium response using clinical data. Acta Psychiatr Scand 2020;141:131–41.
138. Nunes MA, Viel TA, Buck HS. Microdose lithium treatment stabilized cognitive impairment in patients with Alzheimer‘s disease. Curr Alzheimer Res 2013;10:104–7.
139. Ossani GP, Uceda AM, Lago NR, Martino DJ. Relationship between serum lithium concentration and kidney damage in a preclinical model. Bipolar Disord 2019; https://doi.org/10.1111/bdi.12854.
140. Ownby RL, Crocco E, Acevedo A, John V, et al. Depression and risk for Alzheimer disease: systematic review, meta-analysis, and metaregression analysis. Arch Gen Psychiatry 2006;63:530–8.
141. Pacchiarotti I, Leon-Caballero J, Murru A, Verdolini N, et al. Mood stabilizers and antipsychotics during breastfeeding: Focus on bipolar disorder. Eur Neuropsychopharmacol 2016;26:1562–78.
142. Patel NC, Delbello MP, Bryan HS, Adler CM, et al. Open-label lithium for the treatment of adolescents with bipolar depression. J Am Acad Child Adolesc Psychiatry 2006;45:289–97.
143. Pathak R, Pathak A. Effectiveness of zinc supplementation on lithium-induced alterations in thyroid functions. Biol Trace Elem Res 2020; doi: 10.1007/s12011-020-02356-9.
144. Paulzen M, Gründer G, Benkert O. Medikamente zur Behandlung Bipolarer Störungen. In: Benkert O, Hippius H (Hrsg.). Kompendium der Psychiatrischen Pharmakotherapie. 13 Auflage. Heidelberg: Springer, 2021:246.
145. Perlis RH, Sachs GS, Lafer B, Otto MW, et al. Effect of abrupt change from standard to low serum levels of lithium: a reanalysis of double-blind lithium maintenance data. Am J Psychiatry 2002;159:1155–9.
146. Pisanu C, Heilbronner U, Squassina A. The role of pharmacogenomics in bipolar disorder: Moving towards precision medicine. Mol Diagn Ther 2018;22:409–20.
147. Plans L, Barrot C, Nieto E, Rios J, et al. Association between completed suicide and bipolar disorder: A systematic review of the literature. J Affect Disord 2019;242:111–22.
148. Plenge P, Stensgaard A, Jensen HV, Thomsen C, et al. 24-hour lithium concentration in human brain studied by Li-7 magnetic resonance spectroscopy. Biol Psychiatry 1994;36:511–6.
149. Poels EM, Sterrenburg K, Wierdsma AI, Wesseloo R, et al. Lithium exposure during pregnancy increases fetal growth. J Psychopharmacol 2020:269881120940914.
150. Poels EMP, Bijma HH, Galbally M, Bergink V. Lithium during pregnancy and after delivery: a review. Int J Bipolar Disord 2018;6:26.
151. Poels EMP, Kamperman AM, Vreeker A, Gilden J, et al. Lithium use during pregnancy and the risk of miscarriage. J Clin Med 2020;9:1819; doi: 10.3390/jcm9061819.
152. Post RM, Leverich GS, Altshuler L, Mikalauskas K. Lithium-discontinuation-induced refractoriness: preliminary observations. Am J Psychiatry 1992;149:1727–9.
153. Priebe GA, Kanzawa MM. Reducing the progression of Alzheimer‘s disease in Down syndrome patients with micro-dose lithium. Med Hypotheses 2020;137:109573.
154. Quitkin FM, Kane JM, Rifkin A, Ramos-Lorenzi JR, et al. Lithium and imipramine in the prophylaxis of unipolar and bipolar II depression: a prospective, placebo-controlled comparison. Psychopharmacol Bull 1981;17:142–4.
155. Rej S, Looper K, Segal M. The effect of serum lithium levels on renal function in geriatric outpatients: a retrospective longitudinal study. Drugs Aging 2013;30:409–15.
156. Riedl U, Barocka A, Kolem H, Demling J, et al. Duration of lithium treatment and brain lithium concentration in patients with unipolar and schizoaffective disorder – a study with magnetic resonance spectroscopy. Biol Psychiatry 1997;41:844–50.
157. Rybakowski JK, Dembinska D, Kliwicki S, Akiskal KK, et al. TEMPS-A and long-term lithium response: positive correlation with hyperthymic temperament. J Affect Disord 2013;145:187–9.
158. Sajatovic M, Strejilevich SA, Gildengers AG, Dols A, et al. A report on older-age bipolar disorder from the International Society for Bipolar Disorders Task Force. Bipolar Disord 2015;17:689–704.
159. Sani G, Fiorillo A. The use of lithium in mixed states. CNS Spectr 2019:1–3.
160. Schloesser RJ, Martinowich K, Manji HK. Mood-stabilizing drugs: mechanisms of action. Trends Neurosci 2012;35:36–46.
161. Schoot TS, Molmans THJ, Grootens KP, Kerckhoffs APM. Systematic review and practical guideline for the prevention and management of the renal side effects of lithium therapy. Eur Neuropsychopharmacol 2020;31:16–32.
162. Schou M. Lithium studies. 1. Toxicity. Acta Pharmacol Toxicol (Copenh) 1958;15:70–84.
163. Schou M. Serum lithium monitoring of prophylactic treatment. Critical review and updated recommendations. Clin Pharmacokinet 1988;15:283–6.
164. Scott J, Etain B, Manchia M, Brichant-Petitjean C, et al. An examination of the quality and performance of the Alda scale for classifying lithium response phenotypes. Bipolar Disord 2019; https://doi.org/10.1111/bdi.12829.
165. Severus E, Bauer M. Managing the risk of lithium-induced nephropathy in the long-term treatment of patients with recurrent affective disorders. BMC Med 2013;11:34.
166. Severus E, Bauer M, Geddes J. Efficacy and effectiveness of lithium in the long-term treatment of bipolar disorders: An update 2018. Pharmacopsychiatry 2018;51:173–6.
167. Severus E, Taylor MJ, Sauer C, Pfennig A, et al. Lithium for prevention of mood episodes in bipolar disorders: systematic review and meta-analysis. Int J Bipolar Disord 2014;2:15.
168. Severus WE, Grunze H, Kleindienst N, Frangou S, et al. Is the prophylactic antidepressant efficacy of lithium in bipolar I disorder dependent on study design and lithium level? J Clin Psychopharmacol 2005;25:457–62.
169. Severus WE, Kleindienst N, Seemüller F, Frangou S, et al. What is the optimal serum lithium level in the long-term treatment of bipolar disorder – a review? Bipolar Disord 2008;10:231–7.
170. Shine B, McKnight RF, Leaver L, Geddes JR. Long-term effects of lithium on renal, thyroid, and parathyroid function: a retrospective analysis of laboratory data. Lancet 2015;386:461–8.
171. Shorter E. The history of lithium therapy. Bipolar Disord 2009;11(Suppl 2):4–9.
172. Shulman KI, Almeida OP, Herrmann N, Schaffer A, et al. Delphi survey of maintenance lithium treatment in older adults with bipolar disorder: An ISBD task force report. Bipolar Disord 2019;21:117–23.
173. Smith KA, Cipriani A. Lithium and suicide in mood disorders: Updated meta-review of the scientific literature. Bipolar Disord 2017;19:575–86.
174. Soeiro-de-Souza MG, Dias VV, Figueira ML, Forlenza OV, et al. Translating neurotrophic and cellular plasticity: from pathophysiology to improved therapeutics for bipolar disorder. Acta Psychiatr Scand 2012;126:332–41.
175. Souza FG, Goodwin GM. Lithium treatment and prophylaxis in unipolar depression: a meta-analysis. Br J Psychiatry 1991;158:666–75.
176. Sowden GL, Huffman JC. The impact of mental illness on cardiac outcomes: A review for the cardiologist. Int J Cardiol 2009;132:30–7.
177. Sportiche S, Geoffroy PA, Brichant-Petitjean C, Gard S, et al. Clinical factors associated with lithium response in bipolar disorders. Aust N Z J Psychiatry 2017;51:524–30.
178. Stacey D, Schubert KO, Clark SR, Amare AT, et al. A gene co-expression module implicating the mitochondrial electron transport chain is associated with long-term response to lithium treatment in bipolar affective disorder. Transl Psychiatry 2018;8:183.
179. Stevens A, Goossens PJJ, Knoppert-van der Klein EAM, Draisma S, et al. Risk of recurrence of mood disorders during pregnancy and the impact of medication: A systematic review. J Affect Disord 2019;249:96–103.
180. Stout J, Hozer F, Coste A, Mauconduit F, et al. Accumulation of lithium in the hippocampus of patients with bipolar disorder: A lithium-7 magnetic resonance imaging study at 7 tesla. Biol Psychiatry 2020;88:426–33.
181. Strober M, DeAntonio M, Schmidt-Lackner S. Early childhood attention deficit hyperactivity disorder predicts poorer response to acute lithium therapy in adolescent mania. J AffectDisord 1998;51:145–51.
182. Sugawara H, Sakamoto K, Harada T, Ishigooka J. Predictors of efficacy in lithium augmentation for treatment-resistant depression. J AffectDisord 2010;125:165–8.
183. Sun YR, Herrmann N, Scott CJM, Black SE, et al. Global grey matter volume in adult bipolar patients with and without lithium treatment: A meta-analysis. J Affect Disord 2018;225:599–606.
184. Szczepankiewicz A, Narozna B, Rybakowski JK, Kliwicki S, et al. Genes involved in stress response influence lithium efficacy in bipolar patients. Bipolar Disord 2018;20:753–60.
185. Taylor MJ. Timing of onset of lithium relapse prevention in bipolar disorder: evidence from randomised trials. Br J Psychiatry 2018;213:664–6.
186. Tondo L, Baldessarini RJ, Floris G. Long-term clinical effectiveness of lithium maintenance treatment in types I and II bipolar disorders. Br J Psychiatry Suppl 2001;41:s184–90.
187. Tondo L, Baldessarini RJ, Hennen J, Floris G. Lithium maintenance treatment of depression and mania in bipolar I and bipolar II disorders. Am J Psychiatry 1998;155:638–45.
188. Tondo L, Vázquez GH, Baldessarini RJ. Prevention of suicidal behavior in bipolar disorder. Bipolar Disord 2020; https://doi.org/10.1111/bdi.13017.
189. US Food and Drug Administration. Lithium carbonate. https://www.accessdata.fda.gov/drugsatfda_docs/label/2016/017812s027%2C018421s025%2C018558s021lbl.pdf (Zugriff am 24.02.2020).
190. van der Loos ML, Mulder P, Hartong EG, Blom MB, et al. Long-term outcome of bipolar depressed patients receiving lamotrigine as add-on to lithium with the possibility of the addition of paroxetine in nonresponders: a randomized, placebo-controlled trial with a novel design. Bipolar Disord 2011;13:111–7.
191. Velosa J, Delgado A, Finger E, Berk M, et al. Risk of dementia in bipolar disorder and the interplay of lithium: a systematic review and meta-analyses. Acta Psychiatr Scand 2020;141:510–21.
192. Vernon AC, Natesan S, Crum WR, Cooper JD, et al. Contrasting effects of haloperidol and lithium on rodent brain structure: a magnetic resonance imaging study with postmortem confirmation. Biol Psychiatry 2012;71:855–63.
193. Viguera AC, Cohen AS. The course and management of bipolar disorder during pregnancy. Psychopharmacol Bull 1998;34:339–46.
194. Viguera AC, Nonacs R, Cohen LS, Tondo L, et al. Risk of recurrence of bipolar disorder in pregnant and nonpregnant women after discontinuing lithium maintenance. Am J Psychiatry 2000;157:179–84.
195. Volkmann C, Bschor T, Köhler S. Lithium treatment over the lifespan in bipolar disorders. Front Psychiatry 2020;11:377.
196. Wen J, Sawmiller D, Wheeldon B, Tan J. A review for lithium: Pharmacokinetics, drug design, and toxicity. CNS Neurol Disord Drug Targets 2019;18:769–78.
197. Werneke U, Ott M, Renberg ES, Taylor D, et al. A decision analysis of long-term lithium treatment and the risk of renal failure. Acta Psychiatr Scand 2012;126:186–97.
198. Wesseloo R, Wierdsma AI, van Kamp IL, Munk-Olsen T, et al. Lithium dosing strategies during pregnancy and the postpartum period. Br J Psychiatry 2017;211:31–6.
199. Westin AA, Brekke M, Molden E, Skogvoll E, et al. Changes in drug disposition of lithium during pregnancy: a retrospective observational study of patient data from two routine therapeutic drug monitoring services in Norway. BMJ Open 2017;7:e015738.
200. Woo YS, Yoon BH, Song JH, Seo JS, et al. Clinical correlates associated with the long-term response of bipolar disorder patients to lithium, valproate or lamotrigine: A retrospective study. PLoS One 2020;15:e0227217.
201. World Health Organisation. WHO mortality database. https://www.who.int/news-room/fact-sheets/detail/suicide (Zugriff am 23.02.2020).
202. Yacobi S, Ornoy A. Is lithium a real teratogen? What can we conclude from the prospective versus retrospective studies? A review. Isr J Psychiatry Relat Sci 2008;45:95–106.
203. Young AH, Grunze H. Physical health of patients with bipolar disorder. Acta Psychiatr Scand Suppl 2013;442:3–10.
204. Young AH, McElroy SL, Bauer M, Philips N, et al. A double-blind, placebo-controlled study of quetiapine and lithium monotherapy in adults in the acute phase of bipolar depression (EMBOLDEN I). J Clin Psychiatry 2010;71:150–62.
205. Zhou X, Ravindran AV, Qin B, Del Giovane C, et al. Comparative efficacy, acceptability, and tolerability of augmentation agents in treatment-resistant depression: systematic review and network meta-analysis. J Clin Psychiatry 2015;76:e487–98.
Dr. Anna Grunze, Psychiatrisches Zentrum Nordbaden, Heidelberger Straße 1A, 69168 Wiesloch
Priv.-Doz. Dr. med. Emanuel Severus, Klinik und Poliklinik für Psychiatrie und Psychotherapie, Universitätsklinikum Carl Gustav Carus Dresden, TU Dresden, Fetscherstraße 74, 01307 Dresden
Univ.-Prof. Dr. Walter E. Müller, Höhenstraße 49a, 67550 Worms
Priv.-Doz. Dr. med. Heinz Grunze, PMU Nürnberg & Psychiatrie Schwäbisch Hall, Ringstraße 1, 74523 Schwäbisch Hall, E-Mail: h.grunze@klinikum-weissenhof.de
Lithium therapy – oldie but goldie?
Lithium therapy of affective disorders is one of the longest and best-established treatments in psychiatry. Although an "oldie", new findings about mechanism of action and indications are still emerging, not only for established indications such as bipolar disorder or unipolar depression but also for suicide prevention and neuroprotective capabilities, e. g., in dementia. When prescribing lithium some points deserve special attention, and profound knowledge of handling and side effect profile is a prerequisite. This review summarises key facts of the historical evolution of lithium therapy, pharmacology, traditional and emerging indications, side effect profile and handling. Lithium remains to be an essential ingredient of our psychopharmacological repertoire, and profound knowledge of lithium is indispensable for professional training and practice.
Key words: lithium, bipolar disorder, depression, suicidality, side effect profile
Psychopharmakotherapie 2021; 28(01):3-20
