Daniel Schöttle, Wolfgang Janetzky, Hamburg, Elmar Beck, Möhrendorf, Christoph U. Correll, Berlin, und Klaus Wiedemann, Hamburg
Die Anwendung von Depot-Antipsychotika kann bei Patienten mit Schizophrenie die Therapieadhärenz und den Behandlungsverlauf verbessern, wodurch das Risiko von Rezidiven, Rehospitalisierung und Mortalität gesenkt werden kann [11, 27, 29].
Aripiprazol-Depot ist ein atypisches Depot-Antipsychotikum zur intramuskulären Injektion [16], dessen Wirksamkeit und Verträglichkeit bei Patienten mit Schizophrenie in randomisierten kontrollierten Studien nachgewiesen wurde [7, 10, 25]. Darüber hinaus verbessert sich die Lebensqualität der Patienten klinisch relevant unter Behandlung mit Aripiprazol-Depot [18]. Dieser Effekt bleibt über lange Zeit erhalten [17]. Begleitet wird dies von einer Verbesserung der Funktionalität und Arbeitsfähigkeit der Patienten [19, 23]. Diese Verbesserungen entsprechen den von Patienten genannten Erwartungen an eine Behandlung der Schizophrenie [2].Kishimoto und Kollegen haben gezeigt, dass sich in randomisierten, kontrollierten Studien kein eindeutiger Vorteil einer Depotformulierung gegenüber oraler Medikation nachweisen lässt. Verschieben sich die Studienbedingungen hin zu naturalistischen Bedingungen, wie dies etwa in prospektiven, retrospektiven oder Mirror-Image-Design-Studien mit gering vorselektierter Patientenklientel (häufig mit Komorbiditäten) der Fall ist, so lässt sich auch im Langzeitverlauf in naturalistischen Settings ein signifikanter Unterschied zugunsten der Depotbehandlung feststellen [11, 22, 27, 29]. Um ein realistisches Bild der Wirksamkeit von Aripiprazol-Depot zu erhalten, soll seine Anwendung deshalb hier unter Alltagsbedingungen beobachtet werden.
Ziel
In dieser nichtinterventionellen Studie wurde der Behandlungsverlauf von zuvor mit oralem Aripiprazol behandelten Patienten beobachtet, die unter alltagsnahen Bedingungen mit Aripiprazol-Depot behandelt wurden. Anhand der erhobenen Daten sollten die Ergebnisse der bisherigen randomisierten kontrollierten Studien um Daten aus einem Patientenkollektiv, das der Behandlungswirklichkeit mehr entspricht, ergänzt werden. Die primären Ergebnisse zu Psychopathologie und klinischem Gesamteindruck wurden von [24] berichtet. Hier sollen diese Ergebnisse um weiterführende Analysen ergänzt werden.
Patienten und Methoden
Die Planung, Durchführung und Auswertung dieser Studie (Studiennummer 15 960N) orientierte sich, neben den gesetzlichen Vorgaben entsprechend § 4 Abs. 23 Satz 3 AMG, an den entsprechenden Empfehlungen des BfArM und des Paul-Ehrlich-Instituts sowie den Vorgaben des FSA-Kodex. Vor Beginn der Studie wurde das Votum der Ethikkommission der Universität Freiburg (feki Code 014/1336) eingeholt. Alle Patienten wurden über das Ziel und den Ablauf der nichtinterventionellen Studie aufgeklärt; schriftliche Einverständniserklärungen liegen vor. Die Entscheidung des Arztes, den Patienten mit Aripiprazol-Depot zu behandeln, erfolgte unabhängig von der Teilnahme an der Studie.
Studiendesign
In dieser multizentrischen, prospektiven, nichtinterventionellen Beobachtungsstudie, die an 75 Zentren in Deutschland durchgeführt wurde, wurden Patienten mit Schizophrenie über einen Zeitraum von jeweils 24 Wochen beobachtet (Abb. 1).
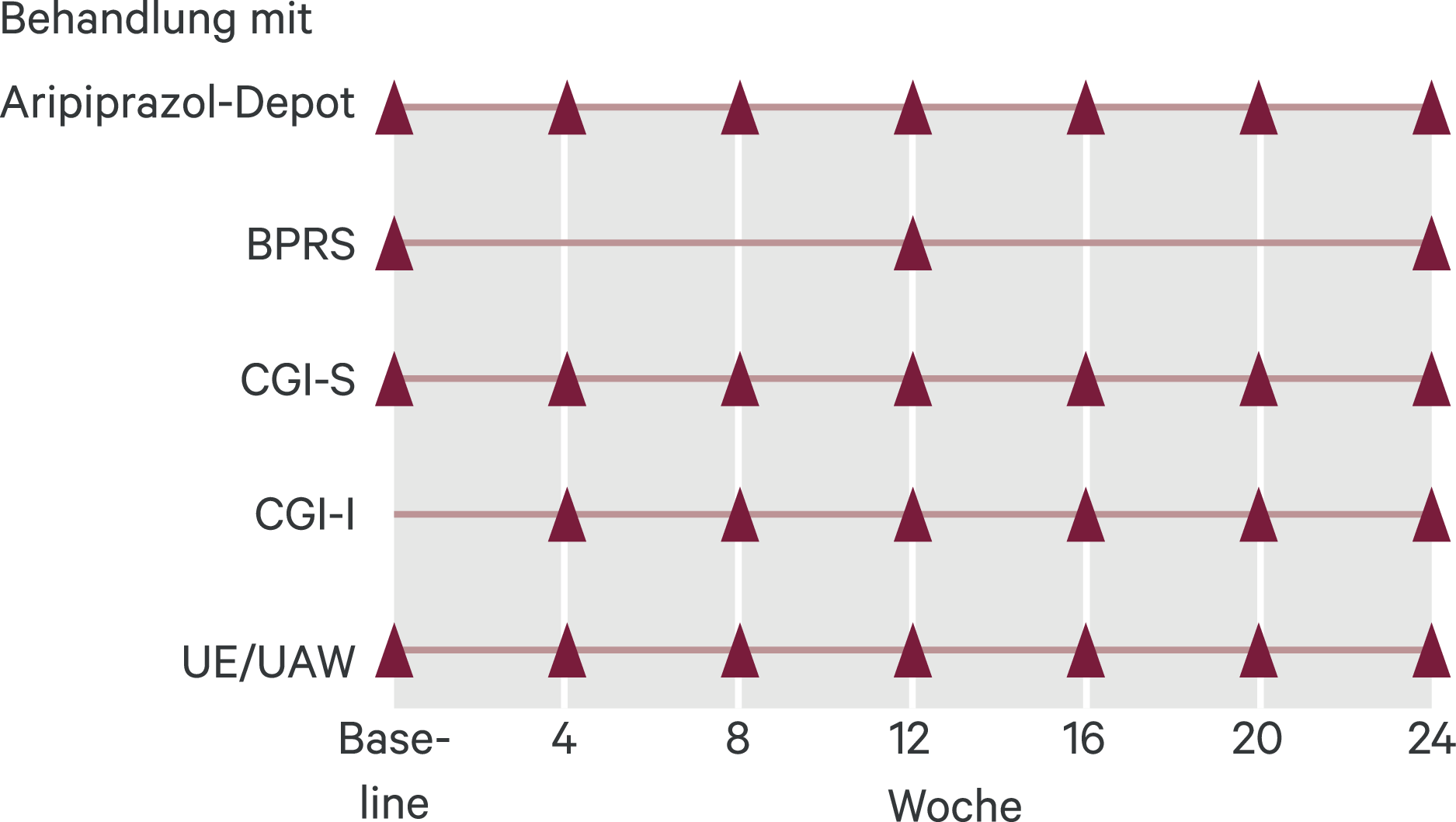
Abb. 1. Studiendesign. Patienten erhielten zu Baseline und zu den weiteren Zeitpunkten Aripiprazol-Depot BPRS: Brief Psychiatric Rating Scale; CGI-S: Clinical Global Impression Scale – Severity; CGI-I: Clinical Global Impression Scale – Improvement; UE/UAW: unerwünschte Ereignisse/unerwünschte Arzneimittelwirkungen. Δ geben den jeweiligen Zeitpunkt der Erhebung an.
Einschlusskriterien
In die Studie konnten ambulant behandelte, volljährige Patienten mit der Diagnose einer Schizophrenie (F20.X nach ICD-10) eingeschlossen werden, bei denen der behandelnde Arzt eine Umstellung auf Aripiprazol-Depot (Anwendung gemäß Fachinformation) als sinnvoll erachtete oder der Patient dies wünschte, wobei über die Behandlung unabhängig von der Studienteilnahme entschieden wurde.
Ausschlusskriterien
Zu den Ausschlusskriterien gehörten neben möglichen Kontraindikationen auch eine geplante oder bestehende Schwangerschaft und Stillen. Des Weiteren wurden Patienten ausgeschlossen, falls ein Abhängigkeitsverhältnis zum Studienpersonal (z. B. Verwandtschaft) bestand oder nach Einschätzung des Arztes ein mangelndes Verständnis der Patienten für die Studie oder Anzeichen für Nichtbefolgung des Beobachtungsplans vorlagen.
Zielvariablen
Primärer Endpunkt. Die Brief Psychiatric Rating Scale (BPRS) [21] umfasst fünf Domänen (Angst/Depression, Anergie, Denkstörung, Aktivierung, Feindseligkeit/Misstrauen) mit insgesamt 18 Einzelitems, die nach der Einschätzung des behandelnden Arztes jeweils von 1 (nicht vorhanden) bis 7 (extrem stark) bewertet werden. Der Gesamtbereich der Skala reicht von 18 bis 126.
Sekundäre Endpunkte. Mit der Clinical Global Impression Scale – Severity [8] wird der Schweregrad der Erkrankung von 1 (überhaupt nicht krank) bis 7 (sehr schwer krank) klassifiziert.
Mittels der Clinical Global Impression Scale – Improvement (CGI-I, klinischer Gesamteindruck – Verbesserung) wird die Veränderung des Schweregrads der Erkrankung gegenüber Baseline von 1 (Zustand ist sehr viel besser) bis 7 (Zustand ist sehr viel schlechter) beurteilt.
Statistische Analyse
Dem Aufbau und der Zielsetzung der Studie entsprechend lag der Schwerpunkt der statistischen Auswertung in der zusammenfassenden und detaillierten Beschreibung der in der Untersuchung erhobenen Daten. Für quantitative Variablen wurden Mittelwert und Standardabweichung (SD) berechnet. Bei nominalen und ordinalen Variablen wurden Häufigkeitszählungen vorgenommen. Fehlende Werte bei mehrfach erhobenen Variablen wurden nach der LOCF-Methode (Last observation carried forward) ergänzt, soweit neben dem Baseline- mindestens ein weiterer Wert vorlag. Statistische Hypothesen wurden nicht formuliert. Für gepaarte Stichproben wurde der Wilcoxon-Vorzeichen-Rang-Test verwendet. Die statistische Signifikanz von Änderungen in der Randverteilung von Kreuztabellen wurde mithilfe des Tests von Bhapkar untersucht. Eine α-Adjustierung erfolgte nicht.
Vordefinierte explorative Subgruppenanalysen wurden stratifiziert nach Alter (≤ 35 vs. > 35 Jahre) und Geschlecht (hier: BPRS) durchgeführt. Weitere explorative Post-hoc-Analysen erfolgten stratifiziert nach Zeit seit Diagnosestellung (≤ 5 vs. > 5 Jahre), Anzahl der Episoden (≤ 5 vs. > 5 und ≤ 3 vs. > 3), Schweregrad der Erkrankung bei Baseline (CGI-S 3–4 vs. 5–7), hinsichtlich des Geschlechts und für ersterkrankte Patienten.
Ergebnisse
Patienten
An der Studie nahmen 243 volljährige Patienten (Tab. 1) teil, von welchen ein Patient aus den Analysen ausgeschlossen wurde, da er kein Aripiprazol-Depot erhalten hatte. Von den 242 Patienten mit der Diagnose einer Schizophrenie nach ICD-10 (F20.0, paranoide Schizophrenie: 202 [83,5 %]; F20.3, undifferenzierte Schizophrenie: 22 [9,1 %]; F20.X sonstige: 18 [7,4 %]) schlossen 227 (93,8 %) die Studie ab; 204 Patienten (84,3 %) nahmen an jeder Visite teil und erhielten alle vorgesehenen Injektionen.
Tab. 1. Patientendisposition
|
Behandelte Patienten [n] |
242 |
|
Geschlecht männlich [n (%)] |
133 (55,0) |
|
Alter [Jahre† (SD)] |
43,1 (15,1) |
|
Alter [n (%)] |
|
|
89 (36,8) |
|
153 (63,2) |
|
Alter bei Auftreten der ersten Episode [Jahre† (SD)] |
29,7 (13,8) |
|
Alter bei Diagnosestellung [Jahre† (SD)] |
30,9 (13,0) |
|
Dauer der unbehandelten Psychose [Jahre (SD)] |
1,2 (8,0) |
|
Zeit seit Diagnosestellung [n (%)]* |
|
|
78 (32,4) |
|
163 (67,6) |
|
Anzahl der schizophrenen Episoden [n (%)]* |
|
|
137 (57,1)/19 (7,9) |
|
103 (42,9) |
|
83 (34,6) |
|
157 (65,4) |
|
BPRS bei Baseline (FAS (LOCF), n = 228) |
54,1 (15,6) |
|
CGI-S bei Studienbeginn [n (%)]* |
|
|
12 (5,0) |
|
79 (32,9) |
|
100 (41,7) |
|
48 (20,0) |
|
1 (0,4) |
† Mittelwert; SD: Standardabweichung, soweit nicht anders angegeben beziehen sich die Daten auf alle eingeschlossenen Patienten; *Erhebung bei Studienbeginn, einzelne Patientendaten fehlen, FAS (LOCF): Full Analysis Set (Last-Observation-Carried-Forward)
Der Zeitraum der Vorbehandlung mit oralem Aripiprazol betrug im Mittel 9,7 Monate (SD 22,3). Neben oralem Aripiprazol erhielten in der Vorbehandlung 141 Patienten (58,3 %) zusätzliche psychotrope Pharmaka, davon 70 Patienten (49,7 % der Patienten mit Zusatzmedikation) Benzodiazepine und 46 Patienten (32,6 %) andere Antipsychotika.
Bei Studienbeginn waren die Patienten nach Einschätzung der behandelnden Ärzte symptomatisch im Mittel seit 5,9 Monaten (SD 18,2) stabil; die häufigsten Dosierungen von oralem Aripiprazol waren 15, 10 bzw. 20 mg/Tag (31,8 %, 29,7 % bzw. 16,1 % der Patienten, n = 236). Neben oralem Aripiprazol erhielten bei Studienbeginn noch 81 Patienten (33,5 %) zusätzliche psychotrope Substanzen, davon 44 Patienten (54,3 % der Patienten mit Zusatzmedikation) Benzodiazepine und 15 Patienten (18,5 %) andere Antipsychotika.
Die Mehrzahl der Patienten war zu Studienbeginn deutlich krank: Der mittlere BPRS-Wert lag bei 54,1 Punkten (±15,6) und 62,1 % der Patienten hatten einen CGI-S-Wert von mindestens 5. Patienten mit einem Alter ≤ 35 Jahren unterschieden sich signifikant von älteren Patienten hinsichtlich ihres Durchschnittsalters (28,8 ± 4,3 vs. 51,3 ± 12,7 Jahre), dem Alter bei Diagnosestellung (23,0 ± 4,3 vs. 35,3 ± 14,2) und der Anzahl der bisherigen Episoden (≤ 5 Episoden: 64 vs. 73 Patienten, > 5 : 24 vs. 79) (p < 0,05), aber nur unwesentlich im Grad der Erkrankung (BPRS, CGI, p > 0,7).
Häufigster Grund für die Umstellung auf Aripiprazol-Depot war die Verbesserung der Adhärenz (48,4 %), gefolgt von guter/besserer Verträglichkeit (16,9 %), Patientenwunsch (13,6 %), besserer/guter Wirkung (12,0 %) und einfacher Handhabung (9,1 %).
Zu Studienbeginn erhielten 79,3 % der Patienten eine Dosis von 400 mg Aripiprazol-Depot, 17,4 % erhielten 300 mg, 2,9 % erhielten 200 mg, und 0,4 % erhielten 160 mg. Die meisten Patienten (132, 54,6 %) erhielten während der gesamten Studiendauer 400 mg Aripiprazol-Depot, 12 Patienten (5,0 %) durchgehend 300 mg. Von den übrigen Patienten erhielten 30,6 % unterschiedliche Dosierungen und 9,9 % beendeten die Behandlung oder wollten sie nicht weiterführen.
Brief Psychiatric Rating Scale (BPRS)
Auf der BPRS verringerte sich der Gesamtscore von Baseline bis Woche 24 signifikant um 13,8 Punkte (SD: 16,0; 95%-Konfidenzintervall [KI]: –15,9 bis –11,7; p < 0,001; Abb. 2). 187 Patienten (82 %) zeigten eine Verbesserung des BPRS-Werts, bei 131 Patienten (57,5 %) lag die Verbesserung bei über 20 % des Ausgangswerts; diese Patienten wurden als Responder gewertet.
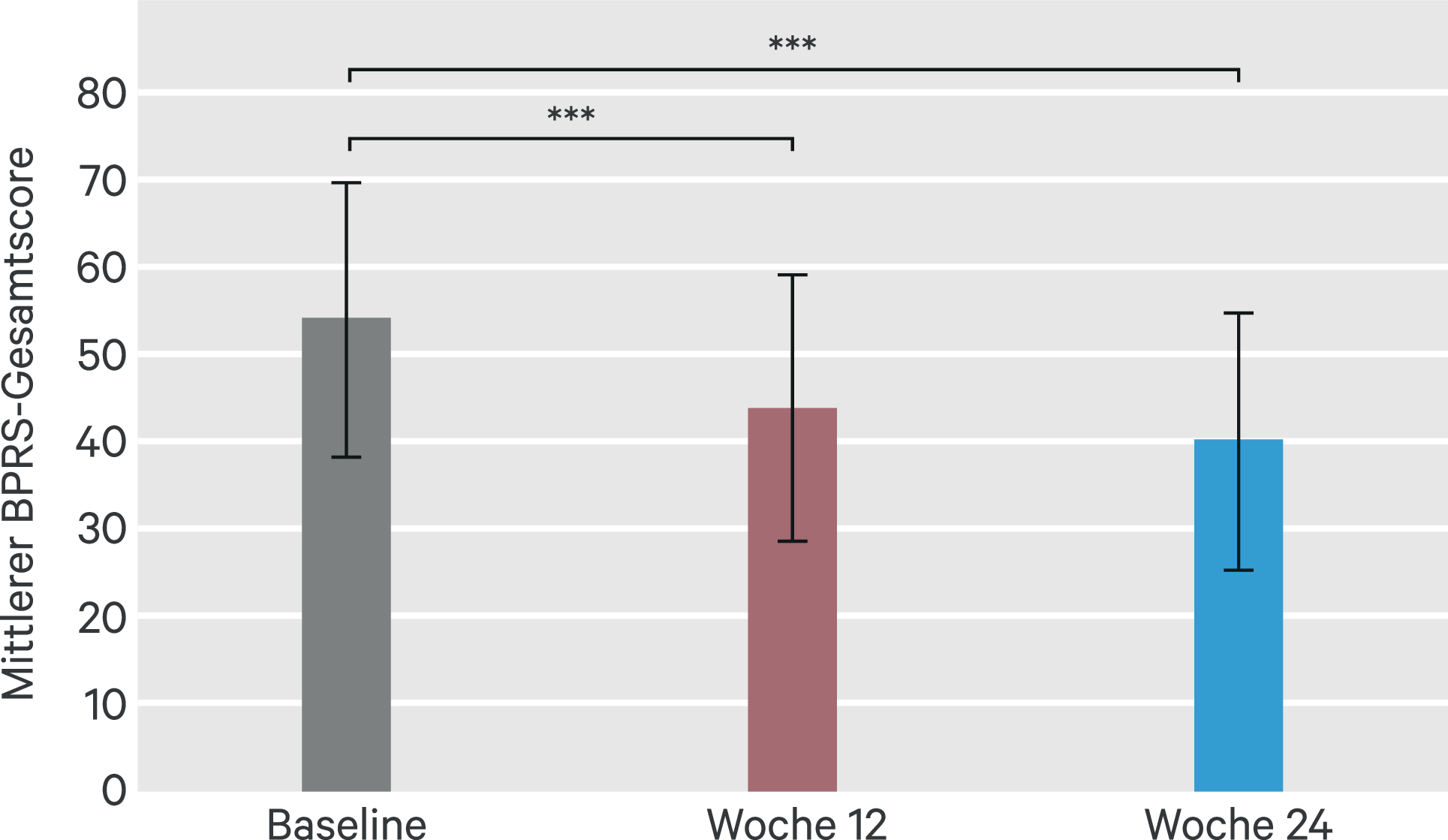
Abb. 2. Brief Psychiatric Rating Scale (BPRS). Dargestellt sind die mittleren Gesamtscores mit Standardabweichungen; *** p < 0,001 gegenüber Baseline; FAS (LOCF)-Auswertung
Die Domänen mit den stärksten Verbesserungen waren Angst/Depression und Aktivierung (Abb. 3): Für den Mittelwert aller Items der Domäne Angst/Depression betrug die Differenz nach 24 Wochen –0,98 (SD 1,21; 95%-KI: –1,14 bis –0,83). Für den Mittelwert aller Items der Domäne Aktivierung betrug die Differenz –0,82 (SD 1,15; 95%-KI: –0,97 bis –0,67).
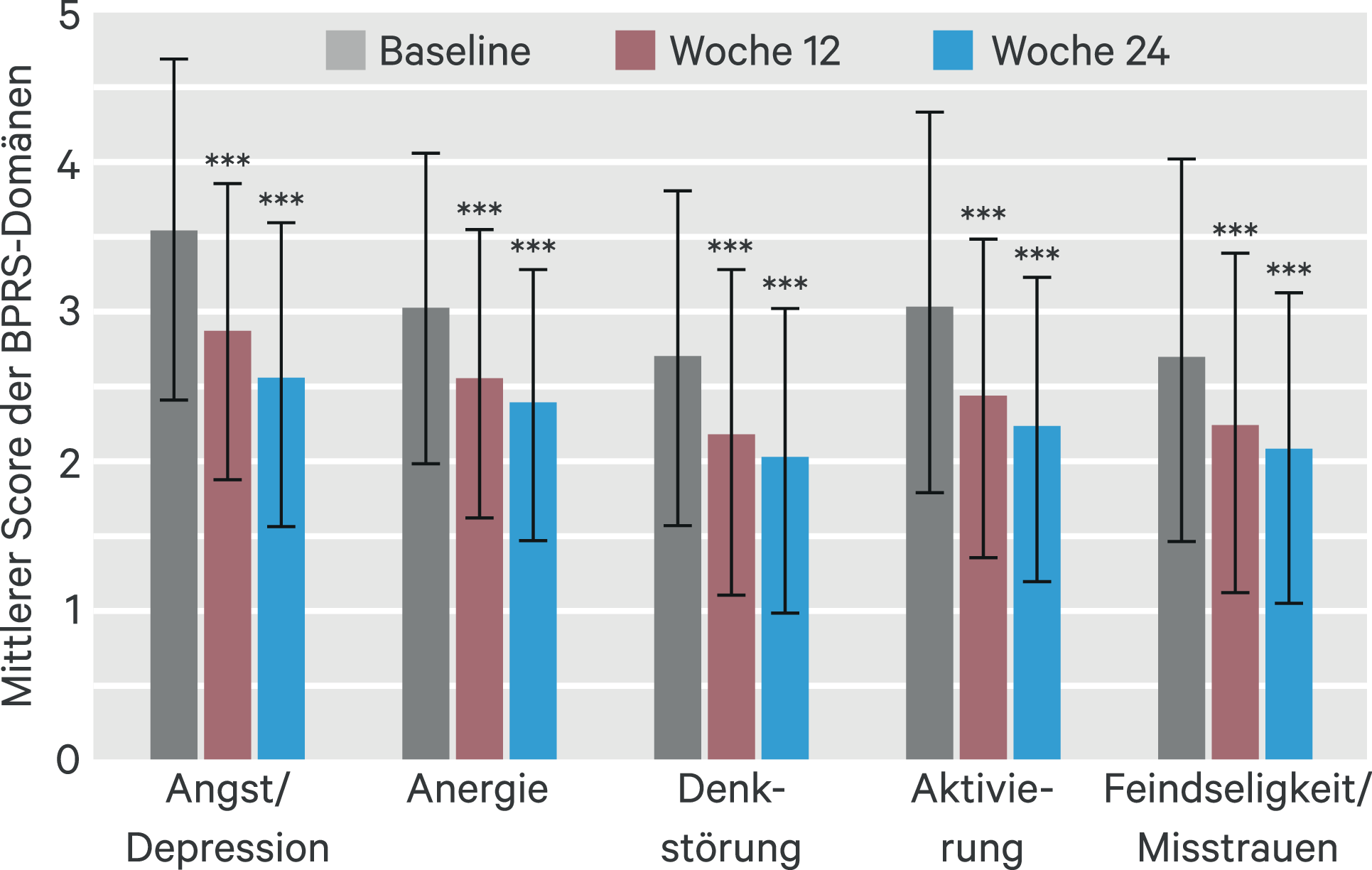
Abb. 3. Brief Psychiatric Rating Scale (BPRS) – Domänen. Dargestellt sind die mittleren Domäne-Scores aller Items, die zur jeweiligen Domäne gehören, mit Standardabweichung; *** p < 0,001 gegenüber Baseline; FAS (LOCF)-Auswertung
Zu Studienbeginn waren die Einzelitems mit den höchsten Werten Ängstlichkeit, somatische Beschwerden und emotionaler Rückzug (im Mittel jeweils 3,9 Punkte, Abb. 4), daneben Spannung und Misstrauen (3,7), sowie depressive Stimmung und Abgestumpftheit (3,6). Die Items mit den größten Verbesserungen im Lauf der Studie waren Spannung, Ängstlichkeit und Misstrauen (jeweils –1,2 Punkte), sowie depressive Stimmung und somatische Beschwerden (–1,0).
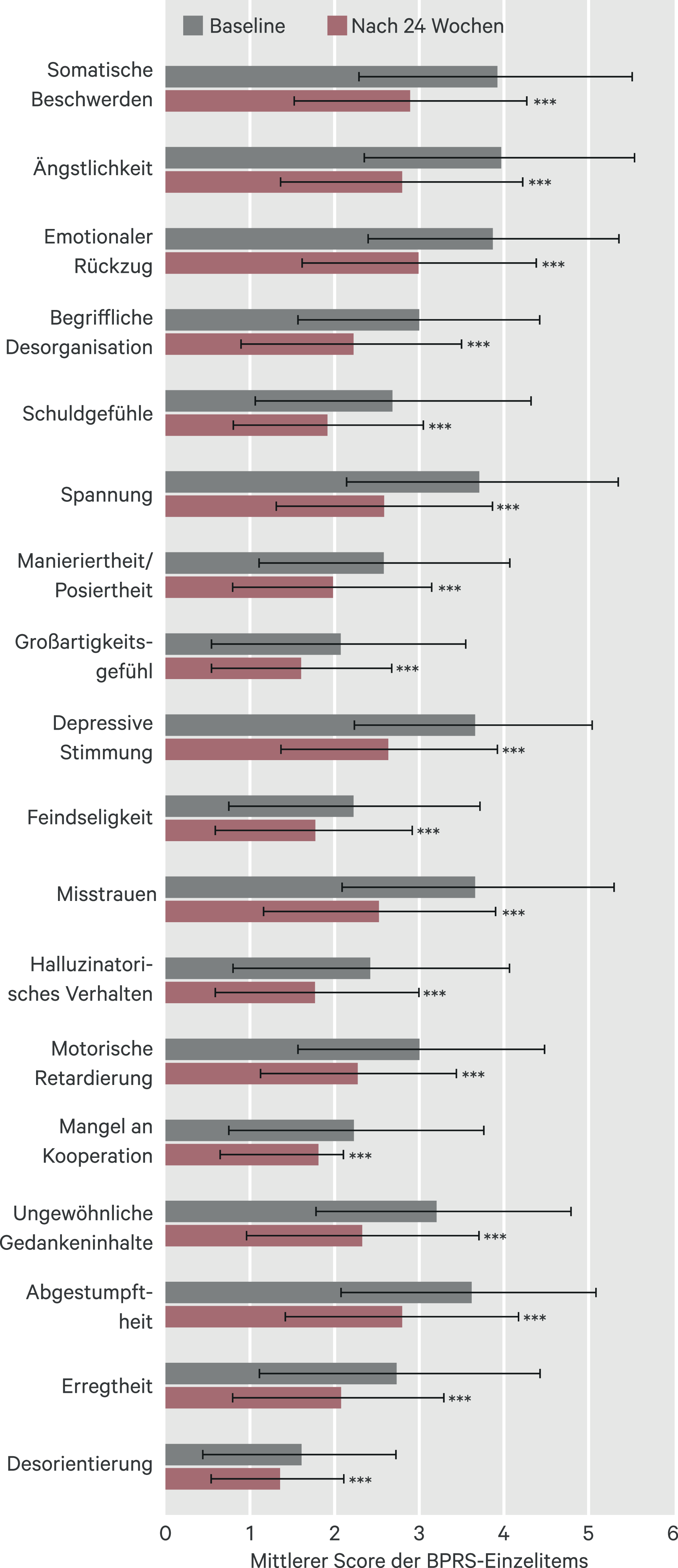
Abb. 4. Brief Psychiatric Rating Scale (BPRS) – Einzelitems. Dargestellt sind die mittleren Scores der Einzelitems mit Standardabweichung; nach 24 Wochen waren alle Einzelitems gegenüber Baseline signifikant gebessert (p < 0,001); FAS (LOCF)-Auswertung
Clinical Global Impression (CGI)
Der mittlere Schweregrad der Erkrankung, gemessen an der CGI-S-Skala, verbesserte sich während des Behandlungszeitraums (Abb. 5). 222 von 235 Patienten (94,5 %, FAS [LOCF]) verbesserten sich während des Behandlungszeitraums oder blieben stabil (82 Patienten, 34,9 %), davon verbesserten sich 83 von 235 Patienten (35,3 %) um 1 und 57 von 235 Patienten (24,3 %) um mindestens zwei Stufen; beides ist als klinisch relevant anzusehen. Die Verbesserung des Schweregrads zeigte sich auch in den CGI-I-Werten: Nach 24 Wochen wurde der Zustand gegenüber Studienbeginn bei 216 von 231 Patienten (93,5 %, n = 231, FAS [LOCF]) als unverändert (39 von 231 Patienten, 16,9 %) oder verbessert bewertet, davon 46 von 231 Patienten als „wenig“, 96 von 231 Patienten als „viel“ und 35 von 231 Patienten als „sehr viel besser“ (19,9 %, 41,6 % bzw. 15,2 %).
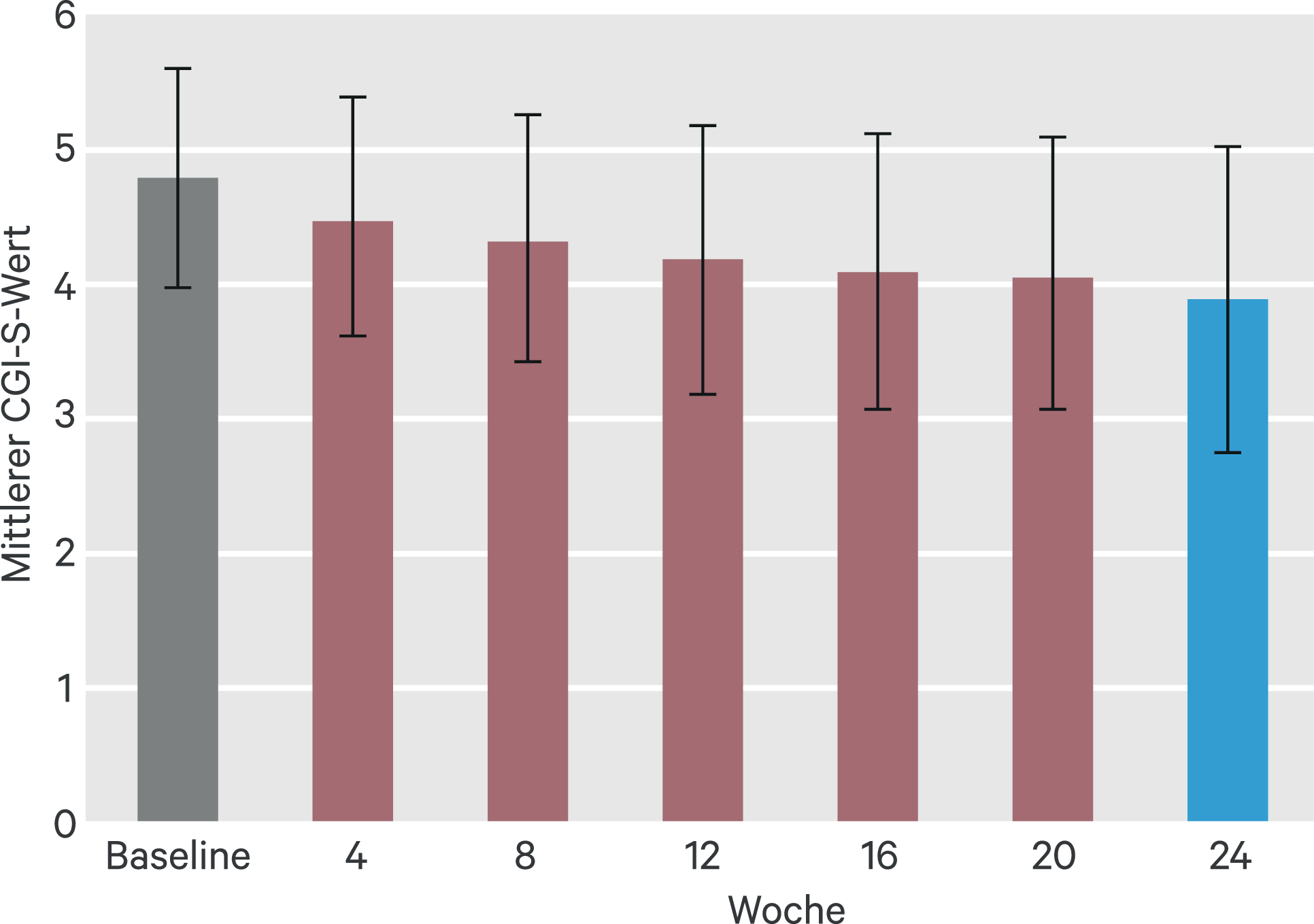
Abb. 5. Clinical Global Impression – Severity (CGI-S). Dargestellt sind die mittleren CGI-S-Werte mit Standardabweichung.
Subgruppen-Analysen
Explorative Analysen sollten klären, ob das Ansprechen auf die Behandlung abhängig ist vom
- Alter der Patienten,
- der Dauer der Erkrankung (Zeit seit Diagnosestellung),
- der Anzahl der Episoden,
- dem Geschlecht des Patienten oder von
- dem Schweregrad der Erkrankung zu Beginn.
Die Ergebnisse sind in Tabelle 2 zusammengefasst.
Tab. 2. Veränderung des Gesamtscores der Brief Psychiatric Rating Scale (BPRS) und des klinischen Gesamteindrucks des Schweregrades (Clinical Global Impression – Severity, CGI-S) für unterschiedliche Subgruppen (n = 240–242)
|
Stratifizierung |
Anzahl der Patienten [n (%)] |
BPRS: Mittelwert (SD) bei Studienbeginn (FAS (LOCF)-Population) |
BPRS: Änderung nach 24 Wochen vs. Studienbeginn (SD) |
CGI-S: Verbesserung nach 24 Wochen vs. Studienbeginn [n (%)] |
||
|
1 Stufe |
≥ 2 Stufen |
|||||
|
Alter |
≤ 35 Jahre |
89 (36,8) |
54,3 (15,4) |
–17,2 (17,6) |
31 (36,1) |
29 (33,7) |
|
> 35 Jahre |
153 (63,2) |
53,9 (15,7) |
–11,9 (14,6) |
52 (34,9) |
28 (18,8) |
|
|
Zeit seit Diagnosestellung* |
≤ 5 Jahre |
78 (32,4) |
54,9 (13,9) |
–15,2 (17,1) |
27 (36,0) |
21 (28,0) |
|
> 5 Jahre |
163 (67,6) |
53,7 (16,4) |
–13,1 (15,4) |
56 (35,0) |
36 (22,5) |
|
|
Anzahl Episoden bisher* |
≤ 5 Episoden |
137 (57,1) |
52,4 (15,3) |
–15,0 (16,3) |
44 (32,8) |
36 (26,9) |
|
> 5 Episoden |
103 (42,9) |
56,1 (15,8) |
–12,1 (15,5) |
38 (38,0) |
21 (21,0) |
|
|
Anzahl Episoden bisher* |
≤ 3 Episoden |
83 (34,6) |
49,6 (14,9) |
–12,8 (14,7) |
25 (30,9) |
19 (23,5) |
|
> 3 Episoden |
157 (65,4) |
56,4 (15,5) |
–14,3 (16,6) |
57 (37,3) |
38 (24,8) |
|
|
Geschlecht |
Weiblich |
109 (45,0) |
56,4 (15,6) |
–15,7 (15,5) |
43 (40,6) |
23 (21,7) |
|
Männlich |
133 (55,0) |
52,2 (15,3) |
–12,2 (16,2) |
40 (31,0) |
34 (26,4) |
|
|
Schweregrad zu Studienbeginn* |
Leicht-mäßig krank (CGI-S 3–4) |
91 (37,9) |
44,6 (12,3) |
–8,9 (13,1) |
35 (39,3) |
5 (5,6) |
|
Deutlich-sehr schwer krank (CGI-S 5–7) |
149 (62,1) |
59,8 (14,6) |
–16,8 (16,8) |
48 (32,9) |
52 (35,6) |
|
SD: Standardabweichung, *Erhebung bei Studienbeginn, einzelne Patientendaten fehlend, FAS (LOCF): Full Analysis Set (Last-Observation-Carried-Forward)
Die Ergebnisse zeigen, dass jüngere Patienten (≤ 35 Jahre) von der Behandlung deutlicher profitieren als ältere Patienten (> 35 Jahre), und zwar sowohl hinsichtlich des BPRS-Gesamtscores (–17,2 vs. –11,9) als auch hinsichtlich des Anteils der Patienten, die sich um mindestens zwei Stufen auf der CGI-S-Skala verbesserten (33,7 vs. 18,8 %). Deutliche Unterschiede ergaben sich auch hinsichtlich des Schweregrads der Erkrankung: Patienten mit einem CGI-S-Wert von 5 bis 7 zu Studienbeginn zeigten eine stärkere Verbesserung des BPRS-Gesamtscores gegenüber leichter erkrankten Patienten (–16,8 vs. –8,9) und ein größerer Anteil verbesserte sich um mindestens zwei Stufen auf der CGI-S-Skala (35,6 vs. 5,6 %, Tab. 2). Es wurde außerdem analysiert, ob sich ein Unterschied zwischen neu erkrankten Patienten (mit erster Episode) und dem Rest des Kollektivs zeigen würde. Hierbei fiel auf, dass die 19 neu erkrankten Patienten (7,9 % aller Patienten) beim Auftreten dieser ersten Episode im Schnitt bereits 39,7 (±22,5) Jahre alt waren, gegenüber einem Durchschnittsalter von 28,7 (±12,5) Jahren beim Auftreten der ersten Episode im Rest des Patientenkollektivs (p = 0,048, t-Test). Ansonsten gab es keine statistisch signifikanten Unterschiede zwischen den untersuchten Subgruppen was das Ansprechen auf die Behandlung betraf.
Sicherheit und Verträglichkeit
Während der Studie wurden insgesamt 153 unerwünschte Ereignisse bei 102 Patienten (42,2 %) berichtet und entsprechend MedDRA 19.0 kodiert. 133 dieser Ereignisse (96 Patienten, 39,7 %) wurden als wahrscheinlich oder möglicherweise behandlungsbedingte Nebenwirkungen eingestuft. Das häufigste Ereignis fiel unter die Kategorie „Medikationsfehler/Fehlanwendung“; meist wurde orales Aripiprazol früher als empfohlen (2 Wochen nach Beginn der ersten Injektion gemäß Fachinformation) abgesetzt (Tab. 3).
Tab. 3. Nebenwirkungen
|
Nebenwirkungen |
[n (%)] |
|
Alle unerwünschten Ereignisse |
153 (42,2) |
|
Nebenwirkungena |
133 (39,7) |
|
Nebenwirkung, die bei mind. 2 % der Patienten auftrat |
|
|
Unangebrachter Zeitpunkt der Medikamenteneinnahmeb |
60 (24,8) |
|
Mangelnde Wirksamkeit |
8 (3,3) |
|
Off-Label-Use |
5 (2,1) |
|
Weitere Nebenwirkungen von klinischem Interesse |
|
|
Nebenwirkungen im Zusammenhang mit extrapyramidalen Symptomen (zusammengefasst) |
7 (2,9) |
|
1 (0,4) |
|
0 (0) |
|
1 (0,4) |
|
0 (0) |
|
1 (0,4) |
|
2 (0,8) |
|
1 (0,4) |
|
1 (0,4) |
|
Nebenwirkungen im Zusammenhang mit Gewichtsveränderungen (zusammengefasst) |
1 (0,4) |
|
1 (0,4) |
|
0 (0) |
a Nebenwirkungen waren definiert als unerwünschte Ereignisse, die nach Einschätzung des Arztes wahrscheinlich oder möglicherweise mit der Medikation in Zusammenhang stehen.
b In den meisten Fällen wurde orales Aripiprazol früher abgesetzt als in der Fachinformation empfohlen.
Die Nebenwirkungen (> 1 % der Patienten, Mehrfachnennungen möglich) wurden nach MedDRA 19.0 folgenden Organklassen zugeordnet: Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen: 69 Patienten (28,5 %), psychiatrische Erkrankungen: 23 Patienten (9,5 %), allgemeine Erkrankungen und Beschwerden am Verabreichungsort: 19 Patienten (7,9 %), Erkrankungen des Nervensystems und Erkrankungen des Gastrointestinaltrakts: jeweils 5 Patienten (2,1 %), sowie Erkrankungen der Haut und des Unterhautzellgewebes: 3 Patienten (1,2 %).
Fortführung von Aripiprazol-Depot
Nach Beendigung der Studie gaben 200 Patienten (89,3 %, n = 224) an, dass sie die Therapie mit Aripiprazol-Depot fortführen wollten. 24 Patienten (10,7 %) wollten dies nicht; häufigste Gründe (inklusive einmaliger Nennung zweier Gründe) waren der Wunsch des Patienten (9/4,0 %), mangelnde Effektivität (7/3,1 %) und Nebenwirkungen (7/3,1 %, jeweils bezogen auf 224 Patienten mit Angaben).
Diskussion
Die Wirksamkeit von Aripiprazol-Depot wurde in randomisierten, kontrollierten Studien dokumentiert [7, 10, 18]. Die hier vorgestellte prospektive, nichtinterventionelle Studie soll dazu dienen, die Wirksamkeit von Aripiprazol-Depot in einem naturalistischen Setting mit einer heterogenen und nach Vorbehandlung mit oralem Aripiprazol stabilisierten Patientenpopulation zu untersuchen.
Während der sechsmonatigen Beobachtungsdauer verbesserten sich bei den Patienten die Psychopathologie (gemessen an der BPRS) und die Krankheitsschwere (CGI-S) signifikant. Die BPRS-Gesamtscores waren bereits nach 12 Wochen signifikant verbessert (p < 0,001) mit weiteren signifikanten Verbesserungen bis Woche 24 (p < 0,001). Insgesamt scheint es, dass Negativsymptome wie emotionaler Rückzug, oder solche Symptome, die zu sekundären Negativsymptomen führen, wie Ängstlichkeit und Depression, zu Beginn besonders stark waren und auch besonders gut auf die Behandlung angesprochen haben, was möglicherweise zu dem allgemein günstigen Ergebnis beigetragen hat. Die besondere Gruppe der Patienten mit persistierenden Negativsymptomen wurde in einer anderen Studie von Nemeth und Kollegen näher untersucht [20, 31].
Auch die CGI-S-Werte nahmen während der Studie signifikant ab. Insgesamt sprechen diese Ergebnisse für eine gute Wirksamkeit von Aripiprazol-Depot.
In einer explorativen Subgruppenanalyse wurde nach Alter der Patienten, Dauer der Erkrankung, Anzahl der Krankheitsepisoden, Geschlecht und Schweregrad der Erkrankung bei Baseline stratifiziert. Die meisten Verbesserungen in den gemessenen Scores waren besonders ausgeprägt bei jüngeren Patienten bis 35 Jahren, bei Patienten mit kürzerer Krankheitsdauer bis fünf Jahre und bei Patienten mit fünf oder weniger Episoden. Die Ergebnisse verdeutlichen, dass gerade junge Patienten in einer frühen Phase einer Schizophrenie-Spektrum-Störung von einer kontinuierlichen Therapie profitieren. Eine gezielte frühe pharmakotherapeutische Intervention, die eingebettet in ein multimodales Setting sein sollte, kann dazu beitragen, die Patienten vor einer chronischen Verschlechterung ihres Zustands, wie er nach mehreren Episoden häufig vorkommt, zu schützen [3–5, 12, 26, 28]. Bei Patienten mit fünf oder weniger Episoden wurden größere Verbesserungen gefunden als bei Patienten mit mehr Episoden, allerdings waren die Verbesserungen bei Patienten mit bis zu drei Episoden weniger ausgeprägt als bei Patienten mit mehr als drei Episoden. Ein besonderer Nutzen einer Behandlung mit Aripiprazol-Depot für jüngere Patienten wurde auch in der QUALIFY-Studie festgestellt [18]: Die Lebensqualität verbesserte sich besonders stark bei Patienten bis 35 Jahren, wie eine explorative, vordefinierte Subgruppenanalyse ergab, die allerdings aufgrund der verringerten Datenbasis eine verminderte statistische Aussagekraft hatte. Hier vermuteten die Autoren, dass die Unterschiede möglicherweise auch auf die Wirkungsweise von Aripiprazol als Partialagonist am Dopamin-D2-Rezeptor zurückzuführen sind und die Atypika keine homogene Gruppe darstellen [16, 18, 19]. Die unterschiedlichen Nebenwirkungen, die in der Langzeittherapie durch die Behandlung mit Partialagonisten und Antagonisten entstehen können, beeinflussen möglicherweise die Lebensqualität der Patienten [14, 15, 19]. Daher sollte das Nebenwirkungsprofil von Anfang an in der Behandlung berücksichtigt werden um die Lebensqualität nicht zusätzlich negativ zu beeinflussen [1].Frauen hatten auf der BPRS-Skala numerisch höhere Anfangswerte, erreichten aber auch numerisch stärkere Verbesserungen als Männer. Auf den CGI-Skalen gab es keine Unterschiede zwischen den Geschlechtern. Dies spricht dafür, dass beide Geschlechter gleichermaßen auf eine Behandlung mit Aripiprazol-Depot ansprechen.
Patienten, die zu Baseline stärker erkrankt waren, hatten größere Verbesserungen zu verzeichnen als weniger kranke Patienten. Insgesamt haben kränkere Patienten mehr Potenzial zur Verbesserung, was diese Unterschiede erklären könnte. In einer anderen Real-World-Studie zu Aripiprazol-Depot hingegen war die Abbruchrate unter schwerer kranken Patienten höher als unter leicht erkrankten, war aber insgesamt mit 13,8 % ähnlich niedrig wie in der hier vorliegenden Studie (6,2 % Studienabbrecher und 10,7 % mit der Angabe, Aripiprazol-Depot nach der Studie nicht fortführen zu wollen) [6]. Hervorzuheben ist hier vor allem, dass auch schwer erkrankte Patienten von Aripiprazol-Depot profitieren.
Der Zustand der Patienten verbesserte sich signifikant unter Aripiprazol-Depot, obwohl die Patienten in dieser Studie bereits mit oralem Aripiprazol vorbehandelt waren, mit einer durchschnittlichen Behandlungsdauer von 9,7 Monaten. Dadurch waren die Patienten im Schnitt bereits 5,9 Monate stabil. Dennoch hatte die Einstellung auf Depotmedikation weitere signifikante Verbesserungen der Psychopathologie und Krankheitsschwere zur Folge.
Während der sechsmonatigen Beobachtungszeit war die häufigste Nebenwirkung das vorzeitige Absetzen des oralen Aripiprazols, das nach der ersten Depot-Gabe für 14 Tage weiter eingenommen werden soll, um die therapeutische Aripiprazol-Konzentration aufrecht zu erhalten. Die geringe Nebenwirkungsrate in dieser Studie – insbesondere waren Nebenwirkungen im Zusammenhang mit extrapyramidalen Symptomen und Gewichtsveränderungen selten – kann darin begründet sein, dass die Patienten bereits mit oralem Aripiprazol vorbehandelt waren. Insgesamt können Nebenwirkungen einen wichtigen Grund für Nichtadhärenz darstellen [30], weshalb die Wahl einer nebenwirkungsarmen Therapie wichtig für den Behandlungserfolg ist.
Die Patienten, die in diese Studie eingeschlossen wurden, sind nicht so stark selektiert wie es in randomisierten, kontrollierten Studien der Fall ist, weshalb auch Patienten mit mehreren Begleiterkrankungen, Komedikationen und anderen Risikofaktoren eingeschlossen wurden. Unsere Daten zeigen, dass Aripiprazol-Depot auch bei diesen Patienten wirksam ist.
Aufgrund des naturalistischen, nichtinterventionellen Designs weist diese Studie einige Einschränkungen auf. Es gibt keine Vergleichsgruppe, es besteht das Risiko einer Verzerrung durch Selektion (Patienten mit Bereitschaft zur Depotanwendung; Bewusstsein, an einer Studie teilzunehmen) und die Patienten waren nicht randomisiert, sodass Störfaktoren weder erkannt noch ausgeschlossen werden können. Dennoch stellen Beobachtungsstudien wie diese eine wichtige Ergänzung zu randomisierten, kontrollierten Studien dar, da in solchen Studien die Patientenpopulation stärker selektiert sind [9, 13].
Schlussfolgerungen
Nach vorangegangener Stabilisierung der Patienten verbessert sich nach Umstellung der Behandlung auf Aripiprazol-Depot der Zustand der Patienten weiter über mindestens sechs Monate.
Die Befunde dieser nichtinterventionellen Studie bestätigen die Ergebnisse der kontrollierten Zulassungsstudien auch unter Alltagsbedingungen in der klinischen Praxis. Ambulante Patienten profitieren von der Behandlung mit Aripiprazol-Depot.
Danksagung
Die Autoren bedanken sich bei den teilnehmenden Studienzentren und Patienten sowie deren Familien und Bezugspersonen. Wir bedanken uns auch bei Sandra Höpfert und der Anfomed GmbH für die Durchführung der Studie sowie bei Kathrin Lemme (Lundbeck GmbH) und Philipp Bauknecht (Dr. Carl GmbH) für ihre Unterstützung.
Interessenkonflikterklärung
Daniel Schöttle erhielt Vortragshonorare und Unterstützungen für Kongressbesuche von Lundbeck, Otsuka und Shire, Klaus Wiedemann von Janssen, Lundbeck und Otsuka. Christoph U. Corell erhielt Vortragshonorare von Alkermes, Allergan, Angelini, Boehringer-Ingelheim, Gedeon Richter, Gerson Lehrman Group, Indivior, IntraCellular Therapies, Janssen/J&J, LB Pharma, Lundbeck, MedAvante-ProPhase, Medscape, Merck, Neurocrine, Noven, Otsuka, Pfizer, Recordati, Rovi, Servier, Sumitomo Dainippon, Sunovion, Supernus, Takeda und Teva, sowie Drittmittel von Janssen und Takeda. Wolfgang Janetzky ist Mitarbeiter der Lundbeck GmbH, Elmar Beck der mit der Studiendurchführung beauftragten Anfomed GmbH.
Literatur
1. Bodatsch M, Kuhn J. Differenzialindikation medikamentöser Erhaltungstherapie in der Schizophrenie-Behandlung. Psychopharmakotherapie 2016;23:50–7.
2. Bridges JF, Beusterien K, Heres S, Such P, et al. Quantifying the treatment goals of people recently diagnosed with schizophrenia using best-worst scaling. Patient Prefer Adherence 2018;12:63–70.
3. Correll CU, Galling B, Pawar A, Krivko A, et al. Comparison of early intervention services vs treatment as usual for early-phase psychosis: A systematic review, meta-analysis, and meta-regression. JAMA Psychiatry 2018;75:555–65.
4. de Millas W, Stelzig M, Janetzky W, Wietfeld R. Phasengerechte Behandlung der Schizophrenie: Stellenwert der ambulanten Versorgung beim niedergelassenen Psychiater. Psychopharmakotherapie 2018;25:161–8.
5. Emsley R, Chiliza B, Asmal L. The evidence for illness progression after relapse in schizophrenia. Schizophr Res 2013;148:117–21.
6. Fagiolini A, Aguglia E, Ballerini A, Callista G, et al. Real-world effectiveness of long acting aripiprazole: Treatment persistence and its correlates in the Italian clinical practice. Psychiatry Res 2019;272:698–706.
7. Fleischhacker WW, Sanchez R, Perry PP, Jin N, et al. Aripiprazole once-monthly for treatment of schizophrenia: double-blind, randomised, non-inferiority study. Br J Psychiatry 2014;205:135–44.
8. Guy W. ECDEU Assessment Manual for Psychopharmacology – Revised (DHEW Publ No ADM 76–338). Rockville, MD: U.S. Department of Health, Education, and Welfare, Public Health Service, Alcohol, Drug Abuse, and Mental Health Administration, NIMH Psychopharmacology Research Branch, Division of Extramural Research Programs; 1976.
9. Haddad PM, Tiihonen J, Haukka J, Taylor M, et al. The place of observational studies in assessing the effectiveness of depot antipsychotics. Schizophr Res 2011;131:260–1.
10. Kane JM, Sanchez R, Perry PP, Jin N, et al. Aripiprazole intramuscular depot as maintenance treatment in patients with schizophrenia: a 52-week, multicenter, randomized, double-blind, placebo-controlled study. J Clin Psychiatry 2012;73:617–24.
11. Kishimoto T, Nitta M, Borenstein M, Kane JM, et al. Long-acting injectable versus oral antipsychotics in schizophrenia: a systematic review and meta-analysis of mirror-image studies. J Clin Psychiatry 2013;74:957–65.
12. Leopold K, Zarafonitis-Müller S, Burkhard E, Laier S, et al. Frühdiagnostik und -behandlung der Schizophrenie. Psychopharmakotherapie 2016;23:41–9.
13. Leucht C, Heres S, Kane JM, Kissling W, et al. Oral versus depot antipsychotic drugs for schizophrenia – a critical systematic review and meta-analysis of randomised long-term trials. Schizophr Res 2011;127:83–92.
14. Leucht S, Davis JM. Second-generation antipsychotics and quality of life in schizophrenia. Lancet Psychiatry 2016;3:694–5.
15. Leucht S, Leucht C, Huhn M, Chaimani A, et al. Sixty years of placebo-controlled antipsychotic drug trials in acute schizophrenia: Systematic review, Bayesian meta-analysis, and meta-regression of efficacy predictors. Am J Psychiatry 2017;174:927–42.
16. Müller WE. Therapeutische Anwendung von Aripiprazol-Depot: Pharmakologische und pharmakokinetische Grundlagen. Psychopharmakotherapie 2014;21:97–105.
17. Naber D, Baker RA, Eramo A, Forray C, et al. Long-term effectiveness of aripiprazole once-monthly for schizophrenia is maintained in the QUALIFY extension study. Schizophr Res 2018;192:205–10.
18. Naber D, Hansen K, Forray C, Baker RA, et al. Qualify: a randomized head-to-head study of aripiprazole once-monthly and paliperidone palmitate in the treatment of schizophrenia. Schizophr Res 2015;168:498–504.
19. Naber D, Kuhn J, Leopold K, Janetzky W, et al. Beeinflussung der Lebensqualität und Funktionalität unter der Therapie mit atypischen Depot-Antipsychotika. Psychopharmakotherapie 2018;25:286–91.
20. Németh G, Laszlovszky I, Czobor P, Szalai E, et al. Cariprazine versus risperidone monotherapy for treatment of predominant negative symptoms in patients with schizophrenia: a randomised, double-blind, controlled trial. Lancet 2017;389:1103–13.
21. Overall JE, Gorham DR. The brief psychiatric rating scale. Psychol Rep 1962;10:799–812.
22. Potempa C, Rychlik R. Hospitalization rates and resource utilization of schizophrenic patients switched from oral antipsychotics to aripiprazole-depot in Germany. Health Econ Rev 2018;8:30.
23. Potkin SG, Loze J-Y, Forray C, Baker RA, et al. Relationship between response to aripiprazole once-monthly and paliperidone palmitate on work readiness and functioning in schizophrenia: A post-hoc analysis of the QUALIFY study. PLoS One 2017;12:e0183475.
24. Schöttle D, Janetzky W, Luedecke D, Beck E, et al. Effectiveness of aripiprazole once-monthly in schizophrenia patients pretreated with oral aripiprazole: a 6-month, real-life non-interventional study. BMC Psychiatry 2018;18:365.
25. Spittler S. Klinische Daten und Erfahrungen mit Aripiprazol-Depot in der Therapie der Schizophrenie. Psychopharmakotherapie 2014;21:106–11.
26. Stahl SM. Long-acting injectable antipsychotics: shall the last be first? CNS Spectr 2014;19:3–5.
27. Taipale H, Mittendorfer-Rutz E, Alexanderson K, Majak M, et al. Antipsychotics and mortality in a nationwide cohort of 29,823 patients with schizophrenia. Schizophr Res 2017 Dec 20; pii: S0920–9964(17)30762–4.
28. Tiihonen J, Haukka J, Taylor M, Haddad PM, et al. A nationwide cohort study of oral and depot antipsychotics after first hospitalization for schizophrenia. Am J Psychiatry 2011;168:603–9.
29. Tiihonen J, Mittendorfer-Rutz E, Majak M, Mehtälä J, et al. Real-world effectiveness of antipsychotic treatments in a nationwide cohort of 29,823 patients with schizophrenia. JAMA Psychiatry 2017;74:686–93.
30. Velligan DI, Sajatovic M, Hatch A, Kramata P, et al. Why do psychiatric patients stop antipsychotic medication? A systematic review of reasons for nonadherence to medication in patients with serious mental illness. Patient Prefer Adherence 2017;11:449–68.
31. Wagner E, Hasan A. Cariprazin – eine neue medikamentöse Therapieoption in der Schizophreniebehandlung. Psychopharmakotherapie 2018;25:278–85.
Priv.-Doz. Dr. med. Daniel Schöttle, Klinik und Poliklinik für Psychiatrie und Psychotherapie, UKE Hamburg, Martinistraße 52, 20246 Hamburg, E-Mail: d.schoettle@uke.de
Dr. rer. nat. Wolfgang Janetzky, Lundbeck GmbH, Hamburg
Elmar Beck, ANFOMED GmbH, Möhrendorf
Prof. Dr. med. Christoph U. Correll, Klinik für Psychiatrie, Psychosomatik und Psychotherapie des Kindes- und Jugendalters, Charité Universitätsmedizin, Berlin; Department of Psychiatry, The Zucker Hillside Hospital and Zucker School of Medicine at Hofstra/Northwell, New York, USA
Prof. Dr. med. Klaus Wiedemann, Klinik und Poliklinik für Psychiatrie und Psychotherapie, UKE Hamburg
Non-interventional study on the effectiveness of aripiprazole once-monthly in patients with schizophrenia under routine conditions in Germany
During this non-interventional study, the treatment of schizophrenia patients after switching to aripiprazole once-monthly was investigated. The collected data complement efficacy data from randomized controlled trials with results from a naturalistic treatment setting.
In this multicenter, prospective study, 242 patients, who had been treated for a mean of 9.7 months with oral aripiprazole, were followed for 6 months after switching to aripiprazole once-monthly (AOM). Efficacy endpoints included ratings of psychopathology (Brief Psychiatric Rating Scale, BPRS) and illness severity (Clinical Global Impression, CGI).
At AOM treatment start, most patients were still considerably ill: The BPRS global score was 54.1 points (±15.6) on average, and most of the patients (95 %) had a CGI-S-Score of 4 or higher. Altogether, 93.8 % completed the 6-month observational study, and 84.3 % came to every visit and got their treatment. During the 6-month treatment with AOM, psychopathology improved significantly with a decrease in BPRS global score of 13.8 points (±16.0). Illness severity decreased significantly with a shift of CGI-S-Scores to lower values. Subgroup analyses showed that the improvements were more prominent in younger patients, patients with shorter illness duration, patients with less episodes and patients more severely affected at study start. The most common adverse effect was classified as inappropriate schedule of drug administration, and in most cases oral aripiprazole had been discontinued earlier than recommended (< 2 weeks of the recommended concomitant treatment after first injection). Six patients (2.5 %) discontinued or choose not to continue after the end of the study due to adverse events.
The study data clearly show the positive effects of aripiprazole once-monthly in a naturalistic setting and confirm available data from controlled studies.
Key words: Non-interventional, aripiprazole once-monthly, long-acting injectable, naturalistic, partial agonist
Psychopharmakotherapie 2019; 26(04):219-226
