Matthias Dose, Taufkirchen, und Karin Gawora, Marburg
Die als Spätdyskinesien oder tardive Dyskinesien bezeichneten abnormen, unwillkürlichen Bewegungen nach einer längerfristigen Behandlung mit Dopamin-antagonistisch wirkenden Neuroleptika (Antipsychotika) stellen auch nach Einführung neuerer („atypischer“) Substanzen eine ernsthafte Komplikation ihrer Langzeitanwendung dar [2]. Als Risikofaktoren gelten die Affinität der Substanzen zu Dopamin-D2-Rezeptoren, ihr Rezeptorprofil, die Höhe der sogenannten kumulativen Gesamtdosis, Alter und Geschlecht der Patienten. „Maskierte“ Spätdyskinesien (auch „Absetzdyskinesien“) können bei Dosisreduktion oder nach dem Absetzen von Neuroleptika erstmalig auftreten.
Das Krankheitsbild ist durch vigilanz- bzw. belastungsabhängige abnorme, unwillkürliche, nicht zweckgebundene Bewegungen charakterisiert. Im Rahmen eines orobukkolingualen (bzw. mastikatorischen) Syndroms kommt es zu kauenden, schmatzenden und/oder grimassierenden Bewegungen im Mund-, Kiefer- und Zungenbereich. Bei schweren Formen kann es zu dystonen Zungenprotrusionen oder dem repetitiven, chamäleonartigen Hervorschnellen der Zunge kommen („fly catchers tongue“). Neuroleptisch bedingte Spätdyskinesien manifestieren sich sehr häufig orobukkolingual betont. Im weiteren Verlauf können dann abnorme, unwillkürliche Rotationsbewegungen im Bereich des Halses und der Hüften („rocking chair“), aber auch Extensions- und Flexionsbewegungen der Finger und athetotisch oder choreatiform anmutende Hyperkinesen im Bereich der oberen und unteren Extremitäten auftreten. Die unwillkürlich auftretenden, nicht kontrollierbaren Bewegungsstörungen haben starke Auswirkungen auf die Lebensqualität der Patienten und können eine Vielzahl von Alltagsaktivitäten einschränken, beispielsweise die Kommunikation (dysarthrische Sprachstörungen), Nahrungsaufnahme (erschwertes Führen der Nahrung zum Mund, Kauen, Schlucken) und Körperhygiene (Probleme beim Waschen und Umkleiden). Für Patienten mit schizophrenen Psychosen, deren soziale Integration schon durch ihre Grunderkrankung erschwert ist, stellen derart stigmatisierende Nebenwirkungen eine zusätzliche Belastung und Erschwernis dar.
Die Entstehung von Spätdyskinesien wird in Zusammenhang mit der antagonistischen Wirkung der Neuroleptika an prä- und postsynaptischen Dopaminrezeptoren gebracht. Danach nehmen bei länger andauernder antagonistischer Blockade von Dopaminrezeptoren im Rahmen der sogenannten Supersensitivitätsentwicklung sowohl deren Dichte als auch deren Empfindlichkeit (Sensitivität) gegenüber dem Neurotransmitter Dopamin zu [20]. Präsynaptisch kommt es infolge der Blockade postsynaptischer Dopaminrezeptoren zu einer gesteigerten Synthese und Freisetzung von Dopamin, die – zumindest im Bereich der Basalganglien (nigrostriatale Bahn) – mit den abnormen, unwillkürlichen Bewegungen im Rahmen tardiver Dyskinesien in Zusammenhang gebracht wird. Die klinische Beobachtung, dass sich beginnende Spätdyskinesien vorübergehend durch eine Dosissteigerung des verabreichten Neuroleptikums „maskieren“ und durch eine Dosisreduktion „demaskieren“ lassen, entspricht der „Supersensitivitätstheorie“ zur Erklärung der Entstehung tardiver Dyskinesien. Allerdings kann die „Supersensitivitätstheorie“ der postsynaptischen Dopaminrezeptoren nicht alle Aspekte der Entstehung und Behandlung tardiver Dyskinesien zufriedenstellend erklären, weshalb in den letzten Jahren erweiterte Hypothesen entwickelt und in deren Rahmen weitere Transmitter (z.B. Noradrenalin, GABA, Acetylcholin) diskutiert wurden (Übersicht bei [1]). Lehrbücher und Leitlinien der Fachgesellschaften empfehlen in der Regel, beim Auftreten tardiver Dyskinesien die Dosis des auslösenden Medikaments zu reduzieren (Cave: Absetzdyskinesien!) oder das Medikament abzusetzen. Allerdings führen beide Strategien bei einem Großteil der betroffenen Patienten zum Wiederauftreten (Re-Exazerbation) oder der Intensivierung/Aktivierung psychotischer Symptome. Von einem Wechsel auf neu entwickelte („atypische“) Substanzen profitiert nur ein Teil der Patienten, wobei auch diese Substanzen (wenn auch in unterschiedlichem Ausmaß) das Risiko der Entwicklung tardiver Dyskinesien bergen [2], wenn man von dem durch andere Risiken (v.a. Agranulozytose) belasteten Clozapin absieht.
Bis vor kurzem stand in Deutschland zur Behandlung tardiver Dyskinesien allein das Antihyperkinetikum Tiaprid – ein Dopamin-D2-Antagonist mit präferentieller Wirkung im nigrostriatalen System – zur Verfügung [23], während international mit Tetrabenazin eine weitere Substanz zur Verfügung stand [14]. Tetrabenazin ist eine Reserpin-ähnliche Substanz, die durch Hemmung eines präsynaptischen Monoamintransporters zur Depletion unter anderem präsynaptischer, Dopamin-speichernder Vesikel und damit zur Hemmung der dopaminergen synaptischen Transmission führt. Tetrabenazin hemmt die Aufnahme von Dopamin, Norepinephrin und Serotonin in die an der synaptischen Neurotransmission beteiligten präsynaptischen Vesikel („Transmitterspeicher“), indem es kompetitiv und reversibel an den präsynaptischen, vesikulären Monoamintransporter VMAT2 bindet. Dadurch wird unter anderem die Aufnahme von Dopamin aus dem Zytoplasma in die präsynaptischen Vesikel gehemmt, mit der Folge, dass Dopamin von der mitochondrialen Monoaminoxidase (MAO) inaktiviert wird [19, 21].
VMAT2 ist hauptsächlich im zentralen Nervensystem lokalisiert. Die durch Tetrabenazin induzierte Hemmung ist vollständig reversibel, die Wirkdauer vergleichsweise kurz [13]. An VMAT1, einen präferentiell im peripheren Nervensystem wirksamen Monoamintransporter, bindet Tetrabenazin nicht in relevantem Ausmaß. Daher hat Tetrabenazin weniger periphere Effekte (z.B. Blutdrucksenkung) als beispielsweise Reserpin, das an beide Rezeptortypen bindet.
Seit März 2007 ist Tetrabenazin unter dem Handelsnamen Nitoman® in Deutschland zur Therapie von Bewegungsstörungen bei Chorea Huntington und tardiven Dyskinesien zugelassen. Die hier vorgestellte, multizentrische, nichtinterventionelle Studie ist die bisher umfangreichste Beobachtungsstudie zur Wirksamkeit und Verträglichkeit von Tetrabenazin und fasst erstmals im deutschen Sprachraum mit diesem Medikament gesammelte Erfahrungen zusammen.
Methode
Die Untersuchung wurde als nichtinterventionelle Studie (NIS) konzipiert und multizentrisch bei niedergelassenen Ärzten gemäß §67Abs. 6 Arzneimittelgesetz und den Empfehlungen des BfArM zur Durchführung von Anwendungsbeobachtungen durchgeführt.
Ziel der Studie war die Erfassung der Besserung von Symptomen von Spätdyskinesien unter Behandlung mit Tetrabenazin. Darüber hinaus sollten die Dosierung von Tetrabenazin, Art, Häufigkeit und Schweregrad unerwünschter Arzneimittelwirkungen dokumentiert und analysiert werden.
Studiendesign
Zwischen März 2007 und Februar 2008 wurden insgesamt 184 Patienten in die Studie eingeschlossen. Beobachtet werden sollten Patienten mit mittelschweren bis schweren Spätdyskinesien, die auf bislang durchgeführte Therapiemaßnahmen nicht oder nur unbefriedigend angesprochen hatten. Der Beobachtungszeitraum umfasste eine sechs bis acht Wochen dauernde Therapiephase mit Tetrabenazin. Eine erste Kontrolluntersuchung erfolgte nach drei bis vier Wochen (Visite 2) eine weitere Kontrolle mit abschließender Bewertung erfolgte acht Wochen nach Einschluss (Visite 3).
Bei Visite 1 wurden erhoben: Demographische Daten, Beginn der Symptomatik der tardiven Dyskinesien, bisher durchgeführte Therapien, als auslösend angesehene Medikamente, Dauer ihrer Einnahme, Begleitmedikation, eventuelle Veränderungen der Begleitmedikation zu Beginn der Therapie mit Tetrabenazin sowie Vor- und Begleiterkrankungen. Bei Visite 1 wurde auch die initiale Dosierung von Tetrabenazin durch den behandelnden Arzt festgelegt. Im weiteren Verlauf der Studie sollte die Dosis schrittweise bis zur ausreichenden Wirkung oder gegebenenfalls bis zur subjektiven Verträglichkeitsgrenze gesteigert werden. Der Grad unwillkürlicher Bewegungen wurde mit der „Skala zur Erfassung abnormer unwillkürlicher Bewegungen“ (SKAUB; deutsche Version der Abnormal involuntary movement scale [AIMS] nach Lane et al. [15]) dokumentiert (s.u.).
Bei den Visiten 2 und 3 wurden die Compliance der Patienten, die aktuelle Dosierung von Tetrabenazin, verabreichte Begleitmedikation, gegebenenfalls unerwünschte Ereignisse und das aktuelle Ausmaß der Bewegungsstörungen (mit der SKAUB) dokumentiert.
Zusätzlich wurden bei Telefonkontakten zwischen den Visiten 1 und 2 sowie optional zu weiteren Zeitpunkten die aktuelle Dosis, eventuelle Dosisveränderungen von Tetrabenazin und unerwünschte Ereignisse erfragt, besprochen und dokumentiert.
Bei den jeweiligen Abschlussuntersuchungen wurden eine abschließende Beurteilung der Wirksamkeit und Verträglichkeit von Tetrabenazin durch den Arzt sowie durch den Patienten vorgenommen und anhand der CGI (Clinical global impression scale) dokumentiert. Weiterhin sollte angegeben werden, ob nach Ende des Beobachtungszeitraums eine Fortsetzung der Therapie mit Tetrabenazin angedacht war. Im Falle einer Beendigung der Therapie sollten die Gründe dafür dokumentiert werden.
Auswertung der Daten
Die Daten wurden deskriptiv statistisch mit dem Programmpaket SPSS, Version 14.0, ausgewertet. Die ermittelten Zahlen wurden als arithmetische Mittelwerte mit Standardabweichung (SEM) angegeben.
Ergänzend zur Analyse der Gesamtpopulation wurden die Patienten, die zu Beginn der Untersuchung unter einer laufenden Tiaprid-Medikation standen und darunter noch Symptome einer tardiven Dyskinesie hatten, einer Subgruppenanalyse unterzogen.
Ergebnisse
Patientenkollektiv
Die in die Studie aufgenommenen 184 Patienten waren zwischen 20 und 97 Jahre, im Mittel 61±15 Jahre alt, 107 (58% der Studienpopulation) waren Frauen.
Die mittlere Dauer seit Auftreten der ersten Symptome einer tardiven Dyskinesie betrug zum Zeitpunkt des Studienbeginns 48,1±51,7 Monate (Spannweite 1 Monat bis 28 Jahre).
Insgesamt wurden 29 Therapieabbrüche dokumentiert, davon 17 im Zeitraum bis zur zweiten Visite. Bei 9 Patienten wurde als Abbruchgrund unzureichende Wirkung angegeben, bei 10 Patienten nichtschwerwiegende unerwünschte Ereignisse, bei 2 Patienten schwerwiegende unerwünschte Ereignisse und bei 9 Patienten „sonstige Gründe“ (Mehrfachnennung möglich).
Von den 154 Patienten, die bis zum jeweiligen Beobachtungsende noch mit Tetrabenazin therapiert wurden, sollte bei 151 Patienten die Therapie nach Beendigung der Studie fortgesetzt werden.
Art und Dauer der Anwendung auslösender Medikamente
Bei dem überwiegenden Anteil der Patienten (71,2%) wurde nur ein Medikament als wahrscheinlicher Auslöser der tardiven Dyskinesie angegeben. Bei 17,4% der Patienten wurden zwei oder drei Medikamente genannt. Bei 11,4% der Patienten wurden keine Angaben zum auslösenden Medikament gemacht, beispielsweise weil die Medikamentenanamnese durch den behandelnden Arzt nicht mehr zu erheben war. Sowohl typische als auch atypische Neuroleptika wurden als Auslöser der tardiven Dyskinesie benannt, wobei Haloperidol am häufigsten (27,7%) als wahrscheinliche Ursache angegeben wurde. 12,4% der Fälle wurden mit dem atypischen Neuroleptikum Risperidon in Verbindung gebracht. In 10,4% der Fälle von tardiver Dyskinesie gaben die teilnehmenden Ärzte Fluphenazin und zu einem etwas geringeren Anteil Flupentixoldecanoat (8,9%) als wahrscheinlich auslösende Substanz an.
Die Einnahmedauer der auslösenden Medikamente betrug bei 148 von 160 Nennungen mehr als drei Monate. Bei 12 von 160 Nennungen wurde bereits nach weniger als dreimonatiger Einnahme die Diagnose einer tardiven Dyskinesie gestellt. Bei weiteren 41 Nennungen lagen keine Angaben zur Einnahmedauer vor.
Vorbehandlungen
Bei der Frage nach der Vorbehandlung der tardiven Dyskinesie wurden für 170 Patienten insgesamt 285 therapeutische Interventionen dokumentiert. Für 47% der Patienten wurde ein Absetzen des auslösenden Neuroleptikums angegeben. In 22% der Fälle wurde eine Dosisreduktion angegeben und in 48% die Umstellung auf ein anderes Neuroleptikum. Bei 55 (22%) der Patienten wurden unter der Frage nach sonstigen Maßnahmen Angaben zu weiteren Medikamenten als Monotherapie oder in unterschiedlichen Medikamentenkombinationen gemacht, wobei Tiaprid, Benzodiazepine, Anticholinergika, Levodopa, Botulinumtoxin, Baclofen, Antikonvulsiva und Antidepressiva genannt wurden.
Begleiterkrankungen/Begleitmedikation
Bei 58% der Patienten wurde jeweils mindestens eine Begleiterkrankung dokumentiert. Am häufigsten wurden Herz-Kreislauf-Erkrankungen (30% der Patienten) und Erkrankungen des zentralen Nervensystems (29% der Patienten) genannt.
Bei 156 (84%) der Patienten wurde bei Visite 1 die Einnahme von ZNS-wirksamen Begleitmedikamenten dokumentiert. Davon betrafen die häufigsten Einzelnennungen Neuroleptika bzw Dopaminrezeporenblocker (76), Antidepressiva (41), Antiparkinsonmedikamente (32), Benzodiazepine (26) und Anticholinergika (28).
Bei 68 Patienten wurden außerdem 164 nicht ZNS-wirksame Begleitmedikamente angegeben.
Die gesamte Begleitmedikation wurde zu Beginn der Behandlung mit Tetrabenazin bei 129 der insgesamt 184 Patienten des Gesamtkollektivs unverändert beibehalten. Auf die übrigen 55 Patienten entfielen insgesamt 61 dokumentierte Änderungen der Begleitmedikation. Dabei wurde am häufigsten Absetzen oder Dosisreduktion von Tiaprid oder Parkinsonmedikamenten genannt.
Zwischen den Visiten 2 und 3 kam es nochmals zu insgesamt 23 Veränderungen der Begleitmedikation. Hier dominierte mit zehn Nennungen die Reduktion oder das Absetzen von Tiaprid.
Behandlung mit Tetrabenazin
Dosistitration im Verlauf der Studie
In der Fachinformation wird zur Behandlung der tardiven Dyskinesie eine Initialdosis von 12,5 mg Tetrabenazin empfohlen. Danach ist in Abhängigkeit vom Ansprechen des Patienten auf die Therapie eine Erhöhung der Tagesdosis um jeweils 12,5 mg alle 3 bis 5 Tage bis zum Erreichen eines ausreichenden Behandlungserfolgs, dem Erreichen der Verträglichkeitsgrenze oder der Maximaldosis von 200 mg pro Tag vorgesehen. Die Verträglichkeitsgrenze ist definiert als die Dosis, bei der nichttolerable Nebenwirkungen auftreten. In Abbildung 1a ist die Entwicklung der durchschnittlichen Tagesdosis Tetrabenazin von Visite 1 zu Visite 3 dargestellt. Erwartungsgemäß wurde die Dosis im Verlauf der Studie erhöht (initial 16,9±13,1 mg/Tag, final 83,7±39,8 mg/Tag).
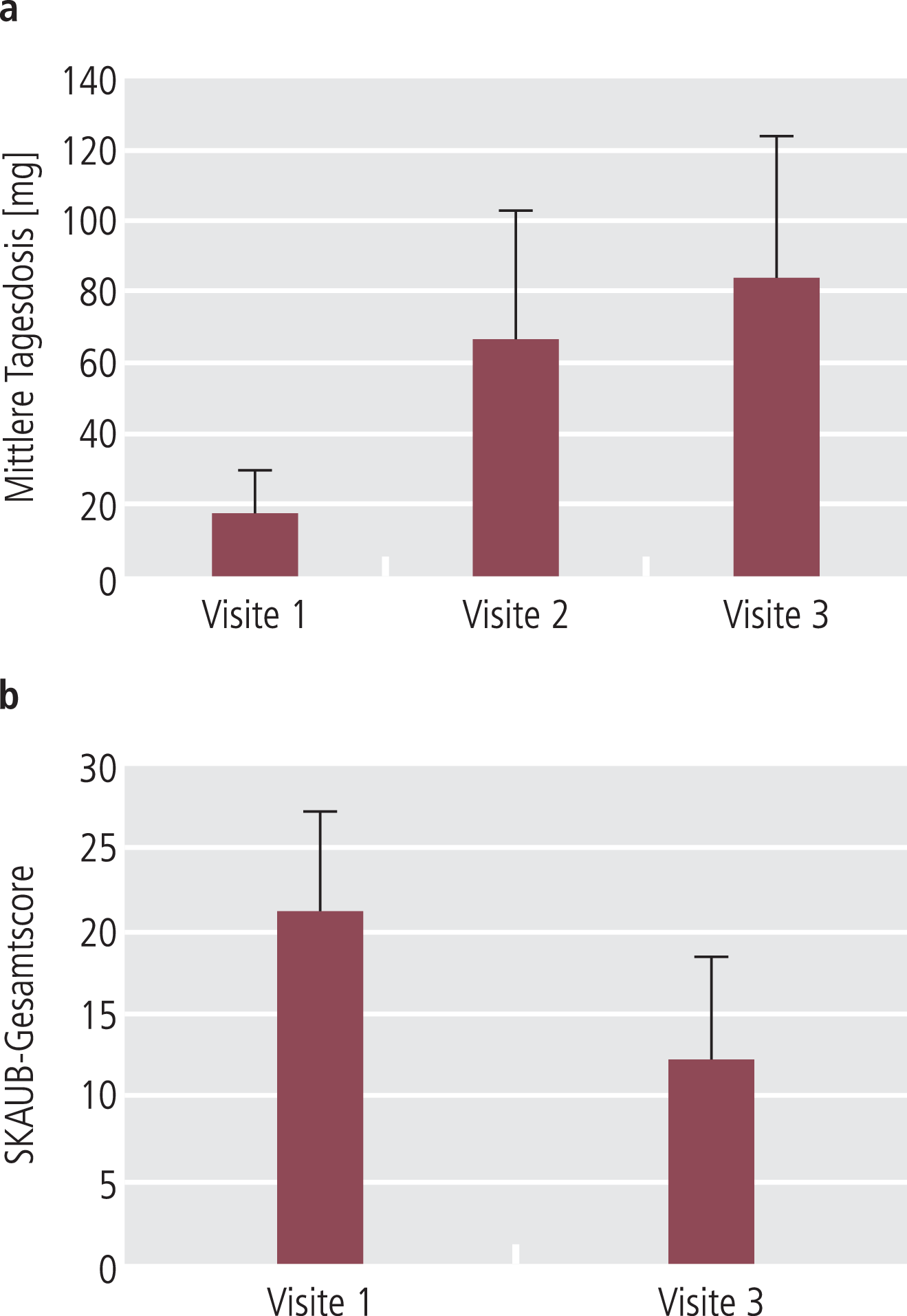
Abb. 1. a) Entwicklung der Tetrabenazin-Dosis von Visite 1 bis Visite 3. Fehlerbalken: Standardabweichung. b) Abnahme des Gesamtsummenscores auf der SKAUB von Visite 1 zu Visite 3
Verbesserung der Dyskinesie-Symptomatik
Zur Beurteilung der Wirksamkeit von Tetrabenazin bei der Behandlung von tardiven Dyskinesien wurde die Besserung der Symptomatik mithilfe der SKAUB erfasst. Die SKAUB beinhaltet 12 Items. 10 Items werden mit einer 5-stufigen-Skala mit je 0 bis 4 Punkten bewertet (mimische Muskulatur, Lippen und Perioralregion, Kiefer, Zunge, obere Extremitäten, untere Extremitäten, Rumpfbewegungen, Behinderungsgrad und Bewusstsein des Patienten über die abnormalen Bewegungen). Zwei Fragen zum Zahnstatus werden jeweils mit 0 oder 1 Punkt bewertet. Aus den Ergebnissen wird ein Gesamtsummenscore von 0 bis 42 möglichen Punkten gebildet.
Zum Ende des Beobachtungszeitraums hatte sich der mittlere Gesamtsummenscore der Gesamtpopulation von 21,0±6,2 (n=177) auf 12,2±5,2 Punkte (n=165) verringert (Abb. 1b).
In Abbildung 2 ist der Schweregrad der abnormalen Bewegungen zu Visite 1 und Visite 3 gegenübergestellt. Deutlich ist die Abnahme des Patientenanteils, bei dem die Abnormalität der Bewegungen insgesamt als mindestens „erheblich“ bewertet wurde, sowie die Zunahme derer, deren Bewegungsmuster als „noch normal“ eingestuft wurden.
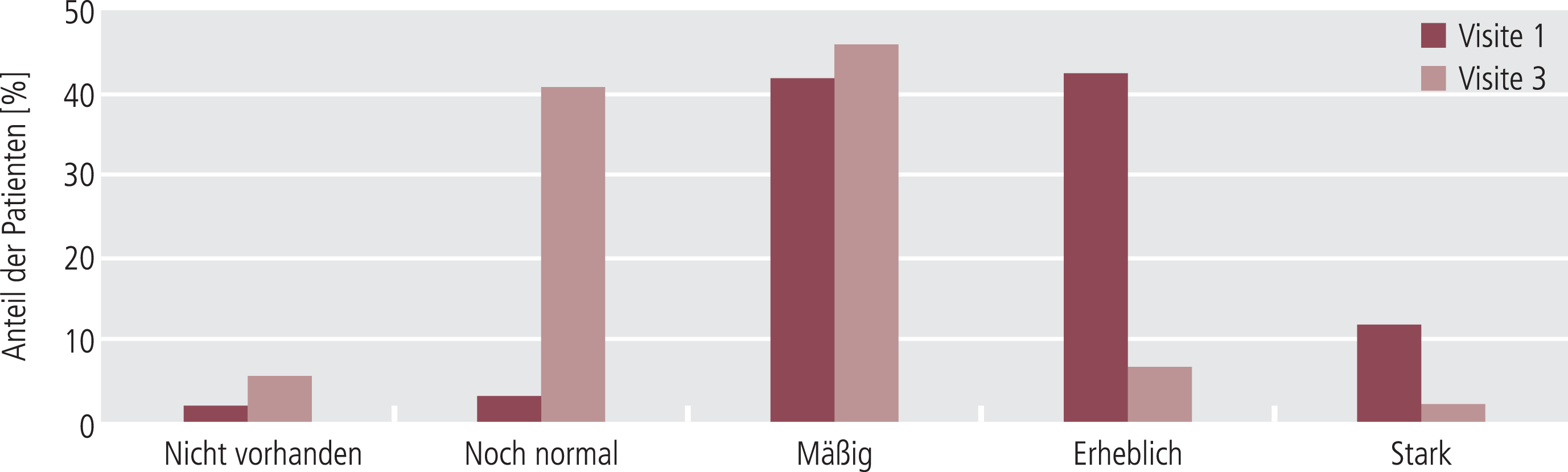
Abb. 2. Schweregrad der Symptome bei Visite 1 (dunkle Balken) und Visite 3 (helle Balken). Der Anteil der Patienten ohne Symptome oder mit einem noch normalen Bewegungsmuster nahm im Verlauf der Studie zu.
Abnahme des Behinderungsgrads infolge der Bewegungsstörungen
Eines der Items der SKAUB bezieht sich auf den Grad der Behinderung infolge der abnormalen Bewegungen. Bei einem Großteil der Patienten nahm die Behinderung im Verlauf der Studie ab. Während zu Visite 1 bei 88% der Patienten eine mäßige bis starke Behinderung angegeben wurde, sank der Anteil bis Visite 3 auf 40%. Somit war bei einem überwiegenden Anteil der Patienten eine deutliche Besserung der Funktionalität zu verzeichnen (Abb. 3a).
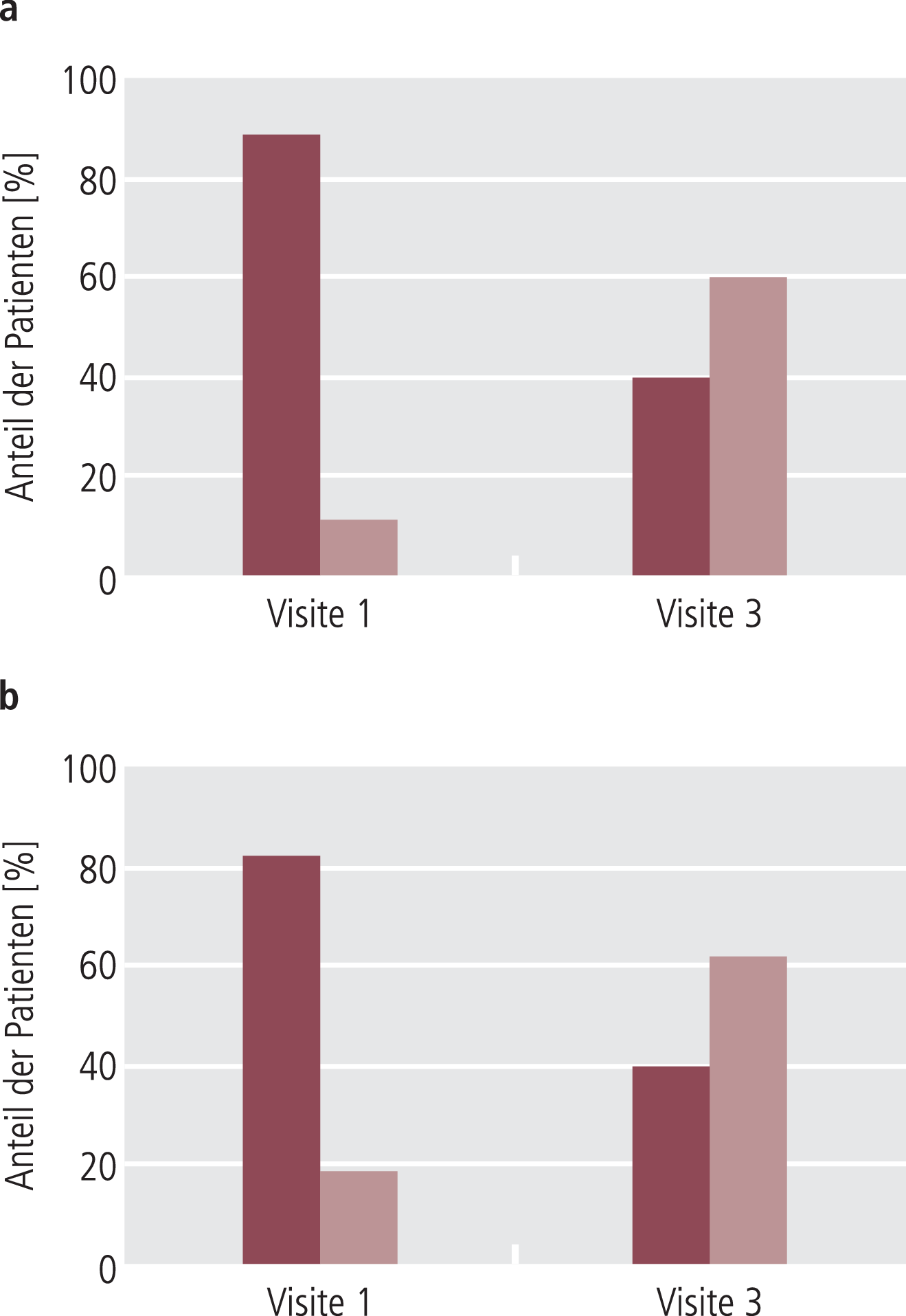
Abb. 3. a) Grad der Behinderung bei Visite 1 und Visite 3. Dunkle Balken: „mäßige Behinderung“ bis „starke Behinderung“, helle Balken: „keine Behinderung“ oder Bewegungsmuster, die „noch als normal betrachtet“ werden können. b) Bewusstheit abnormaler Bewegungen. Dunkle Balken: bewusst“ und „etwas quälend“ bis „äußerst quälend“, helle Balken: „nicht bewusst“ oder „bewusst, aber nicht quälend“.
Abnahme des Bewusstseins der abnormalen Bewegungen
Ein wichtiger Aspekt ist das Bewusstsein der Patienten über ihre abnormen, willkürlich kaum beeinflussbaren Bewegungen. Das entsprechende Item der SKAUB dokumentiert, ob sich die Patienten ihrer abnormalen Bewegungen bewusst sind und in welchem Ausmaß sie subjektiv belastet sind. Im Verlauf der Studie verringerte sich der Anteil der Patienten, die sich ihrer abnormen Bewegungen bewusst und durch sie belastet waren um mehr als die Hälfte (Visite 1: 81,7%; Visite 3: 39,7%) (Abb. 3b).
Beurteilung des Behandlungserfolgs durch Ärzte und Patienten
Nach Visite 3 wurde sowohl vom behandelnden Arzt als auch von den Patienten jeweils eine Abschlussbeurteilung abgegeben. Dabei sollten jeweils die Wirksamkeit und Verträglichkeit der Behandlung mit Tetrabenazin auf einer 5-stufigen Skala von „sehr gut“ bis „sehr schlecht“ bewertet werden. Sowohl Ärzte als auch Patienten beurteilten die Wirksamkeit und Verträglichkeit überwiegend positiv. Die Ärzte bewerteten die Wirksamkeit in 26,0% der Fälle als „sehr gut“ und in 44,5% als „gut“, nach der Bewertung durch die Patienten war die Wirksamkeit in 22,4% der Fälle sehr gut und in 44,3% gut. Die Ergebnisse sind in Tabelle 1 zusammengefasst.
Tab. 1. Abschlussbeurteilung der Wirksamkeit und Verträglichkeit durch den Arzt und den Patienten (Nennungen [%])
|
Wirksamkeit (Arzt) |
Wirksamkeit (Patient) |
Verträglichkeit (Arzt) |
Verträglichkeit (Patient) |
|
|
Sehr gut |
26,0 |
22,4 |
38,6 |
32,4 |
|
Gut |
44,5 |
44,3 |
46,2 |
48,8 |
|
Befriedigend |
20,8 |
21,3 |
8,8 |
9,8 |
|
Schlecht |
6,9 |
10,3 |
5,8 |
7,5 |
|
Sehr schlecht |
1,7 |
1,7 |
0,6 |
1,7 |
Es ist bemerkenswert, dass der Erfolg der Therapie mit Tetrabenazin auch von den 63 Patienten relativ gut bewertet wurde, die bei Visite 3 noch Symptome einer tardiven Dyskinesie aufwiesen. Die Wirksamkeit wurde von den Ärzten bei 30 dieser Patienten (48%) als „sehr gut“ oder „gut“, bei 22 (35%) als „befriedigend“ und bei 7 Patienten (11%) als „schlecht“ oder „sehr schlecht“ angegeben. Bei 4 Patienten lagen keine Angaben vor.
Weiterhin wurde die Veränderung des Befindens des Patienten vom Arzt (n=177) und auch vom Patienten selbst (n=163) eingeschätzt. 87,0% der Ärzte und 83,4% der Patienten gaben an, dass sich das Befinden des Patienten beziehungsweise ihr Befinden im Verlauf der Therapie gering bis stark verbessert hatte. Ein unverändertes Befinden wurde von 9,0% der Ärzte und 9,8% der Patienten dokumentiert. Lediglich in 4,0% der Fälle gaben die Ärzte und in 6,7% der Fälle die Patienten eine Verschlechterung des Befindens unter Tetrabenazin zu Protokoll.
Einhaltung der Dosistitrationsempfehlung bei Patienten mit nur befriedigender oder schlechterer Wirksamkeit von Tetrabenazin
Die behandelnden Ärzte dokumentierten bei 51 Patienten eine befriedigende, schlechte oder sehr schlechte Wirksamkeit von Tetrabenazin, während 58 Patienten die Wirksamkeit selbst lediglich mit befriedigend bis sehr schlecht angaben. Analysiert man die Daten dieser Patienten bezüglich der Einhaltung der Dosierungsempfehlung, zeigt sich, dass in 33 der ärztlich beurteilten und 38 der durch die Patienten beurteilten Fälle die Titration abgebrochen wurde, obwohl weder das zulässige Höchstdosispotenzial von 200 mg Tetrabenazin am Tag erreicht noch Nebenwirkungen dokumentiert worden waren.
Analyse der Tiaprid-Subgruppe
Neben Tetrabenazin ist auch Tiaprid in Deutschland zur Behandlung tardiver Dyskinesien zugelassen. 46 der Patienten standen bei Einschluss in diese Studien noch unter Behandlung mit Tiaprid, litten aber weiterhin unter Symptomen der tardiven Dyskinesie. In einer Subgruppen-Analyse wurde untersucht, ob sich bei diesen Patienten die Umstellung auf Tetrabenazin oder die Kombinationstherapie mit Tetrabenazin und Tiaprid positiv auf die Symptomatik der Dyskinesien auswirkte und wie die Verträglichkeit im weiteren Verlauf der Behandlung bei dieser Subgruppe einzustufen war.
Die durchschnittliche Tagesdosis von Tiaprid lag bei dieser Subgruppe zum Zeitpunkt des Einschlusses in die Studie bei 409±199,95 mg (100–800 mg). Bei 14 Patienten lag die Tiaprid-Dosis zu Studienbeginn bei 600 mg/Tag, bei zwei Patienten bei 800 mg/Tag. Die Tiaprid-Dosis wurde bei neun Patienten während des Beobachtungszeitraums unter Tetrabenazin unverändert beibehalten, bei zehn Patienten reduziert, bei neun Patienten ausgeschlichen und bei 18 Patienten zu Beginn der Tetrabenazin-Einnahme komplett abgesetzt. Bei den Patienten, bei denen Tiaprid bei der Umstellung auf Tetrabenazin ohne Ausschleichen abgesetzt worden war, lag die mittlere Tiaprid-Dosis vor Beginn der Tetrabenazin-Therapie bei 304 mg/Tag (min. 100 mg, max. 600 mg). Ihre mittlere Tetrabenazin-Dosis lag bei Visite 3 bei 60,8 mg/Tag Tetrabenazin (min. 12,5 mg, max. 87,5 mg). Bis zum Ende des Beobachtungszeitraums schieden 7 der 46 Patienten aus der Tiaprid-Subgruppe vorzeitig aus der Studie aus, davon 5 wegen unerwünschter Ereignisse, je einer wegen mangelnder Compliance beziehungsweise auf eigenen Wunsch. Bei den fünf Patienten, die wegen eines unerwünschten Ereignisses ausschieden, war in drei Fällen eine übergangslose Umstellung von Tiaprid auf Tetrabenazin erfolgt. Am Ende des Beobachtungszeitraums nahmen von den 39 verbliebenen Patienten der Tiaprid-Subgruppe 24 Patienten Tetrabenazin in Mono- und 15 Patienten in Kombinationstherapie mit Tiaprid ein.
Bei den Patienten mit der Kombinationstherapie von Tetrabenazin und Tiaprid lagen bei Visite 3 die mittleren Dosen bei 276 mg/Tag Tiaprid (min. 50 mg, max. 600 mg) und 80 mg/Tag Tetrabenazin (min. 37,5 mg, max. 150 mg).
Der Gesamtsummenscore auf der SKAUB halbierte sich in der Tiaprid-Subgruppe im Beobachtungszeitraum von durchschnittlich 24,2±5,8 (n=46) auf 12,4±5,7 (n=42) Punkte. Bei den Patienten, die zum Einschlusstermin eine Tagesdosis von 600 mg Tiaprid oder mehr hatten (n=16), sank der Score im Beobachtungszeitraum von 25,0 auf 11,8.
Auch nach Einschätzung der Ärzte kam es bei der überwiegenden Mehrheit der Patienten (37 von 39 Patienten), die unter der Therapie mit Tiaprid noch unter Symptomen einer Spätdyskinesie gelitten hatten, zu einer „sehr guten“ (15 von 39 Patienten) oder „guten“ (22 von 39 Patienten) Response. Bei allen 39 Patienten dieser Subgruppe, die bei Visite 3 noch mit Tetrabenazin oder der Kombination Tetrabenazin/Tiaprid therapiert wurden, war eine Fortsetzung der Tetrabenazin-Therapie auch nach Beendigung der Studie vorgesehen. Betrachtet man den Therapieerfolg dieser 39 Patienten differenziert nach Monotherapie mit Tetrabenazin oder Kombinationstherapie Tetrabenazin mit Tiaprid, ergibt sich für die 24 Patienten mit Monotherapie eine Verbesserung des SKAUB-Scores von 24,2 bei Visite 1 auf 12 bei Visite 3, für die Patienten mit Kombitherapie betrug der SKAUB-Score 24,4 bei Visite 1 und 12,5 bei Visite 3.
Arzneimittelsicherheit
Insgesamt traten bei 27 Patienten (14,7% der Patienten der Gesamtpopulation) ein oder mehrere unerwünschte Ereignisse (UE) auf. In der Tiaprid-Subgruppe traten bei neun Patienten (19,6%) jeweils ein oder mehrere UE auf. Bezogen auf die Gesamtpopulation wurde in der Hälfte der UE-Fälle (51,2%) der Ausprägungsgrad des UE mit „leicht“ bewertet, in der Tiaprid-Subgruppe galt dies für 33,3% der UE-Fälle.
Alle unerwünschten Ereignisse, bei denen ein Kausalzusammenhang mit der Einnahme von Tetrabenazin durch die Ärzte nicht definitiv ausgeschlossen wurde, wurden als Nebenwirkungen eingestuft. Am häufigsten genannt wurden die Nebenwirkungen „Müdigkeit“ (8-mal) gefolgt von „Parkinsonismus“ (4-mal). „Nervosität/Ängstlichkeit, Schlafstörungen, Speichelfluss/vermehrte Schleimbildung und Schwindel“ traten bei drei, „Depression, Akathisie und Übelkeit/Erbrechen“ jeweils bei zwei Patienten auf.
Bis zum Ende der Beobachtung waren von den Patienten, bei denen Nebenwirkungen aufgetreten waren, 67,4% „wiederhergestellt ohne Folgen“.
Bei drei Patienten traten insgesamt vier als schwerwiegend eingestufte unerwünschte Ereignisse (SUE) auf. Zwei dieser Patienten gehörten zur Subgruppe der mit Tiaprid vorbehandelten Patienten. Bei einem Patienten waren Gleichgewichtsstörungen und Schluckbeschwerden aufgetreten, die nach einem Tag sistierten, jedoch mitursächlich für eine Krankenhauseinweisung waren. In einem weiteren als schwerwiegend eingestuften Fall erlitt die Patientin zehn Wochen nach Beginn der Tetrabenazin-Therapie und damit fünf Wochen nach letzter Dosiskorrektur im Wartezimmer eine Synkope. Der Kausalzusammenhang wurde unmittelbar nach dem Ereignis zunächst als möglich eingestuft. Unter Einbeziehung der Untersuchungsergebnisse, die im Rahmen des anschließenden Klinikaufenthalts erhoben wurden, und der Tatsache, dass die Patientin Tetrabenazin nach kurzer Therapieunterbrechung nach dem Klinikaufenthalt in unveränderter Dosis weiter einnahm, ohne dass das Ereignis erneut auftrat, erscheint jedoch ein Kausalzusammenhang zwischen dem Ereignis (Synkope) und der Einnahme von Tetrabenazin wenig wahrscheinlich.
Bei einem Patienten, dessen Anamnese unter Vorbehandlung mit Tiaprid bezüglich depressiver Verstimmungen unauffällig war, kam es wenige Stunden nach der „Add-on“-Einnahme von 12,5 mg Tetrabenazin zu Suizidgedanken, die nach dem Absetzen von Tetrabenazin innerhalb weniger Stunden wieder sistierten. Alle Patienten mit SUE waren nach Abschluss der Studie „wiederhergestellt ohne Folgen“.
Diskussion
Wegen seiner Reserpin-ähnlichen Wirkungen wird Tetrabenazin als Hemmstoff des präsynaptischen Monoamintransporters VMAT2 zur Therapie verschiedener hyperkinetischer Bewegungsstörungen eingesetzt. So wurden für Tetrabenazin schon in den 60er und 70er Jahren positive Ergebnisse für die Behandlung von Bewegungsstörungen bei der Huntington-Krankheit, bei Tic-Störungen, dem Tourette-Syndrom und bei Neuroleptika-bedingten tardiven Dyskinesien berichtet [3, 6, 12, 17, 22]. Inzwischen ist Tetrabenazin in vielen europäischen Ländern, in Kanada und den USA für eine oder mehrere dieser Indikationen zugelassen. Im März 2007 erhielt Tetrabenazin auch in Deutschland unter dem Handelsnamen Nitoman® die Zulassung zur Behandlung von Bewegungsstörungen bei der Huntington-Krankheit und für mittelschwere bis schwere tardive Dyskinesien, die auf andere Therapiemaßnahmen nicht angesprochen hatten.
Damit steht seitdem neben Tiaprid eine weitere therapeutische Option zur Verfügung, deren Wirksamkeit und Verträglichkeit unter Routinebedingungen in der Praxis erstmalig mit der vorliegenden Studie erfasst wurde. Insgesamt 184 Patienten mit tardiver Dyskinesie wurden im Rahmen dieser NIS mit Tetrabenazin behandelt.
Die Symptome der tardiven Dyskinesie bestanden bei dem untersuchten Patientenkollektiv zu Studienbeginn im Mittel seit über vier Jahren (48,1 Monaten) und waren bei mehr als 90% der Patienten bereits mit mehreren Therapieversuchen behandelt worden. Die Vorgehensweise bei der Einstellung auf Tetrabenazin entsprach in dieser Studie überwiegend dem empfohlenen Titrationsschema.
Es wurden danach durchschnittliche Tagesdosierungen von 83,7 mg Tetrabenazin bei Visite 3 erreicht. Dabei ist zu berücksichtigen, dass bei einem Teil der Patienten die Dosis nicht konsequent bis zur optimal wirksamen und verträglichen Dosis gesteigert wurde. Diese Annahme stützt sich auf die Beobachtung, dass bei etwa zwei Drittel derjenigen Patienten, bei denen die Wirksamkeit von Tetrabenazin als nur befriedigend, schlecht oder sehr schlecht bewertet wurde, die Titration vor Erreichen der gewünschten Wirkung abgebrochen wurde, obwohl keine limitierenden Faktoren wie Nebenwirkungen vorlagen. Dies ist möglicherweise damit zu erklären, dass aufgrund der Neuzulassung von Tetrabenazin in Deutschland ab 2007 das Dosierungsverhalten der verordnenden Ärzte noch von vorsichtiger Zurückhaltung geprägt sein kann.
Die verordneten Tagesdosen von Tetrabenazin variierten entsprechend bei Visite 3 zwischen 12,5 und 200 mg. Ein Vergleich mit der mittleren Tetrabenazin-Dosis anderer Studien ist für die Indikation „tardive Dyskinesie“ schwierig, da in die meist älteren Studien Patienten mit unterschiedlichen Bewegungsstörungen eingeschlossen waren und die Dosierungen in diesen Publikationen nicht nach Indikation differenziert wurden. In einer Studie von Ondo et al. [16] lag die mittlere Tetrabenazin-Dosis bei 20 eingeschlossenen Patienten im Mittel bei 57 mg/Tag. Watson et al. [25] untersuchten 23 Patienten mit tardiver Dyskinesie und fanden individuell unterschiedliche Dosierungen zwischen 37,5 und 150 mg Tetrabenazin pro Tag (Mittelwert 91,3 mg) optimal.
Übereinstimmend mit den Ergebnissen früherer Studien zeigt die vorliegende Untersuchung, dass bei tardiver Dyskinesie ein Therapiebeginn mit niedrigen Dosen von Tetrabenazin ab 12,5 mg und eine anschließende effektivitäts- und verträglichkeitsorientierte Dosissteigerung zu guten Ergebnissen führt. Die jeweils optimale Dosis kann sehr unterschiedlich sein.
Zur Bestimmung der therapeutischen Wirksamkeit wurde die SKAUB verwendet, das meistverwendete Instrument zur Beurteilung tardiver Dyskinesien. Im Studienzeitraum von sechs bis acht Wochen sank der durchschnittliche Gesamtsummenscore des Gesamtkollektivs von 21 Punkten zu Untersuchungsbeginn auf 12,2 bei der 3. Visite. In Anbetracht des meist langjährigen Bestehens der Dyskinesien, mehrfacher Vorbehandlungen und der unvollständigen Dosistitration bei einem Teil der Patienten ist dieses Ergebnis positiv zu bewerten.
Die Ergebnisse zur Effektivität stehen in Einklang mit den Ergebnissen früherer Studien, in denen sich Tetrabenazin zur Behandlung tardiver Dyskinesien als wirksam und gut verträglich erwies [z.B. 8, 9, 16, 18].
Auch der Grad der Behinderung, der von unmittelbarer praktischer Bedeutung für die Alltagsbewältigung und Lebensqualität der Patienten ist, nahm im Verlauf der Studie stark ab. Während zum Zeitpunkt der ersten Visite eine mäßige bis schwere Behinderung infolge der tardiven Dyskinesien bei 86% der Patienten angegeben wurde, wurde der Behinderungsgrad zum Ende des Beobachtungszeitraums bei mehr als 50% der Patienten mit „nicht vorhanden“ oder „gering“ bewertet. Bei 32% lag noch eine mäßige Behinderung vor, die Anzahl der „erheblich“ oder „stark behinderten“ Patienten sank auf 3,3 bzw. 1,6%. Nicht alle Patienten, die unter einer tardiven Dyskinesie leiden, nehmen ihre Bewegungsstörung bewusst wahr. Ist sie ihnen jedoch bewusst und leiden sie darunter, führt dies in besonderem Maß zur Einschränkung ihrer Lebensqualität. Gaben zu Beginn der Studie noch mehr als 80% der Patienten „quälende“ Empfindungen über ihre abnormalen Bewegungen an, traf dies bei Studienende nur noch für die Hälfte der Patienten zu. Sowohl Ärzte als auch Patienten beurteilten den Behandlungserfolg mit Tetrabenazin überwiegend positiv.
Die Subgruppenanalyse der Patienten mit Tiaprid-Vorbehandlung zeigt, dass die meisten Patienten, die unter einer Behandlung mit Tiaprid noch Symptome einer tardiven Dyskinesie aufwiesen, von einer Therapie mit Tetrabenazin profitierten. Einschränkend muss allerdings erwähnt werden, dass ein Teil dieser Patienten zum Zeitpunkt der Umstellung Tiaprid in Dosierungen einnahm, die unter der für die Indikation empfohlenen Dosis lagen. Aber auch bei den 16 Patienten, die vor Beginn der Tetrabenazin-Therapie Tiaprid in Dosierungen von 600 bis 800 mg/Tag erhalten hatten, verminderte sich der SKAUB-Gesamtscore von initial 25,0 auf 11,8.
In der Literatur gibt es bisher weder Daten zum Vergleich der Wirksamkeit und Verträglichkeit von Tiaprid und Tetrabenazin noch zur kombinierten Anwendung dieser beiden Medikamente.
Die vorliegende Studie dokumentiert erstmals Behandlungsverläufe, bei denen eine Umstellung von Tiaprid auf Tetrabenazin oder eine Kombinationstherapie mit beiden Substanzen erfolgt war. Weitere Untersuchungen sind notwendig um beurteilen zu können, ob und für welche Patienten mit tardiver Dyskinesie eine Kombination (Tiaprid/Tetrabenazin) der Monotherapie mit Tetrabenazin überlegen sein könnte.
Ein weiteres Zielkriterium dieser Untersuchung war die Sicherheit und Verträglichkeit der Therapie mit Tetrabenazin, welches in der Literatur noch nie in Verbindung mit tardiven Dyskinesien gebracht wurde, jedoch insbesondere bei höherer Dosierung Bewegungsstörungen wie Parkinsonismus, Akathisie und Tremor auslösen kann [8]. Zu den bekannten Nebenwirkungen von Tetrabenazin gehören weiterhin Schläfrigkeit, Depression und Schlafstörungen. Diese Nebenwirkungen von Tetrabenazin sind überwiegend dosisabhängig und erfahrungsgemäß ohne Ausnahme nach dem Absetzen vollständig reversibel [11].
Die in dieser Studie beobachteten Nebenwirkungen entsprachen hinsichtlich der Art der Symptome und dem Schweregrad dem für Tetrabenazin zu erwartenden Spektrum. Trotz häufiger Multimorbidität der Patienten dieser Beobachtungsstudie und dementsprechend häufigem Einsatz von ZNS-wirksamer und sonstiger Begleitmedikation wurden im Rahmen dieser Untersuchung keine unerwünschten Symptome auf der Basis bisher unbekannter Wechselwirkungen identifiziert. Die kontraindizierte Kombination von Tetrabenazin mit MAO-Hemmern wurde in keinem Fall verordnet. Insgesamt 12 der 29 Therapieabbrüche wurden ganz oder teilweise mit dem Vorliegen eines unerwünschten Ereignisses begründet. Davon betrafen fünf Ereignisse die Subgruppe der Patienten, die von Tiaprid umgestellt oder mit einer Kombination von Tiaprid und Tetrabenazin behandelt wurden. Möglicherweise bedingt eine Kombination von Tiaprid mit Tetrabenazin ein höheres Risiko unerwünschter Arzneimittelwirkungen. Darauf wird bei weiteren Untersuchungen zur Wirksamkeit einer Kombination von Tiaprid und Tetrabenazin zu achten sein.
Die Studie zeigt, dass die Therapie tardiver Dyskinesien mit Tetrabenazin bei den meisten Patienten effektiv und hinreichend sicher ist. Vergleichsstudien mit dem in Deutschland bereits seit längerem erhältlichen Tiaprid liegen aktuell nicht vor. Die Subgruppenanalyse der Patienten dieser Studie mit einer Tiaprid-Vortherapie weist jedoch darauf hin, dass Patienten mit tardiver Dyskinesie, die auf eine Therapie mit Tiaprid primär oder infolge von Toleranzentwicklung nicht ausreichend ansprechen, von einer Umstellung oder Kombinationstherapie profitieren können.
Der Beobachtungszeitraum der Studie ist mit einer Dauer von sechs bis acht Wochen zu kurz, um Aussagen über eine Langzeittherapie mit Tetrabenazin zu ermöglichen. Es gibt jedoch eine Reihe weiterer Beobachtungsstudien mit Patienten unterschiedlicher Indikationen aus dem Spektrum hyperkinetischer Bewegungsstörungen, die gezeigt haben, dass Tetrabenazin auch in der Langzeitanwendung über mehrere Jahre wirksam und sicher ist [10]. In keiner dieser Studien wurde eine nennenswerte Toleranzentwicklung gegen den Wirkstoff beobachtet.
Damit stellt die Zulassung von Tetrabenazin in Deutschland eine sinnvolle Bereicherung des Behandlungsspektrums für tardive Dyskinesien dar.
Interessenkonflikt
Prof. Dr. Dose hat Honorare für Beratungs- und Vortragstätigkeit von Temmler Pharma erhalten. Die vorliegende Studie wurde von Temmler Pharma gesponsert.
Literatur
1. Casey DE. Tardive dyskinesia: pathophysiology and animal models. J Clin Psychiatry 2000;61(Suppl 4):5–9.
2. Correll CU, Schenk EM. Tardive dyskinesia and new antipsychotics. Curr Opin Psychiatry 2008;21:151–6.
3. Dalby MA. Effect of tetrabenazine on extrapyramidal movement disorders. Br Med J 1969;2:422–3.
4. Dose M. Neuroleptisch bedingte Spätdyskinesien: Definition, Symptomatik, Diagnose, Prävalenz, Hypothesen zur Entstehung, Risikofaktoren, Therapie und Prävention. Synthelabo Arzneimittel GmbH, 1993.
5. Egan MF, Apud J, Wyatt RJ. Treatment of tardive dyskinesia. Schizophr Bull 1997;23: 583–609.
6. Gilligan BS, Wodak J, Veale JL, Munro OR. Tetrabenazine in the treatment of extrapyramidal dyskinesias. Med J Aust 1972;2:1054–6.
7. Huntington Study Group. Tetrabenazine as antichorea therapy in Huntington disease: a randomized controlled trial. Neurology 2006;66:366–72.
8. Jankovic J, Beach J. Long-term effects of tetrabenazine in hyperkinetic movement disorders. Neurology 1997;48:358–62.
9. Jankovic J, Vuong KD, Hunter C. Safety and efficacy of tetrabenazine in the treatment of Huntington’s disease and other choreas. Mov Disord 2004;19:1127.
10. Kenney C, Hunter C, Jankovic J. Long-term tolerability of tetrabenazine in the treatment of hyperkinetic movement disorders. Mov Disord 2007;22:193–7.
11. Kenney C, Jankovic J. Tetrabenazine in the treatment of hyperkinetic movement disorders. Expert Rev Neurother 2006;6:7–17.
12. Kingston D. Tetrabenazine for involuntary movement disorders. Med J Aust. 1979;1: 628–30.
13. Kuczenski R. Differential effects of reserpine and tetrabenazine on rat striatal synaptosomal dopamine biosynthesis and synaptosomal dopamine pools. J Pharmacol Exp Ther 1977;201:357–67.
14. Lane JD, Smith JE, Shea PA, McBride WJ. Neurochemical changes following the administration of depleters of biogenic monoamines. Life Sci 1976;19:1663–7.
15. Lane RD, Glazer WM, Hansen TE, Berman WH, et al. Assessment of tardive dyskinesia using the abnormal involuntary movement scale. J Nerv Ment Dis 1985;173:353–7.
16. Ondo WG, Hanna PA, Jancovic J. Tetrabenazine treatment for tardive dyskinesia: assessment by randomized videotape protocol. Am J. Psychiatry 1999;156:1279–81.
17. Pakkenberg H. The effect of tetrabenazine in some hyperkinetic syndromes. Acta Neurol Scand 1968;44:391–3
18. Paleacu D, Giladi N, Moore O, Stern A, et al. Tetrabenazine treatment in movement disorders. Clin Neuropharmacol 2004;27:230–3.
19. Pettibone DJ, Totaro JA, Pflueger AB. Tetrabenazine-induced depletion of brain monoamines: characterization and interaction with selected antidepressants. Eur J Pharmacol 1984;102:425–30.
20. Philipp M, Lesch OM, Walter H, Patras L, et al. für die FRISPO-Studiengruppe. Wirksamkeit von Flupentixol vs. Risperidon auf die Negativsymptomatik schizophrener Patienten. Psychopharmakotherapie 2002;9: 67–74.
21. Quinn GP, Shore PA, Brodie BB. Biochemical and pharmacological studies of RO 1-9569 (tetrabenazine), a non-indole tranquilizing agent with reserpine-like effects. J Pharmacol Exp Ther 1959;127:103–9.
22. Sattes H. [The treatment of chorea minor with the monoamine liberator “Nitoman”]. Psychiatr Neurol (Basel) 1960;140:13–9.
23. Scatton B, Cohen C, Perrault G, Oblin A, et al. The preclinical pharmacologic profile of tiapride. Eur Psychiatry 2001;16(Suppl 1): 29s–34s.
24. Temmler Pharma GmbH. Nitoman® Fachinformation. 4. Version, 16.02.2007.
25. Watson MW, Skelton D, Jamali F. Treatment of tardive dyskinesia:preliminary report on use of tetrabenazine. Can J Psychiatry 1988;33:11–3.
Prof. Dr. med. Matthias Dose, Isar-Amper-Klinikum gemeinnützige GmbH, Klinik Taufkirchen (Vils), Bräuhausstraße 5, 84416 Taufkirchen, E-Mail: M.Dose@iak-kt.de Karin Gawora, Temmler Pharma GmbH & Co. Medizin, Temmlerstr. 2, 35039 Marburg, Deutschland
Efficacy and safety of tetrabenazin in treatment of tardive dyskinesia results of a multicentric non-interventional trial
Efficacy and safety of tetrabenazine (TBZ) was examined in a multicenter, non-interventional study. 184 patients with tardive dyskinesia were adjusted to TBZ, at the endpoint of the non-interventional study 154 out of the 184 patients were still treated with TBZ.
At the end of the 6–8 weeks observation period the mean dose amounted for 83.7±39.8 mg. The severity code of movement disorders was measured with the “SKAUB Scale” (the SKAUB Scale is the German version of the Abnormal Involuntary Movement Scale – AIMS). It improved from a mean score of initially 21.0±6.2 to a score of 12.2±5.2 at the endpoint of the observation period. Adverse events (AE) occurred for 27 patients. Those AEs were described as mild in 51% of all cases.
Frequent symptoms were fatigue, symptoms of the Parkinson’s disease, vertigo and depression. Therapy outcome was evaluated by 70% of the physicians and 66% of the patients with very good or good.
Keywords: Tetrabenazin, tardive dyskinesia, efficacy, safety
Psychopharmakotherapie 2009; 16(05)
