Dr. Heike Oberpichler-Schwenk, Stuttgart
Die selektive Hemmung der Monoaminoxidase B ist als Therapieprinzip bei der Parkinson-Krankheit seit Jahren etabliert. Nach Selegilin wurde als zweiter MAO-B-Hemmer nun Rasagilin (Abb. 1) zugelassen. Rasagilin hemmt die Monoaminoxidase B selektiv und irreversibel. Es verhindert die MPTP-Toxizität bei Mäusen in 5- bis 10fach geringeren Dosen als Selegilin.
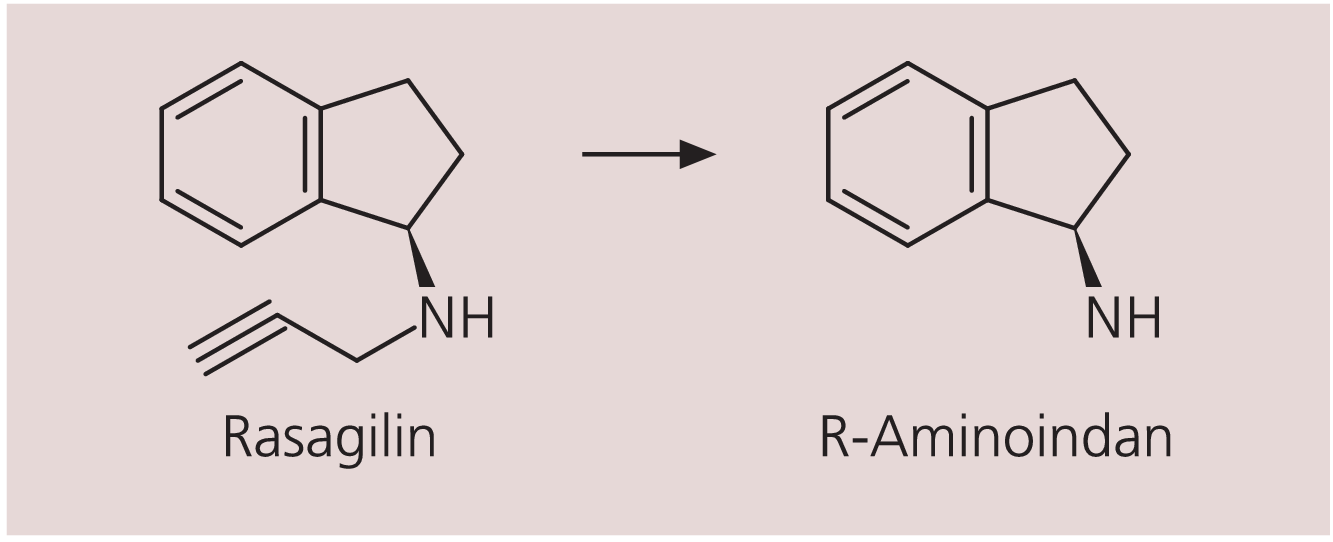
Abb. 1. Rasagilin und sein Hauptmetabolit 1-(R)-Aminoindan
In verschiedenen In-vitro- und In-vivo-Modellen wurden neuroprotektive Wirkungen von Rasagilin nachgewiesen, zum Beispiel bei der Glutamat-Toxizität an kultivierten Hippocampus-Neuronen, bei der Anoxie in PC12-Zellen, beim permanenten Verschluss der mittleren Zerebralarterie bei Ratten oder bei hypertensiven Ratten mit Schlaganfallneigung. Da auch das S-Enantiomer von Rasagilin diese Wirkungen entfaltet, können sie nicht auf die MAO-B-Hemmung zurückgeführt werden. Entscheidend ist wohl die Propargylamin-(Propinylamin-)Seitenkette. Einige günstige Wirkungen in In-vivo-Modellen lassen sich auch dem Hauptmetaboliten, 1-(R)-Aminoindan, zuschreiben, beispielsweise der Schutz vor den Auswirkungen eines Sauerstoffmangels auf die motorische Aktivität bei Dopamin-verarmten Ratten.
Rasagilin wird nach oraler Gabe rasch resorbiert, die maximale Plasmakonzentration wird innerhalb von etwa 30 Minuten erreicht. Die absolute Bioverfügbarkeit beträgt etwa 36 %. Rasagilin wird zu 60 bis 70 % an Plasmaproteine gebunden. Seine terminale Halbwertszeit beträgt 0,5 bis 2 Stunden. Rasagilin wird fast vollständig in der Leber metabolisiert, hauptsächlich durch N-Dealkylierung und/oder Hydroxylierung mithilfe von Cytochrom P450-1A2.
Monotherapie mit Rasagilin
Die Wirksamkeit einer Rasagilin-Monotherapie bei Patienten im frühen Stadium der Parkinson-Krankheit wurde in einer randomisierten, Plazebo-kontrollierten Doppelblindstudie mit 404 Patienten an 32 nordamerikanischen Zentren untersucht. Die Patienten waren im Durchschnitt 61 Jahre alt und seit etwa einem Jahr erkrankt Sie erhielten 26 Wochen lang
- 1 mg/Tag Rasagilin (n=134)
- 2 mg/Tag Rasagilin (in der ersten Woche 1 mg/Tag; n=132)
- Plazebo (n=138)
Primäres Zielkriterium war die Veränderung des Scores der Unified Parkinson’s Disease Rating Scale (UPDRS). Die UPDRS-Ausgangswerte lagen zwischen 24,5 und 25,9 Punkten. Unter der Behandlung mit 1 oder 2 mg/Tag Rasagilin sank der UPDRS-Score zunächst und bewegte sich nach 26 Wochen im Bereich der Ausgangswerte; in der Plazebo-Gruppe schritt die Verschlechterung der Symptomatik fort. Im Vergleich zur Plazebo-Gruppe betrug der adjustierte Unterschied der UPDRS-Veränderung seit Studienbeginn nach 26 Wochen für
- 1 mg/Tag Rasagilin –4,20 (95%-Vertrauensintervall –5,66 bis –2,73; p<0,001)
- 2 mg/Tag Rasagilin –3,56 (–5,4 bis –0,51; p<0,001)
Signifikant bessere Ergebnisse hatten die Rasagilin-behandelten Patienten auch bei den UPDRS-Subscores für Motorik und Alltagsaktivitäten sowie bei der Lebensqualität (Parkinson’s disease quality of life scale).
Die Studie wurde unter Doppelblindbedingungen für 26 Wochen fortgesetzt, indem die Patienten der Plazebo-Gruppe mit 2 mg/Tag Rasagilin behandelt wurden. Dieses „delayed onset“-Design soll Rückschlüsse auf eine mögliche neuroprotektive Wirkung der Substanz erlauben, für die es ja aus In-vitro-Versuchen Hinweise gibt. An dieser zweiten Studienphase nahmen 380 Patienten teil, 371 Patienten gingen in die Wirksamkeitsanalyse (Intention-to-treat) ein. Am Ende der zweiten Studienphase hatte sich der UPDRS-Score gegenüber dem Ausgangswert folgendermaßen verändert:
- 1 mg/Tag Rasagilin: +3,01 (n=122)
- 2 mg/Tag Rasagilin: +1,97 (n=119)
- Plazebo, dann 2 mg/Tag Rasagilin: +4,17 (n=130)
Der Unterschied der UPDRS-Veränderung seit Studienbeginn betrug für den sofortigen im Vergleich zum verzögerten Behandlungsbeginn mit 2 mg/Tag Rasagilin –2,29 Einheiten (95%-KI –4,11 bis –0,48; p=0,01). Dass bei frühzeitigem Behandlungsbeginn die Verschlechterung der UPDRS-Scores geringer ausfällt als bei verzögertem Behandlungsbeginn, wird als Ausdruck einer neuroprotektiven Wirkung interpretiert, die über die symptomatische Wirkung hinausgeht.
Kombinationstherapie mit Rasagilin
In zwei randomisierten, Plazebo-kontrollierten Doppelblindstudien wurde die Wirksamkeit einer Zusatztherapie mit Rasagilin bei Patienten mit motorischen Fluktuationen unter einer bestehenden Levodopa-Therapie untersucht. Primäre Zielgröße war in beiden Studien die Veränderung der durchschnittlichen täglichen Off-Zeit im Vergleich zum Ausgangswert, ermittelt anhand von Patiententagebüchern. In beiden Studien waren die Patienten durchschnittlich seit etwa 9 Jahren erkrankt und erhielten seit 7 bis 8 Jahren Levodopa. Die tägliche Off-Zeit betrug etwa 6 Stunden; während der On-Phasen bestanden während etwa 1 bis 1,5 Stunden quälende Dyskinesien.
Die PRESTO-Studie (Parkinson’s rasagiline: efficacy and safety in the treatment of „off“) wurde in Nordamerika mit 472 Patienten an 57 Zentren durchgeführt. Zusätzlich zu ihrer bisherigen Medikation erhielten die Patienten 26 Wochen lang
- 0,5 mg/Tag Rasagilin (n=164),
- 1 mg/Tag Rasagilin (n=149) oder
- Plazebo (n=159).
Die LARGO-Studie (Lasting effect in adjunct therapy with rasagiline given once daily) wurde mit 687 Patienten an 74 Zentren in Europa, Israel und Argentinien durchgeführt. Nach einer zwei- bis vierwöchigen Plazebo-Phase, in der die bisherige Therapie noch optimiert werden konnte, erhielten die Patienten 18 Wochen lang im Double-Dummy-Verfahren
- 1 mg/Tag Rasagilin (n=231),
- 200 mg Entacapon mit jeder Levodopa-Dosis (n=227) oder
- Plazebo anstelle beider Medikationen (n=229).
In beiden Studien durfte die Levodopa-Dosis in den ersten 6 Wochen noch reduziert werden.
Die Zusatztherapie mit Rasagilin führte in beiden Studien signifikant stärker als Plazebo zu einer Verringerung der Off-Zeit (Abb. 2). Die Wirkung entsprach der mit Entacapon erreichbaren. Die Abnahme der Off-Zeit korrespondierte mit einer signifikanten Zunahme der On-Zeiten, überwiegend ohne quälende Dyskinesien. In der PRESTO-Studie war in der 1-mg-Gruppe etwa ein Drittel der gewonnenen On-Zeit mit behindernden Dyskinesien verbunden; durch eine – hier nach Woche 6 nicht mehr erlaubte – Reduktion der Levodopa-Dosis wäre dem möglicherweise zu begegnen gewesen.
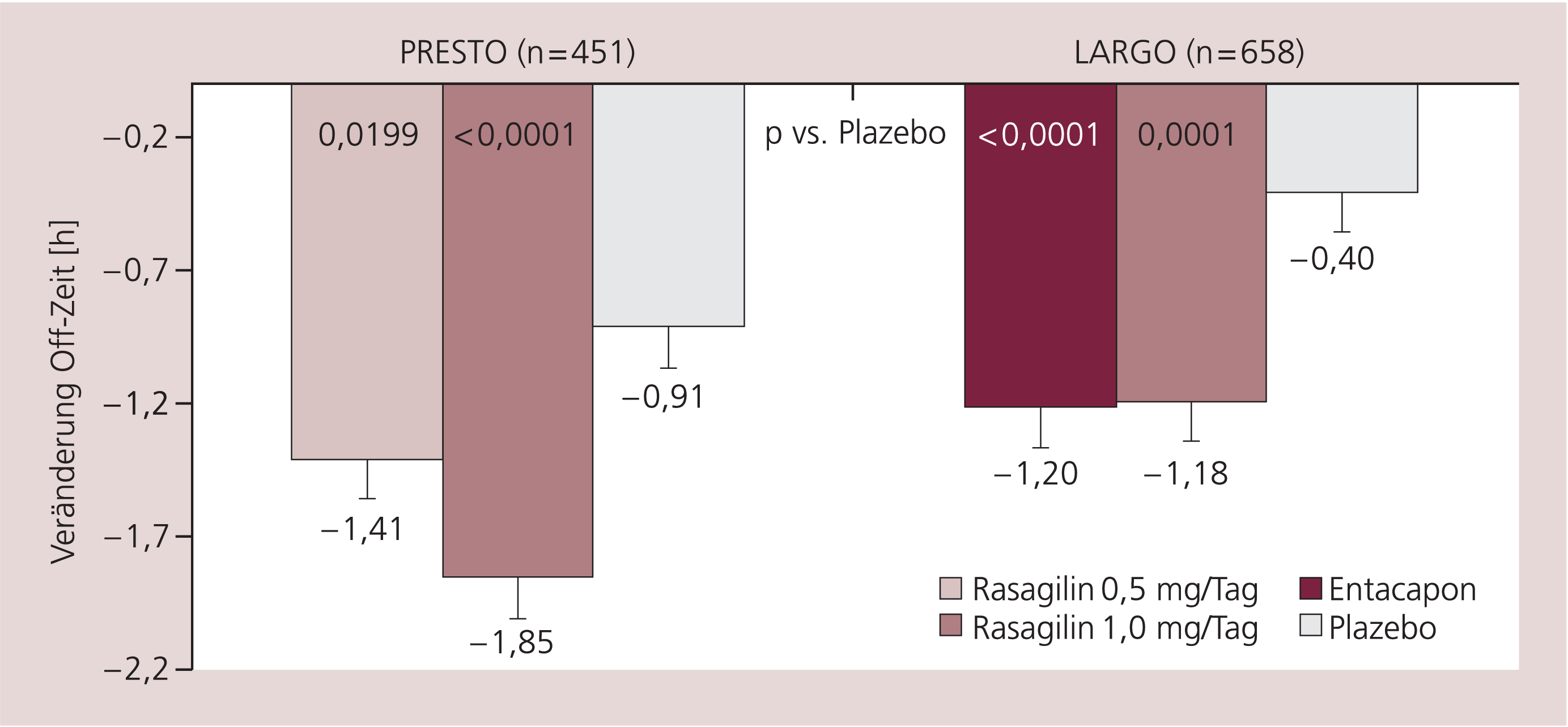
Abb. 2. Eine Zusatztherapie mit Rasagilin verringert die Off-Zeit bei Parkinson-Patienten mit motorischen Fluktuationen [PRESTO, LARGO; nach Lachenmayer]
Weiterhin kam es in den aktiv behandelten Gruppen zu einer Verbesserung der UPDRS-Subscores für motorische Funktionen in der On-Phase sowie für Alltagsaktivitäten während der Off-Phase.
Verträglichkeit
In der Monotherapie-Studie gab es keine Unterschiede im Auftreten unerwünschter Wirkungen zwischen den Rasagilin-behandelten Gruppen und der Plazebo-Gruppe, abgesehen von einem signifikant, aber geringfügig (+4,04 mmHg) erhöhten systolischen Blutdruck in der 2-mg-Rasagilin-Gruppe. Für die gute Verträglichkeit sprechen auch die niedrigen Abbruchraten von 4 % bzw. 6 % mit 1 bzw. 2 mg Rasagilin (Plazebo: 2 %).
In den beiden Studien zur Kombinationstherapie, also bei schwerer kranken Patienten, lagen die Abbruchraten bei 10 bis 15 %; sie waren mit Rasagilin auf Plazebo-Niveau, in der LARGO-Studie sogar darunter. In der PRESTO-Studie wurden folgende unerwünschte Wirkungen signifikant häufiger berichtet als in der Plazebo-Gruppe: mit 0,5 mg/Tag Rasagilin Gleichgewichtsstörungen (5,5 vs. 0,6 %); mit 1 mg/Tag Rasagilin Gewichtsabnahme (9,4 vs. 2,5 %), Erbrechen (6,7 vs. 1,3 %) und Anorexie (5,4 vs. 0,6 %); mit Rasagilin (beide Dosierungen) Dyskinesien (18 vs. 10 %). In der LARGO-Studie waren alle drei Studiengruppen ähnlich in Bezug auf Laborwerte, Ergebnisse der klinischen Untersuchung, EKG, Vitalzeichen und die Häufigkeit unerwünschter Wirkungen.
Rasagilin sollte nicht zusammen mit anderen MAO-Hemmern, Sympathomimetika, Pethidin, Fluvoxamin oder Fluoxetin angewendet werden. Eine Beschränkung der Tyramin-Aufnahme ist nicht erforderlich.
Insgesamt wird Rasagilin als gut verträglich beurteilt. Experten empfehlen seinen Einsatz schon im frühen Stadium der Erkrankung – zunächst als Monotherapie, aber durchaus auch früh kombiniert mit einem Dopamin-Agonisten. Für den frühzeitigen Einsatz sprechen auch die Hinweise auf neuroprotektive Wirkungen von Rasagilin, die allerdings durch weitere Studien erhärtet werden müssen.
Quellen
Prof. Dr. Peter Riederer, Würzburg, Prof. Dr. med. Lutz Lachenmayer, Prof. Dr. med. Horst Przuntek, Bochum, Satellitensymposium „Rasagilin – Eine neue Therapieoption für Morbus Parkinson“, veranstaltet von Lundbeck GmbH und Teva Pharma GmbH im Rahmen des 4. Deutschen Parkinson-Kongresses, Frankfurt/M., 4. März 2005.
Parkinson Study Group. A controlled trial of rasagiline in early Parkinson disease. The TEMPO study. Arch Neurol 2002;59:1937–43.
Rascol O, et al. Rasagiline as an adjunct to levodopa in patients with Parkinson’s diesease and motor fluctuations (LARGO, Lasting effect in adjunct therapy with rasagiline given once daily, study): a randomised, double-blind parallel-group trial. Lancet 2005;365:947–54.
Parkinson Study Group. A randomized placebo-controlled trial of rasagiline in levodopa-treated patients with Parkinson disease and motor fluctuations. The PRESTO study. Arch Neurol 2005;62:241–8.
Fachinformation Azilect®. www.emea.eu.int/humandocs/Humans/EPAR/azilect/azilect.htm (Zugriff am 7.4.2005).
Psychopharmakotherapie 2005; 12(03)
