Michael Paulzen, Miriam Kirchner und Tobias Schreckenbach, Aachen
Eine Task Force der American Psychiatric Association (APA) befand vor exakt 30 Jahren – aus heutiger Sicht beinahe voreilig: „There is no data to suggest that long-term therapeutic use of benzodiazepines by patients commonly leads to dose escalation or to recreational abuse“ [39]. Mittlerweile dürfte jedem bekannt sein, dass diese Annahme lange überholt ist. Während die – jedenfalls zulasten der gesetzlichen Krankenversicherung erfolgenden – Verordnungen (defined daily doses [DDD], definierte Tagesdosierungen) traditioneller Tranquilizer (Anxiolytika) seit dem Jahr 2010 konstant abgenommen haben (–31,2 % zwischen 2010 und 2019), stiegen die Verordnungszahlen der Gabapentinoide Gabapentin und Pregabalin konstant. Dabei lag die Zuwachsrate der Verordnung von Gabapentin im gleichen Zeitraum bei nahezu moderaten 38 % (von 37 Mio. DDD auf 51 Mio. DDD). Viel gravierender stiegen jedoch die Verordnungszahlen von Pregabalin, die in diesem Zeitraum um annähernd 117 % (von 54 Mio. DDD auf 117 Mio. DDD im Jahr 2019) zulegten [41] (Abb. 1). In der Konsequenz bedeutet dieser Zuwachs, dass im Jahr 2019 zulasten der gesetzlichen Krankenversicherung beinahe doppelt so viele definierte Tagesdosierungen der beiden Wirkstoffe Pregabalin und Gabapentin verordnet wurden als für die gesamte Gruppe der Tranquilizer zusammen (168 Mio. DDD vs. 86 Mio. DDD) [30].
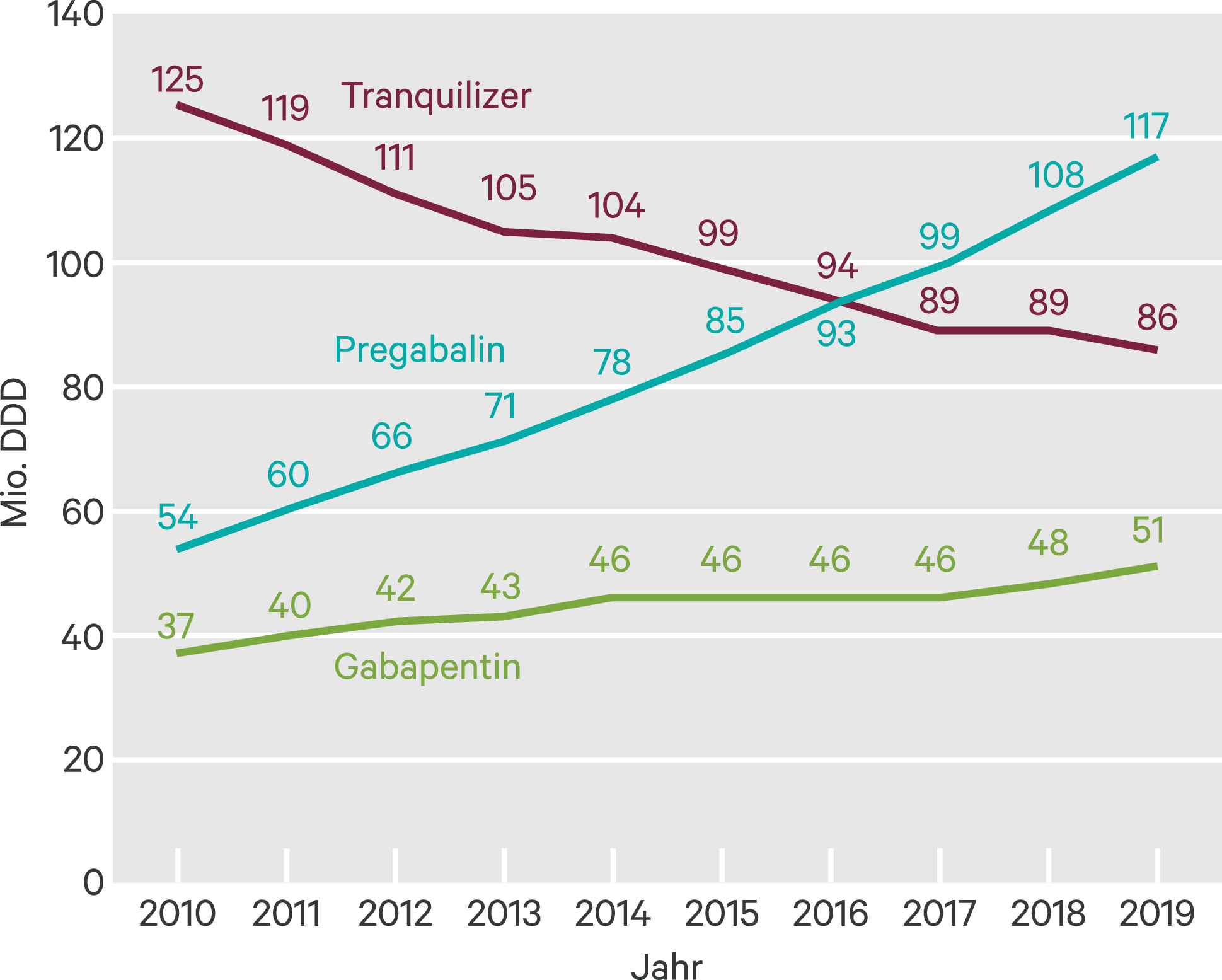
Abb. 1. Verordnungszahlen traditioneller Tranquilizer sowie der sogenannten Gabapentinoide Gabapentin und Pregabalin (eigene Darstellung nach [41])
Dabei wurde über ein mögliches Abhängigkeitspotenzial von Gabapentinoiden schon früh berichtet [11]. So zeigte bereits 2011 eine Auswertung der UAW-Datenbank der Arzneimittelkommission der Deutschen Ärzteschaft Hinweise auf ein Missbrauchspotenzial, das im selben Jahr auch in die Fachinformation von Pregabalin aufgenommen wurde [2]. Jüngere Ausführungen aus dem Jahr 2020 weisen dann noch einmal besonders darauf hin, dass bei suchtkranken Menschen die Anwendung von Pregabalin vermieden werden sollte [7, 24]. Ebenso sollte unter der Behandlung mit Pregabalin auf Anzeichen einer sich entwickelnden Abhängigkeit geachtet werden.
Der vorliegende Beitrag verschafft einen Überblick über das Vorgehen beim Absetzen von Tranquilizern und Gabapentinoiden. Ziel ist es, dem Leser einen Überblick über das konkrete Vorgehen beim Absetzen der Substanzen zu geben und hierbei die aktuellen Leitlinien mit in den Fokus zu nehmen. Grundsätzlich besteht in der guten klinischen Praxis die einschlägige Meinung, dass der Verordner eines Psychopharmakons bereits zum Zeitpunkt des Behandlungsbeginns auch das Absetzen mit in die Behandlungsplanung einbeziehen sollte. Dies gilt umso mehr, als dass die meisten Tranquilizer ohnehin nur für eine Kurzzeitbehandlung zugelassen sind und damit eine Beendigung der Therapie schon sehr frühzeitig ins Auge gefasst werden sollte.
Absetzen von Benzodiazepinen und Z-Substanzen
Einleitung, Epidemiologie und Historie
Benzodiazepine und Z-Substanzen („Benzodiazepin-Analoga“, „Z-Drugs“) gehören in vielfältigen Indikationen zu den häufig verordneten Arzneimitteln im ambulanten und stationären Bereich [41]. Typische Indikationen für die Verschreibung von Benzodiazepinen und Z-Substanzen (in Deutschland vor allem Zopiclon und Zolpidem, aber auch Eszopiclon) sind beispielsweise Schlafstörungen, aber auch Angst- und Erregungszustände sowie sämtliche denkbaren Zustände von vorübergehenden oder auch andauernden „psychischen Missempfindungen“.
Für die Verordnung dieser Substanzen existieren klare Empfehlungen für eine zeitliche Limitierung der Verschreibungsdauer [14]. Aus unterschiedlichen Gründen erfolgt jedoch in nicht wenigen Fällen eine Dauer- bzw. eine nicht indikationsgerechte Verordnung von Benzodiazepinen und Z-Substanzen [8].
Schätzungsweise sind in Deutschland etwa 1,2 bis 1,5 Millionen Menschen abhängig von Tranquilizern und Schlafmitteln. Hinzu kommen noch etwa 300 000 bis 400 000 Menschen, die von weiteren Arzneimitteln, vor allem Opioid-haltigen Schmerzmitteln, abhängig sind. Das sind insgesamt etwa 1,5 bis 1,9 Millionen Medikamentenabhängige [50]. Dies entspricht in etwa auch der Zahl Alkoholabhängiger in Deutschland.
Nur etwa 2 % der Betroffenen haben Kontakt zum Suchthilfesystem [50]. Zwar gibt es aktuell einen rückläufigen Trend der Verordnungshäufigkeit, gleichzeitig besteht jedoch eine massive Zunahme von Verordnungen über Privatrezepte, die von der Statistik nicht erfasst werden [23, 46]. Dadurch entgehen Ärzte einer möglichen Überprüfung ihrer nicht leitliniengerechten Verordnung durch die Prüfinstanzen der Krankenkassen. Dass Benzodiazepine dabei vom Patienten aus eigener Tasche bezahlt werden müssen, scheint unproblematisch angesichts ihrer geringen Kosten (50 Tbl. Diazepam à 10 mg kosten lediglich etwa 13,15 Euro). Z-Substanzen sind zwar insgesamt teurer, bewegen sich mit Kosten um die 15 Euro für 20 Tabletten Zopiclon à 7,5 mg aber insgesamt noch in einem niedrigen Preisniveau.
Prädiktiv für die Verordnung und auch die langandauernde Einnahme von Tranquilizern, Hypnotika und Anxiolytika sind höheres Lebensalter, weibliches Geschlecht, Patienten mit Suchterkrankungen und chronischen somatischen bzw. anderweitigen psychiatrischen Erkrankungen, aber auch medizinisches Personal [14].
Die Geschichte der Benzodiazepine geht zurück bis in die 50er-Jahre. Die erste Substanz auf dem Markt war Chlordiazepoxid, 1963 folgte Diazepam, gefolgt von zahlreichen jeweils abgeänderten Substanzen. Anfang der 90er-Jahre erfolgte unter starker Bewerbung eines „nicht vorhandenen Abhängigkeitspotenzials“ die Einführung der Z-Substanzen. Benzodiazepine bestehen namensgebend aus einem System aus einem Benzol- und einem Diazepin-Ring. Die Z-Substanzen haben strukturelle Ähnlichkeiten mit Benzodiazepinen, besitzen jedoch kein Benzodiazepin-Grundgerüst.
Wichtige Aspekte im Umgang mit Benzodiazepinen und Z-Substanzen sind in Kasten 1 zusammengefasst.
Kasten 1. Wichtige Aspekte beim Umgang mit der Verordnung von Benzodiazepinen und Z-Substanzen
- Die Indikationen sind nosologieübergreifend und primär symptomorientiert.
- Die Indikation ist wegen der Abhängigkeitsgefahr sehr sorgfältig zu stellen.
- Die niedrigste notwendige Dosis ist zu wählen.
- Eine Anwendungsdauer von vier bis sechs Wochen sollte möglichst nicht überschritten werden.
- Therapiealternativen sind stets zu überprüfen.
- Eine gleichzeitige Verordnung verschiedener Benzodiazepine ist zu vermeiden.
- Bei Abhängigkeitserkrankungen sollte auf Benzodiazepine möglichst verzichtet werden.
- Es besteht eine Kreuztoleranz von Benzodiazepinen und Z-Substanzen mit Alkohol.
Abhängigkeitsrisiko
Die Problematik einer nicht-leitliniengerechten (Dauer-)Verordnung von Benzodiazepinen und Z-Substanzen liegt in der potenziellen Entwicklung einer Abhängigkeit mit entsprechendem Wirkverlust und Toleranzentwicklung, der Notwendigkeit einer fortschreitenden Dosissteigerung, dem Auftreten von Entzugssymptomen beim Versuch einer Reduktion oder Verzicht auf die Substanzen und unerwünschten, als negativ erlebten Arzneimittelwirkungen. Unerwünschte Arzneimittelwirkungen (UAW) sind beispielsweise eine affektive Indifferenz, Sturzgefährdung, kognitive Funktionseinschränkungen bis hin zur möglichen Entwicklung demenzieller Syndrome, Einschränkungen der Fahrtauglichkeit, morgendlicher „Hangover“ („Wirküberhang“) und die Entstehung depressiver Symptome [14, 38].
Im Vergleich zu den meisten „Rauschdrogen“ kann es im Rahmen der längerfristigen Einnahme von Benzodiazepinen und Z-Substanzen jedoch auch zur Entwicklung einer Niedrigdosisabhängigkeit („low dose dependence“) kommen. Von einer Niedrigdosisabhängigkeit spricht man bei Tagesdosen, die 20 mg Diazepam-Äquivalente nicht übersteigen. Hierbei besteht eine sowohl körperliche als auch psychische Abhängigkeit meist ohne die Aspekte Dosissteigerung und Toleranzentwicklung. Besonders betroffen scheinen hiervon geriatrische Patienten zu sein [38], die Benzodiazepine häufig zum Schlafen einnehmen, ohne dass alle Kriterien einer Abhängigkeit (Toleranzentwicklung, Craving, Dosissteigerung, Kontrollverlust etc.) erfüllt sind.
Neurobiologie
Benzodiazepine und Z-Substanzen entfalten ihre Hauptwirkung am GABAA-Rezeptorkomplex (GABA: gamma-aminobutyric acid, Gamma-Aminobuttersäure). GABA ist der wichtigste endogene inhibitorisch wirkende Neurotransmitter im zentralen Nervensystem des Menschen. Der GABAA-Rezeptor besteht aus mehreren Untereinheiten und fungiert als ligandengesteuerter Chloridionenkanal, der bei Bindung von GABA in seiner geöffneten Konformation stabilisiert wird, wodurch letztlich ein Anioneneinstrom eine Hyperpolarisation bewirkt.
Benzodiazepine und Z-Substanzen wirken als Modulatoren auf die Wirkung der körpereigenen GABA, indem sie deren Affinität am Rezeptor erhöhen, wodurch die Öffnungswahrscheinlichkeit des GABAA-Rezeptors zunimmt.
Benzodiazepine wirken klinisch anxiolytisch, antikonvulsiv, muskelrelaxierend, sedativ, hypnotisch, amnestisch und teils auch euphorisierend [28, 49]. Sie haben zudem eine gewisse atemdepressive Wirkung, die jedoch vor allem in Kombination mit anderen Substanzen (insbesondere Opioiden) eine Rolle spielt. Z-Substanzen wirken in erster Linie hypnotisch und amnestisch, weniger auch antikonvulsiv, anxiolytisch und muskelrelaxierend. Des Weiteren wirken Benzodiazepine indirekt auf die Aktivierung dopaminerger Neurone im mesolimbischen System, wodurch Belohnungseffekte und somit ein Abhängigkeitspotenzial entstehen [45].
Die verschiedenen Benzodiazepine unterscheiden sich hinsichtlich ihrer Pharmakokinetik und Rezeptoraffinität und somit klinisch bezüglich ihrer Wirkdauer und des Wirkprofils (eher hypnotisch und amnestisch oder eher anxiolytisch und relaxierend). Weltweit sind etwa 35 verschiedene Benzodiazepine auf dem Markt.
Benzodiazepine werden bei oraler Applikation schnell resorbiert und weisen eine hohe Plasma-Eiweißbindung auf. Die Metabolisierung erfolgt auf unterschiedliche Art und Weise in der Leber durch Phase-I- und/oder Phase-II-Stoffwechselwege. Viele Benzodiazepine haben aktive Metaboliten, beispielsweise wird Diazepam zu Oxazepam und Nordazepam mit unterschiedlich langen Halbwertszeiten metabolisiert.
Im Rahmen einer dauerhaften Einnahme von Benzodiazepinen kommt es zu einer Abnahme der Rezeptoraffinität für GABA [4], wodurch eine Toleranzentwicklung und die Notwendigkeit einer immer weiteren Dosissteigerung entstehen. Verschiedene Untersuchungen postulieren einen anzunehmenden Verlust der erwünschten sedierenden Wirkung ab einer Einnahme von ein bis vier Wochen [48]. Bei Dosisreduktion, beispielsweise im Rahmen einer Entzugsbehandlung, kommt es nach vorherigen Adaptationsprozessen im Rahmen einer länger andauernden Einnahme zu einem Überwiegen exzitatorischer Aktivität mit entsprechend „umgekehrten“ Symptomen wie Schlafstörungen, Angst, Anspannung und Unruhe bis hin zu epileptischen Anfällen und Delir.
Als spezifisches Antidot im Rahmen einer Benzodiazepin-Intoxikation wirkt Flumazenil, ein kompetitiver Antagonist am GABA-Rezeptor. Zu beachten ist hier die deutlich kürzere Halbwertszeit von Flumazenil im Vergleich mit den meisten Benzodiazepinen, sodass wiederholte Gaben notwendig sind.
Prävention
Um die Entstehung eines schädlichen Gebrauchs oder einer Abhängigkeit möglichst zu vermeiden, empfiehlt sich bereits vor Verordnung eine kritische Überprüfung der Indikation und eine sorgfältige Aufklärung des Patienten. Hilfreich ist es auch, mit dem Patienten eine konkrete Dauer der Medikation vorzubesprechen und festzulegen. Es empfiehlt sich, die niedrigste effektive Dosis zu wählen und die Möglichkeit alternativer Therapien beständig zu überprüfen. Besonders kritisch sollte die Verordnung bei Abhängigkeitserkrankten erfolgen [14].
Diagnose einer Abhängigkeit/Konsumstörung von Benzodiazepinen und Z-Substanzen
Die Diagnose einer Abhängigkeit von Benzodiazepinen oder Z-Substanzen erfolgt anhand der Diagnosekriterien psychischer Störungen der Weltgesundheitsorganisation, die für jegliche Substanzen gelten: Eine Abhängigkeit von einer Substanz liegt vor, wenn mindestens drei der sechs Kriterien – Toleranzentwicklung, starkes Verlangen nach der Substanz (Craving), Kontrollverlust über den Konsum, körperliches Entzugssyndrom nach Absetzen, Interessenverlust zugunsten der Substanz und fortgesetzter Konsum trotz schädlicher Folgen – erfüllt sind. In Hinblick auf die Abhängigkeit von Benzodiazepinen oder Z-Substanzen ergeben sich jedoch im Vergleich mit anderen Substanzen Besonderheiten im Konsum- und Verhaltensmuster. Typisch sind beispielsweise das Horten von Arzneimitteln, das Drängen auf eine weitere Rezeptierung, Manipulationen in Bezug auf die Ausstellung von Rezepten („Rezept verloren“, Patienten wenden sich an Notdienste), „Doktor-Hopping“ (häufige Arztwechsel, Verschreibung der Substanzen über verschiedene Fachärzte, auf Privatrezepte), Auftreten von neuropsychiatrischen Problemen wie Konzentrationsstörungen und Wesensänderungen, ständige Gereiztheit und Konfliktvermeidung [43]. Unterstützend zu den anamnestischen Angaben und zur Detektion eines eventuell darüber hinaus bestehenden anderweitigen Substanzkonsums kann eine Benzodiazepin-Einnahme im Urin nachgewiesen werden. Benzodiazepine werden durch die meisten Standard-Drogenscreenings erfasst. Die Bestimmung einer Plasmakonzentration ist eher unüblich, Haaranalysen erfolgen gelegentlich im Rahmen forensischer Fragestellungen. Die Einnahme von Z-Substanzen wird im Rahmen von Standard-Drogenscreenings meist nicht erfasst, hierzu bedarf es in der Regel der Verwendung spezieller Einzeltests.
Grundsätzliche Empfehlungen
In der Entzugsbehandlung von Benzodiazepinen und Z-Substanzen gilt als entscheidender Grundsatz: kein abruptes Absetzen, sondern eine schrittweise Ausdosierung über mehrere Wochen bis Monate, um mögliche Absetzphänomene so gering wie möglich zu halten. Hinsichtlich dieses Vorgehens liegen mehrere Metaanalysen [13, 29, 36], und Therapieempfehlungen [25, 26] vor. Bei schlagartigem Absetzen ist die Gefahr des Auftretens von Absetzphänomenen bis hin zu schweren Entzugssyndromen mit Entwicklung eines Delirs oder epileptischen Entzugsanfalls sehr hoch (Tab. 1) [37]. Auch sind für die meisten Patienten die heftigen Entzugserscheinungen nicht tolerabel [21]. Eine zusätzliche, gezielte Psychotherapie führt zu einer erhöhten Wirksamkeit der Entzugsbehandlung vor allem bei Patienten mit Schlaf- und Panikstörungen [29].
Tab. 1. Entzugssymptome beim Absetzen von Benzodiazepinen und Z-Substanzen
|
Psychisch |
Vegetativ |
Neurologisch |
Komplikationen |
|
|
|
|
Indikation von Benzodiazepinen und Absetzen nach Verordnung bei korrekter Indikation
Im klinischen Alltag ergeben sich mehrere Indikationen für die Verordnung von Benzodiazepinen. Benzodiazepine werden in erster Linie symptomorientiert verordnet und kommen somit bei einer Vielzahl von Erkrankungen zum Einsatz. Typische Indikationen sind akute Angst- und Erregungszustände, beispielsweise im Rahmen akut-psychiatrischer Aufnahme- und Notfallsituationen [34], in der Behandlung des Alkoholentzugs [15], im Rahmen der Behandlung von akuten epileptischen Anfällen und zur Prämedikation vor Operationen. In diesen Indikationen erfolgt die Verordnung von Benzodiazepinen über einen definierten, kurzen Zeitraum, und dient vorrangig der Reduktion einer akuten Symptomlast.
Die Fachinformation zu Diazepam empfiehlt ein anschließendes „schrittweises Absetzen“ der Substanz ab einer täglichen Einnahme von Diazepam über einen Zeitraum von sieben Tagen. Eine konkrete Empfehlung zur Abdosierung erfolgt leider weder in der Fachinformation noch in der aktuellen Leitlinie [14]. Nach einer einwöchigen Einnahme von beispielsweise 20 mg Diazepam/Tag erfolgt im stationären Setting üblicherweise eine pragmatisch-schematische Abdosierung auf 10 mg, dann 5 mg Tagesdosis mit anschließendem Absetzen der Substanz. Nach mehrwöchiger Einnahme erfolgt in der Regel eine über mehrere Tage gestreckte Reduktion. Die Fachinformation wie auch die Leitlinie empfehlen eine Limitierung der Verordnung von Benzodiazepinen auf die Dauer von vier bis maximal sechs Wochen.
Kasuistik 1: Benzodiazepine
Die 53-jährige Frau H. wird aufgrund einer akuten psychotischen Exazerbation einer paranoiden Schizophrenie stationär aufgenommen. Aufgrund quälender akustischer Halluzinationen, die bereits in der Vergangenheit einmalig zu einem Fenstersprung der Patientin führten, wurde sowohl in der ambulanten als auch in der stationären Behandlung mit gutem Erfolg Lorazepam zur Anxiolyse verordnet. Initial etablierte sich die Medikation als vorübergehend mit einer Dauer von maximal fünf Wochen und konnte während stationärer Aufenthalte komplikationslos kleinschrittig abgesetzt werden. Aus einer zunehmenden Zustandsverschlechterung bei chronischem Verlauf der Erkrankung mit wiederkehrenden angstbesetzten psychotischen Episoden, aber auch bei einer anhaltenden Residualsymptomatik resultierte eine nunmehr bereits seit mehreren Jahren bestehende Dauerverordnung von Lorazepam. Hierunter kam es zu einer deutlichen Toleranzentwicklung. Zudem bestanden kognitive Defizite und eine deutliche Leistungsminderung, die sowohl dem chronischen Verlauf der Erkrankung aus dem schizophrenen Formenkreis als auch den unerwünschten Langzeiteffekten der Benzodiazepin-Einnahme zugeordnet werden können.
Wir vereinbarten mit der Patientin während der stationären Behandlung die Ausdosierung von Lorazepam, das vor der Aufnahme mit einer Tagesdosis von 2 mg eingenommen wurde. Es erfolgte eine Dosisreduktion in Schritten von 0,5 mg bis zu einer Tagesdosis von 1 mg, im Anschluss daran in 0,25-mg-Schritten über mehrere Tage. Bei einer Tagesdosis von 0,25 mg kam es akut zum Auftreten einer deliranten Symptomatik mit verstärkten Ängsten, Schwitzen, Desorientiertheit und optischen Halluzinationen. Nach erneuter Aufdosierung von Lorazepam auf eine Tagesdosis von 1 mg war die Symptomatik rasch rückläufig.
In Hinblick auf die limitierten Möglichkeiten einer weiteren Dosisreduktion von Lorazepam wurde diese letztlich auf eine Äquivalenzdosis von Diazepam umgestellt und in einer kleinschrittigen Titration in Tropfenform im Verlauf ausgeschlichen. Hierunter traten keine deliranten Symptome mehr auf und Frau H. konnte in die ambulante Weiterbehandlung entlassen werden.
Indikation von Z-Substanzen und Absetzen nach Verordnung bei korrekter Indikation
Der Einsatz von Zopiclon, Zolpidem und Eszopiclon erfolgt definitionsgemäß im Rahmen von Schlafstörungen. Nach Angaben der Fachinformation beschränkt sich die Verordnung auf eine „Kurzzeitbehandlung“ (maximal vier Wochen) bei Schlafstörungen von „klinisch bedeutsamen Schweregrad“. Auch in Bezug auf das Absetzen von Z-Substanzen existieren keine konkreten Empfehlungen. Pragmatisch erfolgt auch hier meist eine Dosisreduktion (beispielsweise Reduktion von 7,5 mg Zopiclon auf 3,75 mg) mit anschließendem Absetzen der Substanz, alternativ kann eine alternierende Gabe (Tage mit und ohne Einnahme der Medikation im Wechsel) erwogen werden.
Klinischer Verlauf des Absetzens/Entzugs, therapeutische Maßnahmen
Die Beschwerden im Rahmen eines Entzugs von Benzodiazepinen und Z-Substanzen sind vielfältig und äußern sich in Form psychischer, neurologisch-somatischer und allgemein-vegetativer Symptome (Tab. 1) [35]. Als Faustregel kann angenommen werden, dass mit zunehmender Einnahmedauer der Substanzen und steigender Dosis ein Absetzen erschwert wird und die Wahrscheinlichkeit des Auftretens von Entzugserscheinungen bzw. Absetzphänomenen steigt. Bei zu schnellem oder abruptem Absetzen besteht das Risiko schwerwiegender Komplikationen wie epileptischer Anfälle oder Delirien. In der Regel sistieren Entzugserscheinungen maximal vier Wochen nach Beendigung der Medikation [35].
Abhängig vom ursprünglichen Kontext der Verordnung der Substanzen kann es im Verlauf des Absetzens neben typischen Absetzphänomenen auch zum Wiederauftreten der ursprünglichen Symptome der Grunderkrankung (z. B. Schlafstörungen im Rahmen einer Depression, Angst- und Paniksymptome) kommen, die teilweise nur schwer von Absetzphänomenen abgrenzbar sind. Zu unterscheiden sind hierbei
- Entzugssymptome (unabhängig von der Grunderkrankung, meist abrupt beginnend in klarer Assoziation mit Reduktion, eher kurzanhaltend, häufig körperliche Symptome),
- Rebound-Symptome (Symptome entsprechend der Grunderkrankung, beispielsweise Angst oder Schlafstörung, wenige Tage anhaltend) und
- Rezidiv- bzw. Rückfall(„Relapse“)-Symptome (Symptome entsprechend der Grunderkrankung, mit Latenz einsetzend nach initial erfolgreichem Abklingen der Symptome, danach anhaltend) (vgl. Tab. 2).
Tab. 2. Mögliche Absetzphänomene nach abruptem Absetzen von Benzodiazepinen und Z-Substanzen [1]
|
Symptome |
Charakteristika |
|
Rebound-Symptome |
|
|
Rezidiv-Symptome |
|
|
Entzugssymptome |
|
Je nach Zuordnung der jeweiligen Symptome empfiehlt sich ein unterschiedliches Vorgehen. Während Entzugssymptome häufig transient sind oder durch Verlangsamung der Reduktion gemildert werden können, ist bei erneutem Auftreten von Symptomen der Grunderkrankung eine spezifische Behandlung der zugrundeliegenden Erkrankung notwendig.
Zur Behandlung der im Rahmen des Absetzens von Benzodiazepinen und Z-Substanzen auftretenden Entzugserscheinungen gibt es keine speziell zugelassenen Substanzen. Entsprechend erfolgt die Behandlung symptomorientiert, beispielsweise durch Verordnung von sedierenden Trizyklika, H1-Antihistaminika und niedrigpotenten Antipsychotika bei Schlafstörungen, Magnesium bei Muskelverspannungen und -zuckungen, Dimenhydrinat bei Übelkeit, Haloperidol bei deliranten und psychotischen Symptomen.
Ein weiterer wichtiger Baustein in der Behandlung der Abhängigkeit sind psychotherapeutische und psychoedukative Maßnahmen. Häufig unterschätzt, jedoch gut in ihrer Wirksamkeit belegt sind „brief interventions“, also die fokussierte Ansprache der vermuteten Suchtproblematik durch einen Arzt mit ergänzender Aushändigung von Informationsmaterial und Meldeadressen [33]. In der langfristigen Behandlung der Arzneimittelabhängigkeit wird die Kombination aus kognitiver Verhaltenstherapie und motivationalen Therapien, beispielsweise „motivational interviewing“, empfohlen [38].
Bezüglich der Prognose zeigen sich im Vergleich zu anderen Substanzabhängigkeiten viele Hinweise auf eine gute Wirksamkeit multimodaler Therapien mit Abstinenzraten bis zu 85 % [35, 38]. Positive Effekte der Abstinenz ergeben sich vor allem auf kognitive Funktionen, Häufigkeit von Stürzen und Schlafverhalten [38].
Entzug von Benzodiazepinen und Z-Substanzen nach längerer/missbräuchlicher Einnahme
Zum konkreten Vorgehen des Absetzens von Benzodiazepinen und Z-Substanzen nach langandauernder bzw. hochdosierter Einnahme gibt es vonseiten der aktuellen deutschen Leitlinie keine konkreten Empfehlungen für ein Reduktionsschema. Als gesichert gilt jedoch, dass ein Absetzen von Benzodiazepinen und Z-Substanzen nach längerer Einnahme nicht abrupt, sondern schrittweise erfolgen soll („tapering off“). Zudem empfiehlt sich die Einbeziehung der Patienten in die Gestaltung des Reduktionsschemas [38]. In der Regel sollten Reduktionsschritte zu Beginn der Entzugsbehandlung größer sein als gegen Ende der Abdosierung [14].
In der Praxis empfiehlt sich, mit den Patienten einen klar definierten Zeitraum abzusprechen, um einerseits ein zu schnelles Absetzen und dadurch das Risiko starker Entzugserscheinungen und Komplikationen zu vermeiden, andererseits, um einen zu langen Absetzprozess und eine damit verbundene gedankliche Fokussierung und Etablierung eines „morbid focus“ zu verhindern [26].
Dafür, ob ein Entzug homolog (Abdosierung der ursprünglich verordneten Substanz) oder durch Umstellung einer kurz- auf eine langwirksame Substanz (z. B. von Lorazepam auf Diazepam) erfolgen sollte, gibt es ebenfalls keine klare Empfehlung [44]. Bei Einnahme mehrerer unterschiedlicher Benzodiazepine empfiehlt sich unter Berücksichtigung einer möglichen Kumulationsgefahr die Umstellung auf eine äquivalente Dosis eines mittellang oder lang wirksamen Präparats. Insbesondere in Hinblick auf schwierige letzte Reduktionsschritte im Niedrigdosisbereich hat sich die Umstellung auf ein in Tropfenform verfügbares Präparat (z. B. Diazepam) in der Praxis bewährt. Auch Z-Substanzen können anhand von Äquivalenztabellen auf ein in Tropfenform verfügbares Benzodiazepin-Präparat umgerechnet und umgestellt werden. Zu berücksichtigen sind darüber hinaus die zu erwartenden Schwankungen der Plasmaspiegel bei Substanzen mit eher kürzeren Halbwertszeiten.
Insbesondere bei Hochdosiskonsum wird mit hoher Übereinstimmung empfohlen, zunächst auf ein mittel- oder langwirksames Benzodiazepin umzustellen, wodurch die Plasmaspiegelschwankungen über den Tag vermindert und die Abbruchquote und frühe Rückfallrate gesenkt werden [21]. Sinnvoll ist eine solche Umstellung in jedem Fall bei polytoxikomanem Suchtverhalten bzw. gleichzeitigem Konsum unterschiedlicher Benzodiazepine [43]. Die Abdosierung mit z. B. Diazepam als lang wirksamem Benodiazepin ist dadurch vorteilhaft, dass sein Plasmaspiegel auch bei sehr niedrigen Dosierungen gegen Behandlungsende über den Tag kaum Schwankungen aufweist und dadurch den Entzug erträglicher sein lässt, allerdings besteht hier eine hohe Akkumulationsgefahr, vor allem bei Mehrfachgaben am Tag.
Um eine bessere Vergleichbarkeit untereinander herzustellen, bietet es sich an, Benzodiazepine, deren Metaboliten und Z-Substanzen durch den Vergleich von Halbwertszeiten (HWZ) und Äquivalenzdosen miteinander in Beziehung zu setzen (Tab. 3).
Tab. 3. Ausgewählte Benzodiazepine und Z-Substanzen mit Eliminationshalbwertszeiten (HWZ) und Äquivalenzdosen in Bezug auf 10 mg Diazepam (eigene Darstellung nach [1, 27])
|
Wirkstoff |
HWZ [h] |
Therapeutisch wirksame(r) Metabolit(en) |
HWZ |
Äquivalenzdosisa [mg] |
|
Diazepam |
30–56 |
N-Desmethyldiazepam |
80–103 |
10 |
|
Oxazepam |
4–15 |
|||
|
Alprazolam |
10–14 |
α-Hydroxyalprazolam |
12–15 |
1 |
|
Bromazepam |
15–28 |
3-OH-Bromazepam (nicht aktiv) |
– |
6 |
|
Chlordiazepoxid |
6–38 |
N-Desmethyl-Chlordiazepoxid |
10–18 |
25 |
|
Demoxepam |
37 |
|||
|
N-Desmethyldiazepam |
80–103 |
|||
|
Clobazam |
36–42 |
N-Desmethylclobazam |
71–82 |
20 |
|
Flunitrazepam |
16–35 |
Desmethylflunitrazepam |
20–30 |
1 |
|
Desmethylhydroxyflunitrazepam |
9–25 |
|||
|
Lorazepam |
9–19 |
Keine |
– |
2 |
|
Medazepam |
2–5 |
N-Desmethyldiazepam |
80–103 |
20 |
|
Oxazepam |
4–15 |
Keine |
– |
30 |
|
Zolpidem |
1,5–2,5 |
Keine |
– |
20 |
|
Zopiclon |
1,7–5,7 |
Zopiclon-N-oxid (nicht aktiv) |
4,5 h |
15 |
aKlinische Äquivalenzdosis bezogen auf 10 mg Diazepam
Gängige Leitlinien diskutieren bei Anfällen in der Anamnese oder sehr schneller Benzodiazepin-Abdosierung den zusätzlichen Einsatz von Antikonvulsiva, vor allem Carbamazepin, aber auch Valproinsäure, Lamotrigin und Gabapentin in anfallsprophylaktischen Dosierungen [14, 37]. Letztlich existiert zum Einsatz pharmakologischer Strategien zur Unterstützung eines Benzodiazepin-Entzugs jedoch eine nur wenig belastbare Studienlage. Am häufigsten wurde in Studien die Wirksamkeit von Carbamazepin mit anfallsprophylaktischer und entzugslindernder Indikation untersucht, wobei Carbamazepin auch positive Effekte auf eine entstehende Angst-Symptomatik zu haben schien. Unter einer zusätzlichen Therapie mit Pregabalin fand sich in einzelnen Studien eine Verbesserung von Entzugs-, insbesondere Angstsymptomen, allerdings ohne ausreichende Signifikanz. Der Vorteil von Pregabalin gegenüber Carbamazepin liegt in der deutlich geringeren Interaktion mit anderen Arzneistoffen und geringeren akuten Nebenwirkungen, als Nachteil ist die Gefahr eines missbräuchlichen Konsums zu nennen. Die Anwendung von Pregabalin im Benzodiazepin-Entzug wurde jedoch nicht empfohlen [10]. Für keine der untersuchten Substanzen besteht letztlich eine entsprechende Zulassung, womit es sich grundsätzlich um Off-Label-Anwendungen handelt, die in jedem Einzelfall überprüft werden müssen.
Im Falle einer Niedrigdosisabhängigkeit kann ein ambulanter Entgiftungsversuch erfolgen. Wichtig ist hierbei die Abwägung des Aufwands einer mehrwöchigen, für den Patienten oftmals belastenden Entzugstherapie und dem potenziellen Schaden, den eine weitere Verordnung der Substanzen verursachen kann. Zu berücksichtigen sind auch die Schwere der Grunderkrankung und zu beachtende Nebendiagnosen, die zu erwartende Lebensdauer und nicht zuletzt die zu erwartende Compliance des Patienten. Bei Patienten mit komorbiden psychischen Störungen oder schweren körperlichen Erkrankungen, Krampfanfällen oder Delirien in der Vorgeschichte oder Abhängigkeit von multiplen Substanzen sollte eine stationäre Entgiftung angestrebt werden.
Kasuistik 2: Abhängigkeit von Z-Substanzen
Die 64-jährige, bereits im Alter von 52 Jahren frühpensionierte Grundschullehrerin Frau C. kam zur stationären qualifizierten Entzugsbehandlung. Sie nehme seit 19 Jahren Zolpidem ein, was ihr anfänglich aufgrund von Schlafstörungen verschrieben worden sei mit dem Hinweis, dass man von diesem neuartigen Präparat nicht abhängig werde. Abgesehen von jährlich mindestens einer stationären Entzugsbehandlung habe es einen dauerhaften Konsum gegeben. Mittlerweile lasse sie sich von vielen verschiedenen Behandlern Zolpidem verordnen. Sie nehme bis zu 60 Tabletten à 5 mg täglich. Belastende Situationen könne sie nur mit Zolpidem bewältigen.
Psychopathologisch zeigte sich eine gepflegte, aber vorgealterte, zart und zerbrechlich wirkende Patientin, wach, nicht erkennbar sediert wirkend. Ihre Stimmung war wenig einfühlbar, wurde von ihr als depressiv und freudlos angegeben, im Affekt imponierte vorrangig eine ängstliche Besorgtheit und Affektlabilität mit gedanklicher Einengung auf die Sorge vor dem Entzug und die Einnahme von Zolpidem. Es lagen keine Entzugssymptome vor. Spürbar war eine ausgeprägte Ambivalenz bezüglich ihres Abstinenzwunschs.
Es erfolgte eine Entzugsbehandlung über eine Dauer von knapp sechs Wochen unter medikamentöser Umstellung und dann schrittweiser Ausdosierung von Diazepam, beginnend mit einer unter der Äquivalenzdosis liegenden Dosierung von 30 mg, was gut toleriert wurde.
Gegen Ende der Entzugsbehandlung fühlte sich die Patientin durch quälende Emotionen überflutet, präsentierte sich völlig verzweifelt und hoffnungslos, berichtete weinend von jahrzehntelang erlebten Entwertungen, Lügen und Demütigungen in ihrer Ehe, die sie mithilfe von Zolpidem aus ihrem Erleben abgespalten hatte. Mit zunehmender kognitiver Aufklarung erfasste sie ihre Situation bewusster und differenzierter, erlebte sich selbst dabei jedoch als völlig unfähig, defizitär, wert- und nutzlos. Zeitgleich beklagte sie einen wieder steigenden Suchtdruck. Eine Entlassung gegen ärztlichen Rat erfolgte daraufhin.
Nach etwa einem Monat erfolgte eine erneute Aufnahme zur Entzugsbehandlung. Sie war unmittelbar nach Entlassung rückfällig geworden und hatte die Dosis schnell wieder auf die ursprüngliche Menge gesteigert. Der Entzugsverlauf verlief analog zur ersten Behandlung, jedoch nur über vier Wochen aufgrund ihres Drängens auf rasche Entlassung.
Eine dritte Entzugsbehandlung nach weiteren drei Monaten beendete sie bereits nach zehn Tagen gegen ärztlichen Rat.
Trotz kontinuierlich begleitender Einzelpsychotherapie und eingehender Psychoedukation während der stationären Entzugsbehandlungen blieb Frau C. in ihrer positiven Einordnung von Zolpidem als „Hilfsmittel“ und „Lebensretter“ und ihrer erlernten Hilflosigkeit und Dependenz verhaftet. Es war nicht gelungen, mittels positiver Aspekte eines abstinenten Lebens ihre Angst vor negativen Konsequenzen eines abstinenten „Er“-Lebens zu überwinden (zitiert nach: [31]).
In einer kanadischen Übersichtsarbeit wurden verschiedene mögliche Reduktionsschemata zusammengefasst [38]. In der überwiegenden Mehrheit der Studien erfolgte dort eine Reduktion der Ausgangsdosis um 25 % alle ein bis zwei Wochen, im Verlauf der letzten Reduktionsschritte erfolgte dann eine 12,5 %ige Reduktion. Alternative Strategien führen eine jeweils 50 %ige Reduktion fort, wieder andere postulieren eine schrittweise Entwöhnung mit Hilfe alternierender Gaben (beispielsweise zwei Nächte ohne Einnahme, eine Nacht mit Einnahme).
Überwiegend werden hyperbole, also nicht-lineare Reduktionsschemata empfohlen, die die Adaptation des Systems in Hinblick auf die zu erwartende GABAA-Rezeptorbesetzung berücksichtigen. Die exponentielle Reduktion der Substanz führt zu einer linearen Reduktion der zu erwartenden Rezeptorbesetzung, wodurch große Sprünge in der Rezeptorbesetzung und somit das Auftreten starker Entzugssymptome vermieden werden.
Fazit
Die Verordnung von Benzodiazepinen und Z-Substanzen sollte sowohl im ambulanten als auch im stationären Sektor einer kritischen Prüfung unterliegen. Beide Substanzklassen haben ein klinisch relevantes Abhängigkeitspotenzial, weshalb die Verordnung nur über einen möglichst kurzen Zeitraum erfolgen sollte.
Im Zuge des Absetzens von Benzodiazepinen und Z-Substanzen ist insbesondere zum Ende der Reduktion eine kleinschrittige Abdosierung zu empfehlen: „go slow when you go low“. Dabei gegebenenfalls auftretende Entzugssymptome können symptomorientiert behandelt werden und müssen von Rebound- und Rezidiv-Phänomenen unterschieden werden.
Absetzen von Gabapentinoiden
Substanzen und Wirkweise
Die Gabapentinoide Gabapentin und Pregabalin sind Derivate des Neurotransmitters GABA. Empfohlene therapeutische tägliche Höchstdosen bei Erwachsenen liegen für Gabapentin bei 3600 mg und für Pregabalin bei 600 mg. Gabapentin ist seit 1997 und Pregabalin seit 2004 auf dem deutschen Markt [6, 7]. Gabapentinoide binden nicht an den GABA-Rezeptor selbst, sondern wirken über eine präsynaptische Hemmung spannungsabhängiger Calcium-Kanäle. Hohe Dosierungen und rasche Eindosierung steigern den extrazellulären GABA-Gehalt, was mit euphorisierenden Effekten („Liking“) einhergehen kann [6].
Gabapentin wird weniger schnell absorbiert als Pregabalin und hat eine geringere Bioverfügbarkeit (Tab. 4). Zudem zeigt die Gabapentin-Plasmakonzentration keinen linearen Anstieg zur Erhöhung der oralen Dosierung, wohingegen die Pregabalin-Plasmaspiegel mit Dosiserhöhung rascher ansteigen und hier einen linearen Zusammenhang zeigen [7]. Dies erklärt ein ausgeprägteres „Liking“ in der Betrachtung eines potenziellen Abhängigkeitspotenzials von Pregabalin gegenüber Gabapentin [6]. Gabapentin und Pregabalin wirken in therapeutischen Dosen anxiolytisch, in geringen Dosierungen stimulierend und in höheren Dosen sedierend [7].
Tab. 4. PK/PD-Parameter sowie empfohlene Dosierungen von Gabapentin und Pregabalin (eigene Darstellung nach [16])
|
PK/PD-Parameter |
Gabapentin |
Pregabalin |
|
tmax [h] |
2–4 |
1 |
|
t1/2 [h] |
5–7 |
5,5–6,7 |
|
Verteilungsvolumen [l/kg] |
0,8 |
0,56 |
|
Plasmaproteinbindung [%] |
< 3 |
0 |
|
Bioverfügbarkeit [%] |
27–60 |
> 90 |
|
Einfluss Nahrung auf Bioverfügbarkeit |
14 % Anstieg von AUC und Cmax |
Bei Einnahme während der Mahlzeiten wird die Resorptionsrate verringert, was zu einer Verringerung der Cmax um ca. 25 bis 30 % sowie zu einer Verzögerung der tmax auf ca. 2,5 Stunden führt |
|
Maximal empfohlene Dosierung |
3600 mg (verteilt auf 3–4 Dosen) |
600 mg (verteilt auf 2–3 Dosen) |
PK: Pharmakokinetik; PD: Pharmakodynamik; AUC: Area under the curve; Cmax: maximale Plasmakonzentration; tmax: Zeit bis zum Erreichen der maximalen Plasmakonzentration
Indikation, Verordnungshäufigkeit und Verordnungsdauer
Gabapentin und Pregabalin haben einen hohen Stellenwert in der Behandlung chronisch neuropathischer Schmerzen und sollen entsprechend der deutschen Leitlinie als Mittel der ersten Wahl eingesetzt werden [40]. Beide Substanzen haben zudem eine Zulassung für die Behandlung der Epilepsie. In dieser Indikation ist in der Regel von einer Langzeitverordnung auszugehen. Pregabalin ist in Deutschland zusätzlich zur Behandlung der generalisierten Angststörung zugelassen.
Neben den bestehenden Indikationen ist von einer Vielzahl von Off-Label-Verordnungen auszugehen. Hier sind Vorteile in der Behandlung des Restless-Legs-Syndroms, Entzugssyndromen, Angsterkrankungen, Schlafstörungen, funktionellen neurologischen und somatoformen Störungen und postoperativen Schmerzen beschrieben [5, 9]. In den USA ist Pregabalin zudem zur Behandlung der Fibromyalgie zugelassen. Neben den beschriebenen positiven Behandlungseffekten sind günstige pharmakokinetische Eigenschaften ein Grund für die häufige Verordnung der Gabapentinoide, die nur ein geringes Interaktionspotenzial aufweisen und renal eliminiert werden [7].
Die Verordnungshäufigkeit von Gabapentinoiden hat in den letzten Jahren sowohl in Deutschland als auch international zugenommen [7, 16, 17]. In Großbritannien erfolgten zuletzt mehr Verordnungen unter Off-Label-Bedingungen als bei bestehender Zulassung [12].
Die deutsche Leitlinie „Diagnose und nichtinterventionelle Therapie neuropathischer Schmerzen“ wurde 2019 um einen Warnhinweis ergänzt, der auf das Abhängigkeitspotenzial von Pregabalin hinweist, insbesondere bei Patienten mit komorbiden Substanzabhängigkeiten und bei sehr hohen Tagesdosen (im Median 2100 mg, Spannweite 800 bis 7500 mg). Es folgt die Empfehlung, bei dieser Patientengruppe aufgrund der günstigeren Pharmakokinetik mit nichtlinearer Resorptionskinetik und geringerer Toxizität bei oraler Überdosierung, Gabapentin in der Verordnung zu bevorzugen [40].
In der Indikation der Behandlung der generalisierten Angststörung erhält Pregabalin in der S3-Leitline „Behandlung von Angststörungen“ eine „Sollte“-Empfehlung. Es besteht eine gesicherte Evidenz für die anxiolytische Wirksamkeit, gleichzeitig werden unerwünschte Arzneimittelwirkungen wie Somnolenz und Benommenheit und das Missbrauchspotenzial als klinisch relevant eingeschätzt [3]. Aufgrund der durchaus gravierenden Einzelfallberichte von unerwünschten Arzneimittelwirkungen empfiehlt auch die Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM) in einer Stellungnahme mit Verweis auf die NICE-Guidelines von 2019, Pregabalin nicht als Mittel der ersten Wahl bei der generalisierten Angststörung einzusetzen [3]. Es liegt in der Leitlinie keine konkrete Empfehlung für die Verordnungsdauer von Pregabalin bei der generalisierten Angststörung vor.
Abhängigkeitspotenzial von Gabapentinoiden und Absetzphänomene
Es fehlen klinische Studien, die den Aspekt der Abhängigkeitsentwicklung von Gabapentinoiden diskutieren [7, 8]. Aus diesem Grund liegen verschiedenen Metaanalysen zu dieser Thematik vor, die den aktuellen Forschungsstand zusammenfassen. Der wesentliche Befund ist, dass Missbrauch und Abhängigkeit von Gabapentinoiden oft mit anderen Substanzabhängigkeiten (insbesondere Opiatabhängigkeiten oder multiplem Substanzgebrauch) assoziiert sind [19, 20].
Das Missbrauchsrisiko für Pregabalin wird aufgrund der rascheren Resorption und höheren Bioverfügbarkeit und der daraus resultierenden rasch eintretenden Euphorie als höher als das von Gabapentin eingeschätzt [20]. Das Abhängigkeitspotenzial im Vergleich zu anderen abhängigkeitserzeugenden Substanzen (Opioide, Alkohol, Benzodiazepine und Cannabis) wird insgesamt jedoch als geringer eingeschätzt [6, 18]. Durch die GABA-mimetische Wirkung mit rasch einsetzenden euphorisierenden Effekten zeigt sich ein direkter körperlicher Effekt. Es ist eher mit einer körperlichen Abhängigkeit (Absetzphänomene, Toleranzentwicklung) als mit einer psychischen Abhängigkeit zu rechnen [6]. Um das gewünschte „High-Feeling“ herbeizuführen, berichten Autoren von einer missbräuchlichen Einnahme von Pregabalin in überdosierten Hochdosisbereichen (bis 4200 mg/Tag) [42]. Es sind lediglich Einzelfälle einer Abhängigkeit von Pregabalin ohne vorliegende andere Substanzabhängigkeit beschrieben [3, 6]. Die Dokumentation verschiedener Einzelfälle von gravierenden Symptomen, insbesondere in Folge von abruptem Absetzen von Pregabalin, unterstreicht jedoch die klinische Relevanz (vgl. hierzu Kasuistik 3).
Kasuistik 3. Absetzen von Pregabalin
Beim 48-jährigen Herrn B. besteht eine langjährige Abhängigkeit von multiplen Substanzen. Bereits seit dem 17. Lebensjahr konsumierte er Heroin inhalativ und intravenös, im Verlauf der Jahre entwickelte er Abhängigkeiten von verschiedensten Substanzen, darunter Kokain, Alkohol, Benzodiazepine und Halluzinogene. Zum Zeitpunkt der aktuellen Vorstellung ist Herr B. in Substitution mit Methadon mit einer Tagesdosis von 160 mg. Die Vorstellung erfolgt in erster Linie mit dem Wunsch der Entgiftung von Pregabalin.
Er erhalte Pregabalin in einer Tagesdosis von 400 mg auf Rezept zur Linderung von „Angstzuständen“, zudem kaufe er Pregabalin auf dem Schwarzmarkt und konsumiere somit in Summe etwa 800 mg Pregabalin täglich.
Herr B. wird auf unsere suchtmedizinische Station zur qualifizierten Entgiftung aufgenommen. In Rücksprache mit dem Patienten reduzierten wir die Tagesdosis von Pregabalin am Tag nach der Aufnahme auf zweimal 300 mg. Die Substitution mit Methadon wurde unverändert fortgeführt.
Infolge der Reduktion zeigte Herr B. eine nächtliche Schlafparalyse von etwa fünf Minuten Dauer. Dabei konnte er durch lautes Schnaufen die Mitpatienten auf sich aufmerksam machen. Bei Eintreffen der hinzugerufenen diensthabenden Ärztin zeigte sich der Patient wach und reagibel auf Ansprache bei zeitgleich schlaffem Muskeltonus aller Extremitäten.
In der Visite am Folgetag berichtete Herr B., einen solchen Zustand bereits im Vorfeld im häuslichen Setting erlebt zu haben, wenn er nicht genügend Pregabalin auf dem Schwarzmarkt habe erstehen können. Zudem verwies er auf Einträge in einschlägigen „User-Foren“. Demzufolge scheinen Zustände von Schlafparalysen sowohl beim Entzug als auch bei (auch intentionaler) Intoxikation mit Pregabalin vermehrt aufzutreten. Teils scheinen solche Intoxikationen mit der Intention des Herbeiführens luzider (also bewusst erlebter und steuerbarer) Träume einherzugehen.
Herr B. brach am darauffolgenden Tag die Behandlung ab. Im Rahmen eines erneuten Aufenthalts erfolgte eine kleinschrittigere Reduktion der mittlerweile auf etwa 900 mg gesteigerten Pregabalin-Tagesdosis. Probatorisch erfolgte eine Reduktion um 50 mg pro Tag. Hierunter trat keine erneute Schlafparalyse auf. Herr B. schloss die Behandlung regulär ab und konnte sich auf eine Vermittlung in ein soziotherapeutisches Wohnheim einlassen.
In der Literatur sind Absetzphänomene beschrieben, die denen beim Absetzen von SSRI (selektiven Serotonin-Wiederaufnahmehemmern) ähneln [7]. Gleichzeitig finden sich Verweise auf die Ähnlichkeit zum Absetzen von Benzodiazepinen [16]. Als Symptome nach dem Absetzen sind Agitation, Dysphorie, erhöhte Irritabilität, Depersonalisation, Gangunsicherheit, Schwindel, Benommenheit, Erschöpfung, Tremor, Schlaflosigkeit, Muskelschmerzen, grippeähnliche Beschwerden, Unwohlsein und Übelkeit, Schlaflosigkeit, Palpitationen und Tachykardien beschrieben. Zudem ist nach Absetzen, jedoch auch während der Behandlung mit Pregabalin, das Auftreten von Krampfanfällen mit Grands-Maux bis hin zum Status epilepticus beschrieben [3]. Absetzphänomene sind vor allem für ältere Patienten und solche mit psychiatrischen Komorbiditäten beschrieben [12]. Eine Medikation mit Gabapentinoiden sollten unabhängig davon, ob sie rezeptiert ist oder nicht, nicht abrupt abgesetzt werden [16]. Absetzphänomene nach abruptem Absetzen treten meist innerhalb von zwölf Stunden bis zu sieben Tagen nach dem Absetzen auf [12].
Für Gabapentin wurde berichtet, dass die Absetzphänomene bei höheren Tagesdosierungen zum Zeitpunkt des Absetzens gravierender waren als bei einer vergleichsweise kleineren Dosis. Zudem bestehen Erfahrungsberichte, dass eine kleinschrittige Reduktion von Gabapentin zu einem unproblematischen Absetzen führt. Neben den Absetzphänomen und einer moderaten Toleranzentwicklung in Einzelfällen sind unter Gabapentin kein Craving, Kontrollverlust oder starkes Substanzverlangen im Sinne einer Abhängigkeitsentwicklung beschrieben [7].
Horowitz et al. kommen in ihrer Übersichtsarbeit zur Frage, ob Gabapentinoide langfristig verordnet werden sollten, zu der Einschätzung, dass abgewogen werden müsse, ob der erwartete klinische Benefit das noch unsichere Sicherheitsprofil der Substanzen ausgleiche [22]. Als Risiken sind neben den bekannten unerwünschten Arzneimittelwirkungen und dem bestehenden Abhängigkeitspotenzial ein erhöhtes Risiko für Suizide, eine versehentliche Überdosierung und für Unfälle und Verletzungen zu nennen [32].
Für den Einsatz bei Angsterkrankungen muss kritisch diskutiert werden, ob eine Langzeitverordnung von Gabapentinoiden sinnvoll ist. Bezüglich der Wirksamkeit bei einer längerfristigen oder gar Dauerverordnung liegen keine ausreichenden Studien vor [22]. Ebenso wenig sind das abrupte Absetzen nach einer Langzeitverordnung und die entsprechende Auswirkung auf die Angstsymptomatik bei fortbestehender Angsterkrankung ausreichend systematisch untersucht.
Zusammenfassung und Empfehlung zum Absetzen von Gabapentinoiden
In der Literatur werden sowohl Parallelen zum Absetzen von SSRI [7] als auch zu Benzodiazepinen berichtet [16]. Da das Abhängigkeitspotenzial der Gabapentinoide als deutlich geringer als bei Benzodiazepinen eingeschätzt wird, und vornehmlich körperliche Absetzphänomene zu erwarten sind, empfiehlt sich – abgeleitet aus den Empfehlungen für Gabapentin und Pregabalin – ein kleinschrittiges Absetzen („Tapering“). Dabei sollten eine kleinschrittige Reduktion und ein Absetzen über mehrere Wochen vorgenommen werden [16]. Dies gilt vor allem bei der Behandlung mit anxiolytischer Indikation, insbesondere für Pregabalin bei der generalisierten Angststörung, jedoch auch für die Off-Label-Verordnung.
Je höher die ursprünglich verordnete Dosierung und je länger die vorangegangene Dauer der Verordnung, desto kleinschrittiger sollte das ausschleichende Absetzen erfolgen. Eine klare Empfehlung für einen Zeitraum, über den die Reduktion erfolgen soll, liegt nicht vor, gleichzeitig wird klar von einem abrupten Absetzen gewarnt. Im Pharmaindex „Gelbe Liste“ findet sich beispielsweise der Hinweis, Gabapentin und Pregabalin unabhängig von der Indikation schrittweise über mindestens eine Woche abzusetzen [47], was aufgrund eines oftmals bestehenden Hochdosiskonsums eher sehr kurz erscheint.
Grundsätzlich sollten vor der Verordnung von Gabapentinoiden (insbesondere Pregabalin) bei der generalisierten Angststörung und in Off-Label-Indikationen andere potenziell nebenwirkungsärmere Substanzen und solche mit geringerem Missbrauchspotenzial erwogen werden. Die Möglichkeit eines kurzdauernden Einsatzes (beispielsweise Gabe von zwei bis vier Wochen in Krisensituationen, vergleichbar mit dem Einsatz von Benzodiazepinen) sollte gegen eine Langzeitverordnung abgewogen werden, wenngleich länger dauernde Auftitrierphasen einer Kurzanwendung eher entgegenstehen [22]. Es kann die klare Empfehlung dafür ausgesprochen werden, Patienten vor der Verordnung von Gabapentinoiden über mögliche Absetzphänomene aufzuklären.
Fazit
Bei eher schwachem Potenzial zur psychischen Abhängigkeit können Gabapentinoide eine erhebliche körperliche Abhängigkeit (Entzugssyndrom, Toleranz) entwickeln. Insbesondere schwerere Pregabalin-Abhängigkeiten entwickeln sich vornehmlich bei Patienten mit vorherigen oder gleichzeitigen anderen Abhängigkeitserkrankungen. Deshalb sollten bei Patienten mit Abhängigkeitserkrankungen entweder keine Gabapentinoide oder – wenn medizinisch erforderlich – bevorzugt Gabapentin anstatt Pregabalin unter strikter Kontrolle und nur so kurz wie möglich eingesetzt werden [6].
Interessenkonflikterklärung
Dr. Paulzen erhielt 2020/2021 Honorare für Vorträge und Beratungsleitungen von Lundbeck, Neuraxpharm, Janssen Cilag, Novartis und Otsuka. Er ist Herausgeber von PSIAC, einem internetbasierten Interaktionsprogramm mit der Schwerpunktsetzung auf Psychopharmaka. Ein Interessenkonflikt bezüglich des Beitrags besteht nicht. Dr. Kirchner und Dr. Schreckenbach berichten keinen Interessenkonflikt.
Literatur
1. Anghelescu I-G, Benkert O. Anxiolytika. In: Kompendium der Psychiatrischen Pharmakotherapie. Heidelberg: Springer, 2021:451–97.
2. Arzneimittelkommission der Deutschen Ärzteschaft. Abhängigkeitspotenzial von Pregabalin (Lyrica®). Deutsches Ärzteblatt 2011;108:A-183.
3. Bandelow B, Aden I, Alpers GW, Benecke A, et al. S3-Leitlinie Behandlung von Angststörungen: Version 2. https://www.awmf.org/leitlinien/detail/ll/051-028.html (2021) (Zugriff am 10.05.2022).
4. Bateson AN. Basic pharmacologic mechanisms involved in benzodiazepine tolerance and withdrawal. Curr Pharm Des 2022;8:5–21.
5. Bockbrader HN, Wesche D, Miller R, Chapel S, et al. A comparison of the pharmacokinetics and pharmacodynamics of pregabalin and gabapentin. Clin Pharmacokinet 2010;49:661–9.
6. Bonnet U. Gefährdungs- und Abhängigkeitspotential von Gabapentinoiden – eine Übersicht. Suchtmedizin in Forschung und Praxis 2020;22:173–81.
7. Bonnet U, Scherbaum N. Über das Abhängigkeitspotential von Gabapentinoiden. Fortschr Neurol·Psychiatr 2018;86:82–105.
8. Buth S, Holzbach R, Martens MS, Neumann-Runde E, et al. Problematic medication with benzodiazepines, “Z-drugs”, and opioid analgesics. Dtsch Arztebl Int 2019;116:607–14.
9. Calandre EP, Rico-Villademoros F, Slim M. Alpha(2)delta ligands, gabapentin, pregabalin and mirogabalin: a review of their clinical pharmacology and therapeutic use. Expert Rev Neurother 2016;16:1263–77.
10. Caniff K, Telega E, Bostwick JR, Gardner KN. Pregabalin as adjunctive therapy in benzodiazepine discontinuation. Am J Health Syst Pharm 2018;75:67–71.
11. Chiappini S, Schifano F. A decade of gabapentinoid misuse: an analysis of the European Medicines Agency’s “suspected adverse drug reactions” database. CNS Drugs 2016;30:647–54.
12. Chincholkar M. Gabapentinoids: pharmacokinetics, pharmacodynamics and considerations for clinical practice. Br J Pain 2020;14:104–14.
13. Denis C, Fatseas M, Lavie E, Auriacombe M. Pharmacological interventions for benzodiazepine mono-dependence management in outpatient settings. Cochrane Database Syst Rev 2006;(3):CD005194.
14. Deutsche Gesellschaft für Psychiatrie und Psychotherapie, Psychosomatik und Nervenheilkunde (DGPPN), Deutsche Gesellschaft für Suchtforschung und Suchttherapie (DG-Sucht). S3-Leitlinie Medikamentenbezogene Störungen – 1. Auflage. Version 01. 2020.
15. Deutsche Gesellschaft für Psychiatrie und Psychotherapie, Psychosomatik und Nervenheilkunde (DGPPN), Deutsche Gesellschaft für Suchtforschung und Suchttherapie (DG-Sucht). Screening, Diagnose und Behandlung alkoholbezogener Störungen. https://www.awmf.org/leitlinien/detail/ll/076-001.html (2020) (Zugriff am 10.05.2022).
16. Evoy K, Peckham A, Covvey J, Tidgewell K. Gabapentinoid pharmacology in the context of emerging misuse liability. J Clin Pharmacol 2021;61:S89–99.
17. Goins A, Patel K, Alles SRS. The gabapentinoid drugs and their abuse potential. Pharmacol Ther 2021;227:107926.
18. Griffith RR, Johnson MW. Relative abuse liability of hypnotic drugs: a conceptual framework and algorithm for differentiating among compounds. J Clin Psychiatry 2005;66:31–41.
19. Grosshans M, Lemenager T, Vollmert C, Kaemmerer N, et al. Pregabalin abuse among opiate addicted patients. Eur J Clin Pharmacol 2013;69:2021–5.
20. Hägg S, Jönsson AK, Ahlner J. Current evidence on abuse and misuse of gabapentinoids. Drug Safety 2020;43:1235–54.
21. Holzbach R. Der Benzodiazepinentzug und dessen Behandlung. Suchttherapie 2006;7:97–106.
22. Horowitz MA, Kelleher M, Taylor D. Should gabapentinoids be prescribed long-term for anxiety and other mental health conditions? Addict Behav 2021;119:106943.
23. Janhsen K, Roser P, Hoffmann K. Probleme der Dauertherapie mit Benzodiazepinen und verwandten Substanzen. Verschreibungspraxis, Epidemiologie und Entzugsbehandlung. Dtsch Ärztebl Int 2015;112:1–7.
24. Köberle U, Stammschulte T, Acquarone D, Bonnet U. Abhängigkeitspotenzial von Pregabalin. Arzneiverordnung in der Praxis 2020;47:62–5.
25. Lader M, Kyriacou A. Withdrawing benzodiazepines in patients with anxiety disorders. Curr Psychiatry Rep 2016;18:8.
26. Lader M, Tylee A, Donoghue J. Withdrawing benzodiazepines in primary care. CNS Drugs 2009;23:19–34.
27. Laux G, Dietmaier O. Praktische Psychopharmakotherapie. 7. Auflage. München: Elsevier Health Sciences, 2020.
28. Laux G, Müller WE. Weiterbildungs-Curriculum Psychopharmakologie/Pharmakotherapie. Teil 7: Pharmakologie und klinische Psychopharmakotherapie der Hypnotika. Psychopharmakotherapie 2019;26:85–95.
29. Lingford-Hughes AR, Welch S, Peters L, Nutt D. BAP updated guidelines: evidence-based guidelines for the pharmacological management of substance abuse, harmful use, addiction and comorbidity: recommendations from BAP. J Psychopharmacol 2012;26:899–952.
30. Lohse MJ. Psychopharmaka. In: Schwabe U, Ludwig W-D (Hrsg.). Arzneiverordnungs-Report 2020. Berlin, Heidelberg: Springer, 2020:781–814.
31. Manthey F, Hauschild-Hersch A, Eich H, Paulzen M. Medikamentöse Suchtbehandlung. 1. Auflage. Stuttgart: Kohlhammer, 2022.
32. Molero Y, Larsson H, D’Onofrio BM, Sharp DJ, Fazel S. Associations between gabapentinoids and suicidal behaviour, unintentional overdoses, injuries, road traffic incidents, and violent crime: population based cohort study in Schweden. BMJ 2019;365:l2147.
33. Mugunthan K, Mcguire T, Glasziou P. Minimal interventions to decrease long-term use of benzodiazepines in primary care: a systematic review and meta-analysis. Br J Gen Pract 2011;61:e573–8.
34. Müller MJ, Benkert O. Pharmakotherapie psychiatrischer Notfallsituationen. In: Kompendium der Psychiatrischen Pharmakotherapie. Heidelberg: Springer, 2021:809–54.
35. Paquin AM, Zimmerman K, Rudolph JL. Risk versus risk: a review of benzodiazepine reduction in older adults. Expert Opin Drug Saf 2014;13:919–34.
36. Parr JM, Kavanagh DJ, Cahill L, Mitchell G, et al. Effectiveness of current treatment approaches for benzodiazepine discontinuation: a meta‐analysis. Addiction 2009;104:13–24.
37. Poser W, Böning J, Holzbach R, Schmidt L. AWMF-Leitlinie Medikamentenabhängigkeit (Sedativa, Hypnotika, Analgetika, Psychostimulanzien) (2006).
38. Pottie K, Thompson W, Davies S, Grenier J, et al. Deprescribing benzodiazepine receptor agonists: Evidence-based clinical practice guideline. Can Fam Physician 2018;64:339–51.
39. Salzman C. The APA Task Force report on benzodiazepine dependence, toxicity, and abuse. Am J Psychiatry 1991;148:151–2.
40. Schlereth T, et al. Diagnose und nicht interventionelle Therapie neuropathischer Schmerzen, S2k-Leitlinie, 2019. In: Deutsche Gesellschaft für Neurologie (Hrsg.). Leitlinien für Diagnostik und Therapie in der Neurologie. Online: www.dgn.org/leitlinie (Zugriff am 10.05.2022).
41. Schwabe U, Ludwig WD. Arzneiverordnungs-Report 2020. Berlin, Heidelberg: Springer, 2020.
42. Schwan S, Sundström A, Stjernberg E, Hallberg E. A signal for an abuse liability for pregabalin – results from the Swedish spontanous adverse drug reaction reporting system. Eur J Clin Pharmacol 2010;66:947–53.
43. Soyka M. Missbrauch und Abhängigkeit von Benzodiazepinen und Z-Drugs. Nervenheilkunde 2021;40:636–47.
44. Soyka M. Treatment of benzodiazepine dependence. N Engl J Med 2017;376:1147–57.
45. Tan KR, Brown M, Labouèbe G, Yvon C, et al. Neural bases for addictive properties of benzodiazepines. Nature 2010;463:769–74.
46. Verthein U, Buth S, Holzbach R, Neumann-Runde E, et al. Benzodiazepine und Z-Substanzen – Analyse der kassenärztlichen Verschreibungen von 2006 bis 2015. Psychiatr Prax 2019;46:399–405.
47. Vidal MMI Germany GmbH. Gelbe Liste Pharmindex – Wirkstoff Monographien. https://www.gelbe-liste.de (Zugriff am 10.05.2022).
48. Vinkers CH, Olivier B. Mechanisms underlying tolerance after long-term benzodiazepine use: a future for subtype-selective GABA(A) receptor modulators? Adv Pharmacol Sci 2012;2012: 416864.
49. Volz H-P, Müller WE. Weiterbildungs-Curriculum Psychopharmakologie/Pharmakotherapie. Teil 3: Pharmakologie und klinische Psychopharmakotherapie der Tranquilizer/Anxiolytika. Psychopharmakotherapie 2018;25:69–75.
50. Wodarz N. Prävalenz und Relevanz der Medikamentenabhängigkeit. Suchttherapie 2020;21:98–9.
Priv.-Doz. Dr. Michael Paulzen, Dr. Miriam Kirchner, Dr. Tobias Schreckenbach, Alexianer Krankenhaus Aachen, Alexianergraben 33, 52062 Aachen, E-Mail: m.paulzen@alexianer.de
Withdrawal of psychotropic drugs. Focus on tranquilizers and gabapentinoids
The long-term use of tranquilizers such as benzodiazepines and hypnotics such as the Z-drugs zopiclone and zolpidem is viewed very critically, especially in elderly patients. The risk of falls and fractures is too great, and possible cognitive decline is also associated with long-term use, even though the number of prescriptions has fortunately been falling for years.
In contrast to the declining prescription of benzodiazepines and Z-drugs, the number of prescriptions for the gabapentinoids gabapentin and pregabalin has been steadily increasing, and in recent years there has been an increasing discussion bout misuse, particularly in the case of pregabalin.
In addition to the on-label use of benzodiazepines, Z-drugs and gabapentinoids discussed here, the focus is on those patients who are extending the use of the drugs towards abusing them and even becoming addicted. As a continuation of the series “Discontinuation of Psychotropic Drugs”, this article focuses on the discontinuation of tranquilizers and gabapentinoids. The topic of discontinuation of psychotropic drugs should increasingly be focused in clinical psychiatry, because all too often a short-term prescription of psychotropic drugs turns into a long-term use.
Key words: anxiolytics, tranquilizers, benzodiazepines, gabapentinoids, discontinuation of psychotropic drugs, withdrawal syndromes
Psychopharmakotherapie 2022; 29(03):84-95
