Max Schmauß, Jessica Baumgärtner, Augsburg, und Walter E. Müller, Worms/Frankfurt
Psychopharmakologie
Der lange Weg von den typischen zu den atypischen Antipsychotika
Die Einführung von Chlorpromazin als Muttersubstanz der Neuroleptika1 vor rund 60 Jahren stellt einen epochalen Meilenstein in der Behandlung schizophrener und manischer Psychosen dar, die zum ersten Mal auf eine therapeutische Intervention nachhaltig ansprachen. In den Jahren danach wurde dann eine große Zahl weiterer Neuroleptika (typische Antipsychotika, Antipsychotika der ersten Generation, „first generation antipsychotics“, FGA) entwickelt und in die Therapie eingeführt (Tab. 1). Sie unterscheiden sich in der für die antipsychotische Wirkung benötigten Dosis. Für alle konnte ungeachtet der chemischen Struktur als gemeinsamer primärer Wirkungsmechanismus eine funktionale Blockade der zentralen dopaminergen Neurotransmission über einen kompetitiven Antagonismus von Dopamin-D2- und teilweise auch D3-Rezeptoren identifiziert werden. Die Affinität der Antipsychotika zum D2-Rezeptor ist die primäre Determinante für die zur antipsychotischen Wirksamkeit eingesetzte Dosis, das heißt, je höher die Affinität (je niedriger die Bindungskonstante), desto niedriger ist die benötigte Dosis. Auf dieser Basis beruht auch die frühere Klassifikation in hochpotente (niedrige Dosis), mittelpotente (mittlere Dosis) und niedrigpotente (hohe Dosis), die oft falsch interpretiert wird dahingehend, dass nur ein hochpotentes Antipsychotikum stark wirksam wäre. Bei ausreichender Dosis können auch Substanzen mit niedriger Affinität voll antipsychotisch wirken. Allerdings müssen sie aufgrund von unerwünschten Arzneimittelwirkungen (UAW) durch die zusätzlichen Rezeptorprofile (Tab. 2) langsam aufdosiert werden bzw. ist eine ausreichende antipsychotische Dosis wegen der UAW nicht umsetzbar. Bei fast allen hochpotenten Substanzen, bei denen der Affinitätsunterschied zwischen D2-Rezeptor und UAW- relevanten Rezeptoren relativ hoch ist (Abb. 1), kann in der Akuttherapie eine zur vollen D2-Okkupation ausreichende Therapie direkt gegeben werden, was aber auch zu Überdosierungen führen kann.
Tab. 1. Antipsychotika der 1. Generation, Dosierung und Darreichungsformen
|
Substanz |
Approx. CPZ- Äquivalent |
Orale Tagesdosis [mg] |
Orale Tageshöchstdosis [mg] |
Darreichungsform |
|
Hochpotente Antipsychotika |
||||
|
Benperidol |
75 |
1,5–20 |
40 |
Tbl., Trpf., Inj. |
|
Haloperidol |
50 |
1,5–20 |
100 |
Tbl., Trpf., Inj., Depot |
|
Bromperidol |
50 |
5–20 |
50 |
Tbl., Trpf. |
|
Flupentixol |
50 |
3–20 |
60 |
Tbl., Trpf., Depot |
|
Pimozid |
50 |
1–4 |
16 |
Tbl. |
|
Fluphenazin |
40 |
2,5–20 |
20 |
Tbl., Drg., Trpf., Inj., Depot |
|
Perphenazin |
15 |
4–24 |
48 |
Tbl., Drg., Trpf., Depot |
|
Zuclopenthixol |
5 |
20–40 |
80 |
Tbl., Trpf., Inj., Depot |
|
Mittelpotente Antipsychotika |
||||
|
Melperon |
1 |
25–300 |
600 |
Drg., Liqu., Inj. |
|
Perazin |
1 |
75–600 |
1000 |
Tbl., Drg., Trpf., Inj. |
|
Thioridazin |
1 |
25–300 |
600 |
Tbl., Kps., Inj. |
|
Niedrigpotente Antipsychotika |
||||
|
Pipamperon |
0,8 |
40–360 |
360 |
Tbl., Liqu. |
|
Chlorprothixen |
0,8 |
100–400 |
400 |
Drg., Liqu., Susp., Inj. |
|
Prothipendyl |
0,7 |
40–320 |
320 |
Tbl., Drg., Inj. |
|
Levomepromazin |
0,5 |
25–300 |
600 |
Tbl., Trpf., Inj. |
|
Promethazin |
0,5 |
25–150 |
1000 |
Tbl., Liqu., Trpf., Inj. |
CPZ-Äquivalent: 1 mg der Substanz entspricht x mg Chlorpromazin. Die Umrechnungsfaktoren können aufgrund von klinischen Studien nur approximativ eingeschätzt werden. Orale Tagesdosis: Regeldosis in der Akut- und Erhaltungstherapie von Psychosen. Die angegebene Höchstdosis kann im Einzelfall überschritten werden.
Tab. 2. Rezeptorprofile der Antipsychotika als Grundlage von erwünschten (therapeutischen) und unerwünschten (UAW) Wirkungen
|
Rezeptor |
Wirkung als Antagonist |
|
Dopamin-D1 |
Kognition ↓, Aufmerksamkeit ↓ |
|
Dopamin-D2 |
Antipsychotisch, antimanisch, EPS, antidepressiv und anxiolytisch (präsynaptisch bei niedrigen Dosen) |
|
Dopamin-D3 |
Antipsychotisch, antimanisch, antidepressiv, Negativsymptomatik ↓ |
|
Dopamin-D4 |
Antipsychotisch?, EPS? |
|
Serotonin-5-HT1A |
Prokognitiv, anxiolytisch, antidepressiv |
|
Serotonin-5-HT2A |
EPS ↓, Negativsymptome ↓, antidepressiv |
|
Serotonin-5-HT2C |
Appetitsteigerung ↓, Gewichtszunahme |
|
Noradrenalin-alpha1 |
Hypotension, Orthostase, Sedierung, EPS ↓ |
|
Noradrenalin-alpha2 |
Unruhe, antidepressiv |
|
Histamin-H1 |
Müdigkeit, Sedierung, Appetitzunahme, Gewichtszunahme |
|
Acetylcholin-M1 |
EPS ↓, anticholinerge Effekte (Mundtrockenheit, Obstipation, Tachykardie, Harnverhalt), Delir, Müdigkeit |
EPS: extrapyramidal-motorische Symptome

Abb. 1. Schematische Darstellung der Okkupation verschiedener anderer Rezeptoren für ein Antipsychotikum im Vergleich mit D2-Okkupation. Die Substanz hat eine höhere Affinität für den 5-HT2-Rezeptor und niedrigere Affinitäten für den H1- und den M1-Rezeptor
Gemeinsam sind allen neben einer guten antipsychotischen Wirkung aber auch die typischen extrapyramidal-motorischen unerwünschten Wirkungen (EPS: Frühdyskinesien, Parkinson-Symptomatik, Spätdyskinesien), Akathisie und Prolactinerhöhungen. Diese UAW sind ebenfalls auf eine Blockade von D2-Rezeptoren zurückzuführen, allerdings spielen hier im Gegensatz zur antipsychotischen Wirkung (primär mesolimbische Bereiche) andere Hirnareale eine Rolle, wie die Basalganglien und besonders das Striatum für die extrapyramidal-motorischen Effekte und die Hypophyse für die Prolactinerhöhung. Eine auf der Hand liegende Lösung für dieses Problem wäre eine Hirnregion-spezifische Beeinflussung der Dopamin-D2-Rezeptoren; dies scheitert aber daran, dass Dopamin-Rezeptoren vom D2-Typ in allen diesen Hirnarealen identisch sind und gleich auf die typischen Antipsychotika (FGA) reagieren.
Clozapin als Muttersubstanz der atypischen Antipsychotika (SGA)
Einen Ausweg aus diesem Dilemma stellte die eher zufällig gefundene Substanz Clozapin dar, die im Tierversuch und besonders auch in der Klinik sehr gute antipsychotische Eigenschaften zeigte, aber kaum die typischen extrapyramidal-motorischen UAW aufwies.
Mit diesem damals „atypischen Profil“ wurde Clozapin der Vorreiter einer ganzen Reihe von „atypischen Neuroleptika“, die heute weltweit als „First-Line“-Behandlung schizophrener Psychosen gelten. Die ursprüngliche, auch das UAW-Profil einschließende Begrifflichkeit von klassischen und atypischen Neuroleptika bzw. Antipsychotika wird allerdings heute verlassen und zunehmend ersetzt durch die Bezeichnung Antipsychotika der ersten bzw. zweiten Generation (FGA, first generation antipsychotics; SGA, second generation antipsychotics). Einen Überblick über die bei uns zugelassenen SGA gibt Tabelle 3. Allen gemeinsam sind eine sehr gute, aber nicht relevant bessere antipsychotische Wirkung (einzige sicher belegte Ausnahme ist Clozapin) und etwas bessere Effekte auf die schizophrene Negativsymptomatik, wobei diese Effekte von Präparat zu Präparat unterschiedlich ausgeprägt sind. Als gemeinsamer Nenner aller SGA gilt die geringere Prävalenz von EPS; deren Ausprägung variiert allerdings von Substanz zu Substanz, von „fast gar nicht“ bei Clozapin bis „dosisabhängig deutlich reduziert“ (im Vergleich zu FGA) beispielsweise bei Risperidon.
Tab. 3. Antipsychotika der 2. Generation: Dosierung und Darreichungsform
|
Substanz |
Approx. CPZ-Äquivalent |
Orale Tagesdosis [mg] |
Orale Tageshöchstdosis [mg] |
Darreichungsform |
|
Amisulprid |
0,2 |
50–1200 |
1200 |
Tbl., Trpf. |
|
Aripiprazol |
40 |
5–30 |
30 |
Tbl., Schmelztbl., Depot |
|
Cariprazin |
40 |
1,5–6 |
6 |
Tbl. |
|
Clozapin |
1 |
12,5–450 |
900 |
Tbl., Inj. |
|
Olanzapin |
50 |
5–20 |
20 |
Tbl., Schmelztbl., Inj., Depot |
|
Paliperidon |
25 |
6–12 |
12 |
Tbl., Depot |
|
Quetiapin |
1 |
150–900 |
1200 |
Tbl. |
|
Risperidon |
50 |
2–6 |
8 |
Tbl., Depot, Schmelztbl., Trpf. |
|
Sertindol |
50 |
4–20 |
24 |
Tbl. |
|
Sulpirid |
0,2 |
200–1600 |
3200 |
Tbl., Kps., Liqu., Inj. |
|
Ziprasidon |
2,5 |
40–160 |
160 |
Tbl., Inj. |
CPZ-Äquivalent: siehe Tab. 1.
Die pharmakologischen Grundlagen dieser atypischen Eigenschaften waren lange nicht bekannt, zumal alle diese Substanzen auch Antagonisten an zentralen Dopamin-D2-Rezeptoren waren. Da fast alle darüber hinaus auch viele andere Rezeptoren mit teilweise sehr hoher Affinität antagonisierten, ging man ursprünglich davon aus, dass andere Rezeptoren als der D2-Rezeptor direkt für die atypischen Eigenschaften verantwortlich sind.
In dieses Konzept passten nicht die atypischen Substanzen Sulpirid und Amisulprid als eher reine D2/D3-Antagonisten. Auf Basis dieser und einer Reihe von weiteren Daten gehen wir heute davon aus, dass alle Atypika auch über eine D2-Blockade primär in mesolimbischen Strukturen antipsychotisch wirken (in Analogie zu den Typika). Im Unterschied zu den Typika inhibieren aber die Atypika in den Basalganglien über verschiedene, bei den einzelnen Substanzen unterschiedlich ausgeprägte Mechanismen die über D2-Rezeptoren vermittelte dopaminerge Neurotransmission funktionell geringer, mit der Konsequenz von fast keinen bis zumindest deutlich reduzierten EPS. Ähnliches gilt auch für die dopaminerge Hemmung der Prolactin-Freisetzung in der Hypophyse.
Als eine Ursache für die weniger starke Hemmung der dopaminergen Neurotransmission im striatalen dopaminergen System konnten die starken 5-HT2-antagonistischen Eigenschaften vieler Atypika identifiziert werden; hierdurch wird die physiologische, über 5-HT2-Rezeptoren vermittelte serotoninerge Hemmung der Dopamin-Freisetzung verringert, was zu einer erhöhten Dopaminkonzentration an den Synapsen führt, die dann durch Kompetition die Rezeptorbesetzung durch das Atypikum reduzieren kann. Darüber hinaus zeigen einige Atypika eine besondere D2-Rezeptorbindungskinetik (schnelle Zeitkonstante der Dissoziation), die der hohen synaptischen Dopaminkonzentration im Striatum zusätzlich erlaubt, das Atypikum vom D2-Rezeptor zu verdrängen. Beide Mechanismen können allein (schnelle Dissoziation bei Amisulprid; 5-HT2-Antagonismus bei Risperidon) oder auch in Kombination (verschiedene andere Atypika) erklären, dass bei den Atypika eine bevorzugte funktionelle D2-Blockade im mesolimbischen System stattfinden kann, obwohl sich die D2-Rezeptoren in beiden Arealen nicht unterscheiden (Abb. 2).
Aus dem Raster der Atypika mit regional selektiver D2-Rezeptor-Bindung (mesolimbisch stärker als striatal) fallen Substanzen mit reduzierter intrinsischer Aktivität am D2-Rezeptor heraus, da sie bei hoher dopaminerger Aktivität antagonistisch, bei geringer dopaminerger Aktivität aber agonistisch wirken können. Aripiprazol war die erste Substanz aus der Gruppe der D2-Partialagonisten, bei der diese balancierte Beeinflussung der dopaminergen Neurotransmission in Abhängigkeit vom dopaminergen Grundtonus gelang, daher auch der manchmal benutzte Begriff eines Dopaminstabilisators. Cariprazin (bei uns zugelassen) und Brexpiprazol (bei uns noch nicht – aber z. B. in der Schweiz – erhältlich) sind weitere Dopaminpartialagonisten. In Arealen wie der Hypophyse bzw. dem Striatum reicht die relativ geringe dopaminerge Stimulation bei voller Rezeptorbesetzung aus, um die durch Dopamin vermittelte Funktion aufrecht zu halten (Hemmung der Prolactinfreisetzung in der Hypophyse; Steuerung der extrapyramidalen Motorik im Striatum). In mesolimbischen Arealen reicht selbst bei vollständiger Besetzung der D2-Rezeptoren die dopaminerge Stimulation nicht für propsychotische Effekte aus, die antagonistische Komponente überwiegt mit der Konsequenz einer guten antipsychotischen Wirkung. Die selektivere Antagonisierung mesolimbischer versus striataler dopaminerger Mechanismen geht darüber hinaus auch auf die unterschiedliche funktionelle Beeinflussung präsynaptischer D2-Rezeptoren durch einen Partialagonisten in beiden Arealen zurück [8].
Einen Überblick über die Beeinflussung der zentralen dopaminergen Neurotransmission durch Antipsychotika gibt Abbildung 2.
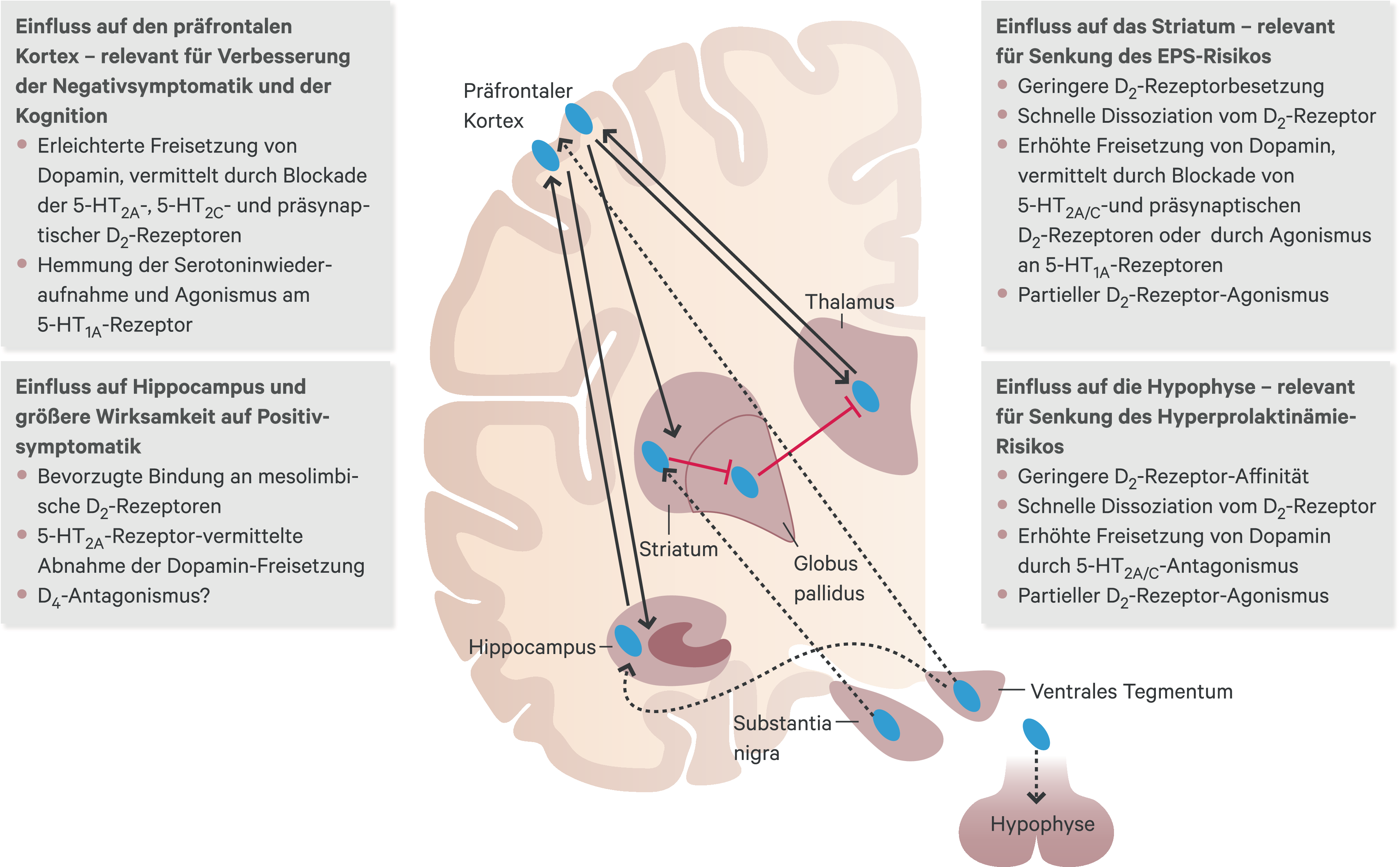
Abb. 2. Schematische Darstellung der Beeinflussung der relevanten zentralen dopaminergen Systeme durch Antipsychotika. In allen vier Arealen zeigen alle Antipsychotika als gemeinsamen Nenner eine Blockade von D2-Rezeptoren. Dargestellt sind die Mechanismen, die die atypischen Antipsychotika von den typischen unterscheiden.
Effekte an anderen Neurorezeptoren als Basis zusätzlicher erwünschter Eigenschaften und UAW
Die meisten typischen und atypischen Antipsychotika haben neben den beschriebenen antidopaminergen Eigenschaften breite, variable Rezeptorprofile, das heißt, sie binden in unterschiedlichem Maß an verschiedene weitere Neurorezeptoren (fast immer als Antagonisten; Tab. 4). Diese zusätzlichen Rezeptorprofile haben keinen wesentlichen Effekt auf die eigentliche antipsychotische Wirkung, können aber zu den geringen EPS im Fall der SGA beitragen (siehe oben, 5-HT2-Antagonismus). Darüber hinaus können diese zusätzlichen Rezeptorprofile zu den über die eigentliche antipsychotische Wirkung hinausgehenden Eigenschaften der individuellen Antipsychotika beitragen (Wirkung auf die schizophrene Negativsymptomatik, antidepressive, anxiolytische und prokognitive Effekte). Diese individuellen Eigenschaften gewinnen heute besonders im Fall der primär eingesetzten Atypika bei der differenzialtherapeutischen Wirkstoffauswahl immer mehr an Bedeutung.
Tab. 4. Rezeptorbindungsprofile atypischer Antipsychotika (im Vergleich zu Haloperidol)
|
Substanz |
D1 |
D2 |
D3 |
D4 |
5-HT2A |
5-HT1A |
α1 |
α2 |
Hist. |
Musk. |
|
Haloperidol |
+ |
+++ |
– |
– |
++ |
– |
+++ |
++ |
+ |
+ |
|
Clozapin |
++ |
++ |
+ |
++ |
+++ |
++ |
+++ |
++ |
+++ |
+++ |
|
Risperidon |
+ |
+++ |
++ |
+++ |
+++ |
++ |
+++ |
+++ |
+ |
– |
|
Paliperidon |
+ |
+++ |
++ |
+++ |
+++ |
++ |
++ |
+ |
+ |
– |
|
Olanzapin |
++ |
++ |
++ |
++ |
++ |
– |
+++ |
++ |
+++ |
+++ |
|
Sertindol |
++ |
+++ |
+++ |
+++ |
+++ |
– |
+++ |
+ |
– |
– |
|
Amisulprid |
– |
+++ |
+++ |
– |
– |
– |
– |
– |
– |
– |
|
Quetiapin |
+ |
++ |
+ |
– |
++ |
+ |
++ |
++ |
+ |
– |
|
Ziprasidon |
+ |
+++ |
+++ |
++ |
+++ |
+++ |
+++ |
++ |
++ |
– |
|
Aripiprazol |
– |
+++1 |
++1 |
– |
+++ |
++1 |
– |
– |
– |
– |
|
Cariprazin |
– |
+++1 |
++1 |
– |
+ |
+++1 |
+ |
– |
– |
– |
D1–D4: Dopamin-Typ-1–4-Rezeptorblockade; 5-HT2A–1A: Serotonin-Typ-2A- und 1A-Rezeptorblockade; α1–α2: Noradrenalin-Typ-α1- und α2-Rezeptorblockade; Musk.: Acetylcholinrezeptorblockade, muskarinerg; Hist.: Histamin-Typ-1-Rezeptorblockade
+++ = stark, ++ = mäßig, + = schwach; 1 Wirkung als Partialagonist
Bei der Interpretation solcher Rezeptorprofile muss man immer berücksichtigen, dass alle Antipsychotika (FGA und SGA) immer so dosiert werden, dass am Dopamin-D2-Rezeptor in nichtstriatalen Strukturen eine ausreichende Okkupation erreicht wird. Rezeptoren, an denen die jeweilige Substanz mit höherer Affinität binden, sind unter diesen Bedingungen ebenfalls maximal okkupiert. Bei Rezeptoren mit ähnlicher wie der D2-Affinität muss man unter therapeutischen Bedingungen noch mit relevanten Effekten rechnen. Alle anderen Rezeptoren mit Affinitäten geringer als die D2-Affinitäten spielen bei therapeutischen Dosierungen eher keine wesentliche Rolle (Abb. 1). Dies kann gegebenenfalls bei Überdosierungen anders sein.
Erwünschte und unerwünschte Wirkungen der Antipsychotika in Abhängigkeit von den jeweiligen Rezeptorbindungseigenschaften zeigt Tabelle 2.
Dopamin-Rezeptoren
Die zentrale Rolle des Antagonismus an D2/D3-Rezeptoren für die antipsychotische Wirkung aller Antipsychotika wurde bereits beschrieben. Substanzen, die nur diesen Mechanismus zeigen (Sulpirid und besonders Amisulprid), sind vollwirksame Antipsychotika, wobei dem D2-Antagonismus die Hauptrolle zukommt. Partialagonistische Effekte am D3-Rezeptor sind vermutlich an der relativ häufigen UAW Akathisie von Aripiprazol und besonders Cariprazin beteiligt. D4-Antagonismus wird heute als eher nicht relevant für antipsychotische Effekte beispielsweise von Clozapin angesehen. Im präfrontalen Cortex sind an der postsynaptischen dopaminergen Übertragung Dopamin-D1-Rezeptoren von größerer Bedeutung als D2-Rezeptoren. Ihre Aktivierung durch indirekte Dopamin-Freisetzung über 5-HT1A-Rezeptoren scheint für prokognitive Effekte einiger, aber nicht aller SGA von Bedeutung zu sein (Abb. 2).
In Dosierungen, mit denen noch keine für eine antipsychotische Wirkung ausreichende D2-Okkupation erzielt wird, überwiegt bei den meisten Antipsychotika eine präsynaptische D2-Blockade mit der Konsequenz einer erhöhten synaptischen Dopaminkonzentration, was direkt anxiolytische und antidepressive Effekte bewirken kann („Imap“-Prinzip).
Bei höheren Dosen wird allerdings dieser Effekt durch die postsynaptische D2-Blockade aufgehoben.
Serotonin-Rezeptoren
Eine Hemmung der über 5-HT2A-Rezeptoren vermittelten serotoninergen Hemmung der Dopamin-Freisetzung im Striatum ist der wesentliche Mechanismus der geringen EPS-Problematik der meisten SGA (Abb. 2). Blockade von 5-HT2C- zusammen mit H1-Rezeptoren gilt als wesentliche Ursache der zum Teil dramatischen Gewichtszunahmen bei Atypika und der damit verbundenen metabolischen UAW. Verschiedene SGA sind partielle Agonisten an 5-HT1A-Rezeptoren mit damit verbundenen direkten anxiolytischen und antidepressiven und indirekten (über präfrontale Dopaminfreisetzung) prokognitiven Effekten (Abb. 2). Diese Eigenschaften werden vermehrt bei kognitiven Störungen im Rahmen einer schizophrenen Erkrankung oder auch zur Augmentierung (off Label) der Antidepressiva in der Depressionstherapie ausgenutzt.
Andere Rezeptoren
Viele FGA und SGA sind starke Antihistaminika (H1-Rezeptorantagonisten) und haben über diesen Mechanismus sedierende und schlafanstoßende Eigenschaften. In der Kombination mit 5-HT2C-antagonistischen Effekten führen starke antihistaminerge Effekte zu den zum Teil massiven Appetitsteigerungen und Gewichtszunahmen bei einigen SGA, aber auch einige der älteren FGA führten zu deutlichen, wenn auch nicht so ausgeprägten Gewichtsproblemen. Eine Blockade von M1-muskarinergen Acetycholinrezeptoren ist der Grund für die starken zentralen und peripheren typischen anticholinergen UAW vieler FGA und SGA, für kognitive Einschränkungen und erhöhtes Delirrisiko besonders auch in Kombination mit anderen ebenfalls anticholinerg wirksamen Medikamenten. Eine Reduktion des EPS-Risikos im Sinne eines eingebauten „Biperiden“ wurde immer postuliert, besonders auch bei Clozapin, ist aber nicht sicher belegt. Die sehr häufige Hypersalivation, die man unter Clozapin sieht, scheint dagegen durch agonistische Effekte am M4-Rezeptor ausgelöst zu sein.
Einige Antipsychotika sind potente Antagonisten von adrenergen Alpha1-Rezeptoren mit den typischen kardiovaskulären UAW wie Hypotension und orthostatische Dysregulation. Einige wenige sind auch Alpha2-Antagonisten mit direkten antidepressiven Eigenschaften analog zu dem Antidepressivum Mirtazapin (z. B. Asenapin, Brexpiprazol).
Klinische Psychopharmakotherapie
Präparate-Übersicht
Antipsychotika der 1. Generation (FGA)
Als Antipsychotika der 1. Generation (Tab. 1) sind die älteren von Chlorpromazin abgeleiteten Substanzen anzusehen, mit zum Teil ähnlicher (Phenothiazine) oder unterschiedlicher Grundstruktur wie Thioxanthene (z. B. Flupenthixol), Butyrophenone (z. B. Haloperidol ) oder Diphenylbutylpiperidine (z. B. Fluspirilen). Ihre antipsychotische Wirkung ist immer auch mit extrapyramidal-motorischen Symptomen assoziiert. Ihre Wirksamkeit ist primär auf die Plussymptome limitiert. Eine Beeinflussung der Minus- bzw. Negativsymptomatik ist üblicherweise nicht festzustellen; hierbei handelt es sich um Symptome wie Anhedonie, Alogie, Antriebsmangel und sozialer Rückzug, die bei vielen schizophrenen Patienten im Erkrankungsverlauf zu beobachten sind und sehr häufig einen stärkeren Einfluss auf den weiteren Erkrankungsverlauf beinhalten als die Plussymptome.
Eingesetzt werden heute noch einige Substanzen mit sehr hoher D2-Affinität (hochpotente) mit starker antipsychotischer Wirkung und starken extrapyramidal-motorischen Nebenwirkungen bei gering ausgeprägter Sedierung und Antriebshemmung aufgrund eines deutlichen Affinitätsabstands zwischen D2-Okkupation und Bindung an andere Rezeptoren (Abb. 1). Sie werden primär bei der Therapie produktiv psychotischer Symptome wie Wahn, Wahrnehmungsstörungen und Ich-Störungen eingesetzt, besonders auch in der Akuttherapie.
Antipsychotika mit niedriger D2-Affinität (mittel- bis niederpotente) zeigen bei den üblichen zumutbaren Dosen keine ausreichende antipsychotische Wirkung wegen unvollständiger D2-Okkupation und damit geringe extrapramidal-motorische Nebenwirkungen bei starker Sedierung und Antriebshemmung (wegen deutlicher Effekte an anderen Rezeptoren) und werden vornehmlich zur Sedierung und Dämpfung psychotischer Erregungszustände eingesetzt. In der Klinik findet sich häufig eine Kombination nieder- und hochpotenter Antipsychotika.
Antipsychotika der 2. Generation
Pharmakologisch handelt es sich bei den Antipsychotika der 2. Generation (Tab. 3) um eine äußerst heterogene Gruppe von Substanzen. Sie weisen ebenfalls breite Rezeptorprofile auf (Ausnahme Amisulprid und Sulpirid), die aber in ihrer Mischung im Gegensatz zu den FGA Grund der atypischen Eigenschaften sind (besonders 5-HT2A-Antagonismus); ähnlich wie bei den FGA sind sie aber auch UAW-relevant. Die wichtigsten Substanzen der Gruppe werden im Folgenden kurz vorgestellt.
Amisulprid. Amisulprid ist ein Benzamid-Derivat. Es blockiert nahezu ausschließlich die D2-Rezeptoren, reichert sich aber mehr im mesolimbischen (antipsychotische Wirkung) und tuberoinfundibulären (Prolactinerhöhung) System und weniger im nigrostriatalen System an, sodass extrapyramidal-motorische Nebenwirkungen relativ gering sind. Die Dosierung beträgt 400 bis maximal 1200 mg/Tag. Pharmakokinetische Interaktionen sind nicht bekannt, da es vorwiegend unverändert rein renal eliminiert wird. Amisulprid ist zur Behandlung von akuten und chronischen Schizophrenien mit Positiv- und Negativsymptomatik zugelassen.
Aripiprazol. Aripiprazol ist ein Dichlorphenylpiperazin-Derivat und ein D2-Rezeptorantagonist mit intrinsischer D2-agonistischer Wirkung (partieller Agonist) sowie ein partieller Agonist an 5-HT1A-Rezeptoren. Durch diesen komplexen Wirkungsmechanismus kann eine gute Wirksamkeit auf die Positivsymptomatik wie auch auf die Negativsymptomatik postuliert werden. Zu Beginn der Behandlung wird in 10 bis 20 % der Fälle eine Akathisie beobachtet. Gewichtszunahme, Hyperprolaktinämie, QTc-Zeit-Verlängerungen und Sedierung sind selten. Die Dosierung beträgt 10 bis 30 mg/Tag. Aripiprazol ist zur Behandlung von Schizophrenien und von mäßigen bis schweren Manien und deren Rezidivprophylaxe zugelassen. Seit 2013 ist Aripiprazol auch als Depot verfügbar.
Asenapin. Asenapin blockiert D2- und 5-HT2A-Rezeptoren und ist seit 2011 zur Behandlung mäßiger bis schwerer manischer Episoden bei bipolarer Störung zugelassen. Die Dosierung liegt zwischen 10 und 20 mg/Tag.
Clozapin. Clozapin kam als erstes Antipsychotikum der zweiten Generation bereits in den 70er-Jahren auf den Markt. Aufgrund zum Teil tödlich verlaufender Agranulozytose wurde es in einigen Ländern vorübergehend wieder vom Markt genommen, ist aber seit 1979 unter besonderen Auflagen und kontrollierten Bedingungen wieder zugelassen. Clozapin ist der Goldstandard eines „atypischen Neuroleptikums“ bzw. eines Antipsychotikums der 2. Generation, da bei einer Clozapin-Therapie keine extrapyramidal-motorischen Nebenwirkungen beobachtet werden. Clozapin hat eine hohe Affinität zu H1-, Alpha1-, 5-HT2A-, 5-HT2C-, mACh (M1-) und D4-Rezeptoren und eine niedrige Affinität zu D1-, D2-, D3-, D5-, 5-HT1A-, 5-HT3-, Alpha2- und mACh (M2-) Rezeptoren. Entgegen früheren Konzepten geht man heute davon aus, dass auch bei Clozapin die antipsychotische Wirkung über eine ausreichende Blockade extrastriataler D2-Rezeptoren vermittelt wird. Clozapin hat eine ausgeprägte initial dämpfende Wirkung. Es wird fast ausschließlich hepatisch verstoffwechselt (primär Cytochrom P450 [CYP] 1A2, aber auch CYP2C19 und CYP3A4) und darf wegen des erhöhten Agranulozytose-Risikos nur bei Therapieresistenz oder Unverträglichkeit von mindestens zwei Antipsychotika nach schriftlicher Aufklärung und unter regelmäßigen Blutbildkontrollen verordnet werden. Der heute zum Teil zu beobachtende sehr lockere Umgang mit diesen Vorgaben ist als sehr kritisch anzusehen. Die wichtigsten Kontraindikationen sind hämatologische Erkrankungen oder medikamentös bedingte Blutbildveränderungen, ein erhöhtes Krampfrisiko und schwere kardiale Erkrankungen. Bei therapieresistenten schizophrenen Erkrankungen zeigt Clozapin eine Überlegenheit gegenüber den anderen Antipsychotika. Darüber hinaus besitzt es antisuizidale Eigenschaften.
Olanzapin. Olanzapin ist ein Dibenzepin-Derivat. Es blockiert neben 5-HT2- und D1–5-Rezeptoren auch mACh-, Alpha1- und H1-Rezeptoren. Olanzapin zeigt ein geringes Risiko für extrapyramidal-motorische Nebenwirkungen. Wichtige unerwünschte Arzneimittelwirkungen sind jedoch deutliche Gewichtszunahmen, die Gefahr eines metabolischen Syndroms sowie eines Diabetes mellitus. Olanzapin ist zur Behandlung und Rezidivprophylaxe sowohl der Schizophrenie wie auch mäßiger bis schwieriger Manien bei bipolaren Störungen zugelassen. Die Dosierung beträgt 5 bis 20 mg/Tag, Olanzapin ist auch als i. m. Präparat zur Akuttherapie und als Depot-Präparat verfügbar. Patienten, die mit Olanzapinpamoat behandelt werden, müssen nach Injektion für mindestens drei Stunden auf Anzeichen auf eine Olanzapin-Überdosierung (Postinjektionssyndrom) überwacht werden.
Quetiapin. Quetiapin ist ein Dibenzothiazepin-Derivat und blockiert H1- und Alpha1-Rezeptoren stärker als D2-Rezeptoren. Der Hauptmetabolit ist ein Noradrenalin-Wiederaufnahmehemmer, was die direkt antidepressiven Eigenschaften von Quetiapin erklärt. Die Dosierung beträgt in der Behandlung von Schizophrenien und Manien 400 bis 800 mg/Tag, bei Depressionen durchschnittlich 200 bis 300 mg/Tag. Quetiapin ist zur Behandlung der Schizophrenie sowie mäßiger bis schwerer Manien und schwerer depressiver Episoden bei bipolarer Störung (einschließlich deren Rezidivprophylaxe) zugelassen. Es besitzt nur ein geringes Risiko für extrapyramidal-motorische Nebenwirkungen und einen Prolactin-Anstieg, führt jedoch, ebenso wie Olanzapin, häufig zu erheblichen Gewichtszunahmen mit der Gefahr eines metabolischen Syndroms inklusive eines Diabetes mellitus.
Risperidon. Risperidon ist ein Dibenzisoxazol-Derivat. Es blockiert vor allem 5-HT2-, D2- und Alpha1-Rezeptoren und wird über CYP2D6 zu 9-Hydroxy-Risperidon (Paliperidon) metabolisiert. Die Dosierung beträgt 0,5 bis 6 mg/Tag. Eine Dosierung über 4 mg täglich kann zu extrapyramidal-motorischen Nebenwirkungen und Prolactin-Erhöhung führen.
Risperidon ist zur Behandlung von Schizophrenien, mäßigen bis schweren Manien bei bipolarer Störung, Aggressionen im Rahmen der Alzheimer-Demenz sowie von Verhaltensstörungen bei Kindern und Jugendlichen mit geistiger Retardierung zugelassen. Als Depot-Präparate stehen Risperidon-Microsphären mit einem Applikationsintervall von zwei Wochen und Paliperidonpalmitat in einem Injektionsintervall von vier Wochen bzw. von drei Monaten zur Verfügung.
Sertindol. Sertindol ist ein Phenylindolpiperidin. Es blockiert in erster Linie 5-HT2A-, 5-HT6-, 5-HT7-, D2- und Alpha2-Rezeptoren mit einer mittelstarken Affinität zu D1- und D4-Rezeptoren, zeigt keine Blockade von H1-Rezeptoren und keine nachweisbaren anticholinergen Wirkungen. Sertindol wurde nach der Einführung wegen kardiovaskulärer Nebenwirkungen (vor allem QT-Zeit-Verlängerungen) vom Markt genommen und 2006 wieder eingeführt. Die Verordnung darf nur bei Patienten erfolgen, die ein anderes Antipsychotikum nicht vertragen haben oder therapieresistent sind. Regelmäßige EKG-Kontrollen sind obligat.
Ziprasidon. Ziprasidon ist ein Benzisothiazoylpiperazin-Derivat. Es blockiert in erster Linie 5-HT2A/C-Rezeptoren und zeigt eine mittelstarke Affinität zu D2- und H1-Rezeptoren. Ziprasidon besitzt nur eine geringe Affinität zu D1- und Alpha2-Rezeptoren und keine Affinität zu mACh-Rezeptoren. Die Dosierung liegt zwischen 80 und 160 mg/Tag. Ziprasidon ist zur Behandlung der Schizophrenie sowie von leichten bis mäßigen manischen und gemischten Episoden bei bipolaren Störungen zugelassen. Ziprasidon ist relativ gewichtsneutral und führt selten zur Prolactin-Erhöhung, verursacht dosisabhängig aber einer Verlängerung des QTc-Intervalls.
Lurasidon. In den USA ist Lurasidon in einer Dosis von 40 bis maximal 160 mg pro Tag zur Behandlung der Schizophrenie zugelassen. Lurasidon zeigt eine hohe Affinität zu D2-Rezeptoren, 5-HT2A- und 5-HT7-Rezeptoren sowie Alpha1- und Alpha2-Rezeptoren und nur eine geringe Affinität zu H1- und mACh-Rezeptoren. Die Substanz ist weitgehend gewichtsneutral, führt jedoch relativ häufig zur Akathisie.
Loxapin. Loxapin ist ein Dibenzoxazepin und in den USA schon lange in oraler Form bis 50 mg täglich zugelassen. Es blockiert D2- und 5-HT2A-Rezeptoren und hat anticholinerge, antihistaminerge und adrenerge Nebenwirkungen. In Deutschland wurde es 2013 nur als inhalatives Antipsychotikum zur Kontrolle leichter bis mittelschwerer Agitiertheit bei erwachsenen Patienten mit Schizophrenie oder bipolarer Störung zugelassen.
Indikationen
Mögliche klinische Effekte der Antipsychotika in Bezug zu ihrem pharmakologischen Wirkungsmechanismus sind in Tabelle 2 dargestellt.
Primäre Indikationen für Antipsychotika sind:
- Akutbehandlung und Rezidivprophylaxe der Schizophrenie
- Behandlung der akuten Manie und bipolarer Depressionen sowie Rezidivprophylaxe bipolarer Depressionen
- Behandlung Psychose-assoziierter Symptome (Erregung, Hostilität)
- Behandlung psychotischer (wahnhafter) Depressionen
- Behandlung akuter Erregungszustände oder psychotischer Symptomatik im Rahmen verschiedener psychischer Störungen, beispielsweise bei organischen psychischen Störungen
- Behandlung der Alkoholhalluzinose
- Behandlung von psychomotorischer Unruhe und Schlafstörungen im Rahmen verschiedener psychischer Erkrankungen
- Behandlung motorisch-neurologischer Störungen (z. B. Tics, Dyskinesien, Tourette-Syndrom, Chorea)
Die Wirksamkeit aller Antipsychotika in der Therapie schizophrener Erkrankungen ist durch zahlreiche Placebo-kontrollierte Doppelblindstudien und Metaanalysen belegt. Für die anderen Indikationen gibt es nicht für alle Antipsychotika Zulassungen.
Antipsychotika in der Therapie schizophrener Erkrankungen
Bei der Behandlung schizophrener Erkrankungen ist zwischen der Akuttherapie und einer sich anschließenden Erhaltungstherapie sowie in der Regel einer Langzeittherapie zu unterscheiden.
In der Akuttherapie schizophrener Störungen liegt der Schwerpunkt häufig auf der Medikation. Die Akuttherapie dient vorwiegend der Symptomkontrolle und der Reduktion von Eigen- und Fremdgefährdung. Hierzu zählt die konsequente Behandlung im Rahmen akuter Exazerbationen mit häufig vorliegender Positivsymptomatik.
Die sich anschließende Erhaltungstherapie dient der Stabilisierung einer postakuten Übergangszeit mit häufig weiterhin bestehender aber wenig beeinträchtigender Symptomatik mit dem Ziel der vollständigen, auch funktionellen Remission.
In der Langzeittherapie sind die Verhinderung von Rezidiven und Chronifizierung der Morbidität und Mortalität der Patienten mit schizophrener Störung ein Schwerpunkt der antipsychotischen Therapie.
Akuttherapie
Die antipsychotische Wirksamkeit von Antipsychotika der 1. und 2. Generation ist in der Akutbehandlung produktiv psychotischer Symptome schizophrener Erkrankung durch Metaanalysen sehr gut belegt. Die Besserungsraten liegen bei etwa 75 % gegenüber Besserungsraten von etwa 25 % unter Placebo. Zwischen den einzelnen Substanzen gibt es (abgesehen von Clozapin) im Wesentlichen keine Wirksamkeitsunterschiede, weshalb die Wahl des Antipsychotikums in erster Linie nach Kriterien wie Wirksamkeit bei früherer Behandlung oder Nebenwirkungsprofil erfolgt. Auch die therapeutische Überlegenheit der Antipsychotika der 2. Generation gegenüber den Antipsychotika der 1. Generation ist nicht belegt. Dennoch ist der Vorteil der geringeren extrapyramidal-motorischen Nebenwirkungen der Antipsychotika der 2. Generation von großer Relevanz. Aufgrund dieser Tatsache haben sich die Antipsychotika der 2. Generation in den letzten Jahren als Mittel der ersten Wahl bei der Behandlung von Schizophrenien durchgesetzt. Die Wahl des einzusetzenden Antipsychotikums ist damit weniger von der Frage der antipsychotischen Wirksamkeit als von den im Folgenden zu besprechenden Problemen wie UAW, Interaktionen und Therapieresistenz abhängig (siehe auch die zusammenfassende Tabelle am Ende des vorliegenden Beitrags).
Die einzige Substanz, für die eine Überlegenheit gegenüber anderen Antipsychotika festgestellt werden konnte, ist Clozapin. Clozapin darf wegen des Agranulozytose-Risikos allerdings nur bei Patienten eingesetzt werden, die auf mindestens zwei Antipsychotika nicht angesprochen oder mit ausgeprägten unerwünschten Wirkungen reagiert haben.
Die Dosierung des Antipsychotikums variiert individuell. In der Regel sollte einschleichend dosiert werden. Tabelle 5 gibt den Dosisbereich der einzelnen Antipsychotika in der Akut- und Langzeittherapie wieder. Das erste Ziel in der Akutphase der Behandlung ist die Besserung von Verhaltensauffälligkeiten, die mit ausgeprägten Denk- und Wahrnehmungsstörungen und nicht selten mit Eigen- und/oder Fremdgefährdung einhergehen.
Tab. 5. Empfohlene Dosierung in der antipsychotischen Therapie
|
Akutverlauf |
Langzeitverlauf |
||||||
|
Substanz |
Empfohlene Startdosis |
Zieldosis Ersterkrankte |
Zieldosis Mehrfacherkrankte |
Höchste empfohlene Dosis [mg/Tag] |
Zieldosis Ersterkrankte |
Zieldosis Mehrfacherkrankte |
Höchste empfohlene Dosis [mg/Tag] |
|
Atypische Antipsychotika |
|||||||
|
Amisulprid |
200 |
100–300 |
400–800 |
1200 |
200 |
100–800 |
1200 |
|
Aripiprazol |
5 |
15(–30) |
15–30 |
30 |
15 |
15–30 |
30 |
|
Cariprazin |
1,5 |
3 |
4,5 |
6 |
3 |
3 |
6 |
|
Clozapin |
12,5 |
100–250 |
200–450 |
900 |
100–500 |
200–550 |
900 |
|
Olanzapin |
5–10 |
5–15 |
5–20 |
20 |
5–20 |
10–20 |
20* |
|
Quetiapin |
50 |
300–800 |
400–1000 |
1000 |
300–800 |
300–1000 |
1000 |
|
Risperidon |
2 |
1–4 |
3–6 |
6 |
2–4 |
2–6 |
8 |
|
Ziprasidon |
40 |
40–80 |
80–160 |
160 |
80–160 |
80–160 |
160 |
|
Konventionelle Antipsychotika |
|||||||
|
Flupentixol |
2–10 |
2–10 |
10–60 |
60 |
2–10 |
2–15 |
20(–60) |
|
Fluphenazin |
0,4–10 |
2,4–10 |
10–20 |
20(–40) |
2,5–12,5 |
3–15 |
20(–40) |
|
Haloperidol |
1–10 |
1–4 |
3–20 |
20 |
1–5 |
2–15 |
20 |
|
Perazin |
50–150 |
100–300 |
200–600 |
1000 |
50–200 |
200–600 |
1000 |
|
Perphenazin |
4–24 |
6–36 |
2–42 |
56 |
6–36 |
3–36 |
56 |
|
Pimozid |
1–4 |
1–4 |
2–12 |
16 |
2–6 |
2–8 |
16 |
* Höhere Dosierungen werden laut Fachinformationen nicht empfohlen, wurden aber unter bestimmten Behandlungsbedingungen (z. B. bei Therapieresistenz) in klinischen Studien verwendet.
Handelt es sich um eine schizophrene Ersterkrankung und zeigt der Patient eine gute Remission, sollte die antipsychotische Medikation etwa ein bis zwei Jahre beibehalten und dann unter engmaschiger Kontrolle vorsichtig ausgeschlichen werden.
Bei Zweit- oder Mehrfachmanifestation einer schizophrenen Erkrankung wird im Allgemeinen eine Behandlungsdauer von zwei bis fünf Jahren vorgeschlagen.
Bei Patienten, die sehr häufig erkranken oder gar nicht remittieren, ist eine Dauertherapie angezeigt.
Erhaltungstherapie, Langzeittherapie
Eine Langzeitmedikation bzw. Rezidivprophylaxe mit Antipsychotika ist für die Behandlung der meisten schizophrenen Patienten von großer Wichtigkeit. In Placebo-kontrollierten Studien trat bei Patienten, die über ein Jahr antipsychotisch behandelt wurden, lediglich bei 25 bis 30 %, hingegen bei etwa 70 % unter Placebo ein psychotisches Rezidiv auf.
Da die Langzeitmedikation mit Antipsychotika zu den unterschiedlichsten Nebenwirkungen (inklusive Spätdyskinesien, metabolische Veränderung) führen kann, sollte grundsätzlich die niedrigst mögliche wirksame Dosis eines Antipsychotikums gewählt werden (Tab. 5). Antipsychotika der 2. Generation (z. B. Aripiprazol, Amisulprid, Olanzapin, Risperidon, Quetiapin) weisen eine deutlich geringere Rate an extrapyramidal-motorischen Nebenwirkungen auf. Cariprazin zeigt eine bessere Wirksamkeit auf die häufig vorhandene Negativsymptomatik.
Das zentrale, die Prognose entscheidende Problem der Compliance wurde durch die Antipsychotika der 2. Generation nicht nachhaltig verbessert, die Non-Compliance-Rate unter Antipsychotika der 2. Generation war in Studien nicht wesentlich geringer, unter naturalistischen Versorgungbedingungen nahezu identisch der Rate unter Antipsychotika der 1. Generation. Offensichtlich wird die UAW-Problematik in ihrer Relevanz für die Compliance überschätzt. Trotzdem gilt uneingeschränkt, bei der Therapie mit Antipsychotika den Patienten mit so wenig UAW wie möglich zu belasten, was in den meisten Fällen die Wahl auf ein SGA fallen lässt.
Für die Langzeitbehandlung bietet sich der Einsatz von Depot-Antipsychotika an (Tab. 6). Depotpräparate verbessern die Compliance. Die Injektionstermine sollten immer auch Anlass zum ärztlichen Gespräch und zur Verlaufsbeobachtung sein. Für die erfolgreiche Langzeitbehandlung schizophrener Patienten ist ein Gesamtbehandlungskonzept absolut erforderlich, das psychopharmakologische, soziotherapeutische und psychotherapeutische Elemente mit einschließt. Ziel ist, dem Patienten ein bestmögliches psychosoziales Funktionsniveau zu ermöglichen.
Tab. 6. Mögliche Vor- und Nachteile von Depot-Antipsychotika
|
Vorteile |
Nachteile |
|
|
EbM-Info
Metaanalysen zum Wirksamkeitsvergleich von Placebo und Antipsychotika in der Akuttherapie der Schizophrenie dokumentieren eine Überlegenheit von Antipsychotika gegenüber Placebo.
- FGA und SGA sind bezüglich der Gesamt- und der Positivsymptomatik effektiv in der Behandlung akuter schizophrener Symptome. Metaanalysen weisen darauf hin, dass die SGA Risperidon, Amisulprid und Olanzapin die relativ höchste Wirksamkeitswahrscheinlichkeit besitzen, sodass beim Fehlen weiterer Entscheidungskriterien (z. B. Kontraindikation, Verträglichkeitsprofil) der Einsatz dieser etablierten SGA rational erscheint.
- Für den differenzierten Einsatz von Antipsychotika sollten weitere Wirksamkeitsaspekte einer wirksamen Pharmakotherapie ins Auge gefasst werden, insbesondere Negativsymptome, kognitive Symptome, depressive Symptome und Suizidalität. Hier spielen wie besprochen die über die D2-Bindung hinausgehenden individuellen Rezeptorprofile eine wesentliche Rolle.
Unerwünschte Wirkungen von Antipsychotika
Die unerwünschten Wirkungen der Antipsychotika (Tab. 7) stehen in einem Zusammenhang mit den Rezeptorprofilen der jeweiligen Substanzen (Tab. 2 und Tab. 4) und korrelieren mit deren Einflüssen auf die verschiedenen Rezeptoren. So zeigt sich die anticholinerge Komponente in Symptomen wie Akkommodationsstörungen, Mundtrockenheit, Obstipation und Harnverhalt, die antihistaminerge Wirkung in Benommenheit und Sedierung, die antiadrenerge Wirkung durch Blutdruckabfall und Reflextachykardie. Die längerfristige Verordnung von Antipsychotika führt zudem zu einer Supersensivität der Dopamin-Rezeptoren, was als (Mit-)Ursache verschiedener Spätwirkungen, wie Spätdyskinesien, diskutiert wird.
Tab. 7. Unerwünschte Arzneimittelwirkungen atypischer Antipsychotika (im Vergleich zu Haloperidol)
|
Unerwünschte Arzneimittelwirkungen |
Typische Antipsychotika |
Clozapin |
Risperidon |
Paliperidon |
Olanzapin |
|
EPS |
+ bis +++ |
0 bis + |
0 bis ++ |
0 bis + |
0 bis + |
|
Spätdyskinesien |
+ bis +++ |
0 bis + (?) |
0 bis + (?) |
0 bis + (?) |
0 bis + (?) |
|
Krampfanfälle |
0 bis + |
+ bis +++ |
0 bis + |
0 bis + |
0 |
|
Sedierung |
+ bis +++ |
+++ |
0 bis + |
0 bis + |
+ bis ++ |
|
Malignes neuroleptisches Syndrom |
+ |
+ |
+ |
? |
? |
|
Kardiovaskuläre Effekte |
+ bis +++ |
+++ |
+ |
0 bis + |
0 bis + |
|
Transaminasenanstieg |
+ |
+ |
+ |
+ |
+ |
|
Anticholinerge Effekte |
+ bis +++ |
+++ |
0 |
0 |
0 bis ++ |
|
Agranulozytose |
0 |
+++ |
0 |
0 |
+ |
|
Prolactinanstieg |
+++ |
0 |
+ bis ++ |
+ |
0 |
|
Störungen des Orgasmus und der Ejakulation |
++ |
++ |
++ |
+ bis ++ |
+ bis ++ |
|
Gewichtszunahme |
+ |
+++ |
+ |
+ |
+++ |
|
Verstopfte Nase |
0 bis + |
0 bis + |
0 bis + |
? |
0 bis + |
|
Hauterscheinungen |
+ |
+ |
0 bis + |
? |
+ |
EP(M)S
Die wichtigsten unerwünschten Wirkungen der Antipsychotika der 1. Generation stellen die extrapyramidal-motorischen Nebenwirkungen dar. Diese treten mit umso größerer Wahrscheinlichkeit auf, je mehr antipsychotische Potenz eine Substanz besitzt.
Es werden differenziert:
- Frühdyskinesien
- Parkinsonoid
- Akathisie und Tasikinesie
- Spätdyskinesien
- Malignes neuroleptisches Syndrom
Frühdyskinesien. Unter Frühdyskinesien, die bei etwa 5 bis 30 % Patienten vorübergehend auftreten können, werden folgende Symptome subsumiert: Zungen-, Schlund-, und Blickkrämpfe (am häufigsten), unwillkürliche Bewegung der Gesichtsmuskulatur, Verkrampfung der Kiefermuskulatur (Trismus), Torticollis-artige, choreatische, athetoide und torsionsdystone Bewegungsabläufe in der Halsmuskulatur und der Muskulatur der oberen Extremitäten.
Frühdyskinesien treten fast ausschließlich zu Behandlungsbeginn auf und korrelieren mit der Geschwindigkeit der Dosissteigerung. Im weiteren Verlauf sind sie nur noch dann zu beobachten, wenn die antipsychotische Dosis plötzlich erhöht oder reduziert wird. Offenbar besteht eine individuell unterschiedliche Disposition zur Entwicklung von Frühdyskinesien, bei den meisten Patienten sind diese nie zu beobachten, bei einigen schon nach Einnahme von nur geringen Dosen. Frühdyskinesien können durch Gabe eines Anticholinergikums wie Biperiden (oral 2 bis 4 mg oder langsam i. v.) kupiert werden. Es ist zu beachten, dass die Gefahr für das Auftreten deliranter Syndrome und – aufgrund der euphorisierenden Wirkung – auch der Suchtentwicklung besteht. Das Auftreten und die inkonsequente Behandlung von Frühdyskinesien sind häufig Ursache für eine spätere Non-Compliance des Patienten.
Parkinsonoid. Das Parkinsonoid ist durch die Einschränkung zunächst der Feinmotorik, dann der gesamtmotorischen Beweglichkeit (Akinese), Erhöhung des Muskeltonus (Rigor), eines kleinschrittigen Gangs sowie Tremor und Salbengesicht charakterisiert. Das Parkinsonoid manifestiert sich meist nach 1- bis 2-wöchiger Therapie. Das Parkinson-Syndrom tritt dosisabhängig bei etwa 20 bis 30 % der Patienten auf und hängt von der Dosierung und Wirkstärke des Antipsychotikums sowie der individuellen Disposition des Patienten ab. Behandlungsstrategien wären eine eventuelle Dosisreduktion, ein Umsetzen des Antipsychotikums auf ein Antipsychotikum der 2. Generation sowie Gabe eines Anticholinergikums wie Biperiden.
Akathisie und Tasikinesie. Akathisie und Tasikinesie treten bei etwa 25 % der Patienten auf. Akathisie wird subjektiv oft als sehr quälend empfunden und äußert sich in einer Unfähigkeit, sitzen bleiben zu können (Sitzunruhe). Tasikinesie ist charakterisiert durch einen Drang zur ständigen Bewegung. Akathisie und Tasikinesie treten meist erst nach längerer antipsychotischer Behandlung auf. Differenzialdiagnostisch ist zu Akathisie das Restless-Legs-Syndrom in Erwägung zu ziehen: Im Gegensatz zu Akathisie tritt beim Restless-Legs-Syndrom die Symptomatik vor allem im Liegen auf. Medikamentöse Behandlungsoptionen mit der Gabe von Betablockern (z. B. Propranolol 3-mal 10 bis 20 mg täglich) und Benzodiazepinen (Oxazepam 10 bis 30 mg täglich, Lorazepam 1 bis 2 mg täglich).
Spätdyskinesien. Bei den Spätdyskinesien handelt es sich um abnorme unwillkürliche Bewegungen hauptsächlich der Muskeln des Kopfes und der Extremitäten. Am häufigsten sind Bewegungen im Mundbereich, wie Rausstrecken der Zunge, Schmatzbewegungen, Mahlbewegungen des Unterkiefers, ein rhythmischer Lippentremor (Rabbit-Syndrom) und Grimassieren. In schweren Fällen treten vereinzelt Schleuderbewegungen (Ballismus), Torti- und Retrocollis sowie das Pisa-Syndrom (Schiefhaltung von Kopf, Hals und Schultern) auf. Spätdyskinesien werden durch Stress verstärkt, während des Schlafs sind sie nicht vorhanden.
Spätdyskinesien entwickeln sich meist nach Jahren antipsychotischer Therapie und sind umso wahrscheinlicher, je länger der Patient mit Antipsychotika behandelt wurde. Als mögliche Ursache wird eine Überempfindlichkeit der Dopamin-Rezeptoren angenommen. Die Symptomatik ist auch nach Absetzen der Antipsychotika irreversibel bzw. es bleiben Residualsymptome. Besonders betroffen sind Patienten, die älter als 50 Jahre und zerebral vorgeschädigt sind.
Auch Antipsychotika der 2. Generation können Spätdyskinesien auslösen. Die Inzidenz liegt mit 1 % pro Jahr jedoch signifikant unter der Inzidenz von 5 % pro Jahr bei Einnahme von Antipsychotika der 1. Generation. Unter Clozapin wurden bisher keine Spätdyskinesien beschrieben. Behandlungsoptionen für Spätdyskinesien bestehen in der Umsetzung auf ein Antipsychotikum der 2. Generation (in erster Linie Clozapin). Anticholinergika wie Biperiden sind ineffizient und können sogar unter Umständen das Auftreten von Spätdyskinesien begünstigen. Gelegentlich zeigen Benzodiazepine einen positiven Effekt. Ferner kann auch ein Versuch mit Tiaprid oder Tetrabenazin unternommen werden.
Malignes neuroleptisches Syndrom. Hierbei handelt es sich um eine sehr seltene, aber schwerwiegende Nebenwirkung. Das maligne neuroleptische Syndrom tritt bei bis zu 1 % der mit Antipsychotika behandelten Patienten auf und verläuft unbehandelt in 20 bis 30 % der Fälle tödlich. Das maligne neuroleptische Syndrom kann bei jedem Antipsychotikum auftreten, ein höheres Risiko besteht allerdings bei den hochpotenten Antipsychotika der 1. Generation. Folgende Symptome entwickeln sich innerhalb von ein bis drei Tagen: extrapyramidal-motorische Störung, vor allem schwerer Rigor, Stupor, vegetative Störungen wie hohes Fieber, aber auch Tachykardien, Blutdruckveränderung, vermehrtes Schwitzen und Exsikkose sowie fluktuierende Bewusstseinsveränderung bis hin zum Koma. Das maligne neuroleptische Syndrom ähnelt in der Symptomatik der malignen Hyperthermie und kann oft nur schwer vor einer febrilen Katatonie abgegrenzt werden. Dies führt häufig zu einem therapeutischen Dilemma, da beim malignen neuroleptischen Syndrom die Antipsychotika unbedingt abgesetzt werden müssen, bei der febrilen Katatonie jedoch häufig höher dosiert werden müssen.
Im Labor ist in etwa 50 % der Fälle eine Creatinkinase-(CK-)Erhöhung festzustellen, weniger oft ein Anstieg der Leberenzyme und eine Leukozytose. Eine Myoglobinurie kann zu renalen Komplikationen führen.
Patienten mit einem malignen neuroleptischen Syndrom müssen auf einer internistischen Intensivstation behandelt werden. Das Antipsychotikum ist sofort abzusetzen, gegebenenfalls kommt die Gabe von Dantrolen, eventuell auch von Dopamin-Agonisten, beispielsweise Bromocriptin infrage. Patienten mit malignem neuroleptischem Syndrom müssen wegen der erhöhten Gefahr thromboembolischer Prozesse heparinisiert werden.
Zerebrale Krampfanfälle
Zerebrale Krampfanfälle können gelegentlich, insbesondere bei sehr schneller Aufdosierung oder hohen Dosen, bei allen Antipsychotika auftreten, das höchste Risiko besteht bei Clozapin. Bei Clozapin korreliert die Inzidenz von Krampfanfällen eng mit der Höhe des Plasmaspiegels (> 600 ng/ml). Das relative Risiko für zerebrale Krampfanfälle ist unter Clozapin (10-fach), Olanzapin (2,5-fach), Quetiapin (2-fach) erhöht. Treten unter Antipsychotika zerebrale Anfälle auf und Antipsychotika sind unverzichtbar, können Antipsychotika mit Antikonvulsiva (z. B. Valproinsäure, Lamotrigin, Pregabalin) kombiniert werden. Unter Clozapin sind vorherige und regelmäßige EEG-Kontrollen obligat.
Delirante Syndrome
Delirante Syndrome sind bei allen Substanzen mit ausgeprägter anticholinerger Wirkung (hohe Affinität zum Muskarin-Rezeptor) zu beobachten. Hierzu zählen in erster Linie Clozapin und einige niederpotente Antipsychotika der 1. Generation (z. B. Levomepromazin, Perazin). Mit Ausnahme von Olanzapin zeigen alle Antipsychotika der 2. Generation ein sehr geringes Risiko für delirante Syndrome. Das Risiko steigt bei schnellem Aufdosieren in den ersten Behandlungstagen und ist allgemein bei älteren Patienten erhöht. Das Risiko steigt ebenfalls, wenn Substanzen mit anticholinerger Komponente miteinander kombiniert werden.
Sedierung
Die Sedierung kann zu Beginn einer antipsychotischen Behandlung erwünscht sein, ist jedoch im Rahmen der Erhaltungstherapie und der Langzeittherapie häufig ausgesprochen problematisch. Besonders unter Clozapin, Olanzapin und initial Quetiapin ist die Sedierung stark ausgeprägt. Unter Risperidon oder Haloperidol ist sie gering, unter Amisulprid, Aripiprazol und Ziprasidon sowie Sertindol fehlt sie weitgehend. Eine Aufteilung der Tagesdosis, Veränderung des Einnahmezeitpunkts oder Dosisanpassungen können versucht werden. Die Sedierung wird von vielen Patienten als äußerst unangenehme unterwünschte Arzneimittelwirkung beurteilt und führt häufig zu Compliance-Problemen.
Zerebrovaskuläre Ereignisse
Sowohl Antipsychotika der 1. wie auch der 2. Generation führen bei älteren Patienten mit Demenz zu einem leicht, aber signifikant erhöhten Risiko für Mortalität und zerebrovaskuläre Ereignissen im Vergleich zu Placebo. Die Gabe von Antipsychotika bei diesen Patienten muss einer strengen Nutzen-Risiko-Abwägung unterzogen werden. Ist ihr Einsatz beispielsweise bei Aggressivität oder Wahn im Rahmen einer Demenz nicht zu umgehen, darf die Gabe nur zeitlich befristet erfolgen (maximal 3 bis 6 Monate). Das einzige für diese Indikation zugelassene Antipsychotikum ist Risperidon.
Beeinträchtigung der Psychomotorik und Reaktionsfähigkeit
Beeinträchtigung der Psychomotorik und Reaktionsfähigkeit sind für die Alltagstauglichkeit und das psychosoziale Funktionsniveau von extremer Wichtigkeit. Die Beeinträchtigung psychomotorischer Funktionen unter Antipsychotika wird zum einen durch das psychopathologische Bild der Erkrankung, den Verlauf sowie auftretende Nebenwirkungen determiniert. Von besonderer Bedeutung ist hier die Fahrtauglichkeit. Für schizophrene Patienten unter Antipsychotika ist die Frage der Fahrtauglichkeit frühestens im Rahmen der Erhaltungstherapie zu diskutieren.
Endokrine Nebenwirkungen und Sexualstörungen
Dopamin supprimiert die Ausschüttung von Prolactin. Eine Antipsychotika-induzierte Dopamin-D2-Rezeptor-Blockade führt zur Aufhebung der Suppression und damit zu einer Hyperprolaktinämie. Nahezu alle Antipsychotika können eine Hyperprolaktinämie verursachen. Unterschiede zwischen den einzelnen Antipsychotika lassen sich zum Teil über die Stärke der Dopamin-D2-Rezeptor-Blockade (dosisabhängig), über die Fähigkeit, die Blut-Hirn-Schranke zu passieren, sowie über die relative Rezeptorbindung erklären.
Antipsychotika mit erhöhtem, meist dosisabhängigem Risiko sind Amisulprid, Sulpirid, hoch- und mittelpotente FGA, Risperidon, Paliperidon, Sertindol sowie vor allem Antipsychotika-Kombinationen.
Antipsychotika mit geringem Hyperprolaktinämie-Risiko sind Aripiprazol, Asenapin, Clozapin, Olanzapin, Quetiapin und Ziprasidon.
Eine Hyperprolaktinämie kann verschiedene kurz- und langfristige Konsequenzen haben, beispielsweise Dys- oder Amenorrhö bei Frauen, Libidostörungen sowie erektile und ejakulatorische Dysfunktionen bei Männern, Störung der Brustfunktionen bei Männern und Frauen, Abnahme der Knochendichte als Folge des Estrogen- bzw. Testosteronmangels mit Gefahr der Osteoporose und ein erhöhtes Infarkt- und Arterioskleroserisiko als Folge des Estrogen- bzw. Testosteronmangels. Kontrollen der Prolactinspiegel vor Beginn der Behandlung und regelmäßig im Verlauf sind obligat. Bei Hyperprolaktinämie kann auf ein anderes Antipsychotikum umgestellt werden, das keine Prolactinerhöhung bewirkt, sowie eine Kombination mit Aripiprazol, da es darunter zu einer Normalisierung und teilweise einem Abfall des Prolactinspiegels kommt.
Metabolische Nebenwirkungen
Metabolische Nebenwirkungen (Gewichtszunahme, Diabetes mellitus, Dyslipidämie) treten vor allem unter der Therapie mit Antipsychotika der 2. Generation auf. Vor allem Clozapin und Olanzapin induzieren bei 10 bis 40 % der Patienten eine deutliche Gewichtszunahme (mehr als 10 % des Ausgangsgewichts). In diesem Zusammenhang soll nicht vernachlässigt werden, dass das Risiko schizophrener Patienten für metabolische Erkrankungen um den Faktor 1,5 bis 2 höher liegt als in der Allgemeinbevölkerung. Unter einer Langzeittherapie mit Antipsychotika haben mehr als 50 % der Patienten Adipositas mit einem Body-Mass-Index (BMI) > 30 kg/m². Bei einer Reihe von Patienten können dabei unter Clozapin- bzw. Olanzapin-Therapie Gewichtszunahmen von mehr als 20 kg auftreten. Eine Gewichtszunahme geht unter antipsychotischer Therapie häufig mit Glucose- und Lipidstoffwechselstörung einher. In Verbindung mit erhöhten Blutdruckwerten wird diese Kombination verschiedener Stoffwechselstörungen auch als metabolisches Syndrom bezeichnet.
Kardiovaskuläre Nebenwirkungen
Unter der Behandlung mit Antipsychotika sind kardiale Nebenwirkungen und Herz-Kreislauf-Komplikationen, wie Verlängerungen der QT-Zeit, Sinus-Tachykardien, Verbreiterung des QRS-Komplexes, AV-Blockierungen, orthostatische Hypotonien, Tachykardien, Myokarditiden/Kardiomyopathien und der plötzliche Herztod zu beobachten. Die QT-Zeit verkürzt sich mit steigender Herzfrequenz. Die QTc-Zeit entspricht dem um die Herzfrequenz korrigierten QT-Intervall und liegt in Abhängigkeit von Alter und Geschlecht normalerweise < 440 ms bei Männern und < 450 ms bei Frauen. Als klinisch pathologisch werden eine Verlängerung des QTc-Intervalls von > 60 ms und ein QTc-Intervall von > 500 ms angesehen. Mit zunehmender Verlängerung der QTc-Zeit nimmt das Risiko polymorph-polytoper ventrikulärer Arrhythmien mit Torsade de pointes zu. Die Risiken steigen mit abnehmender Herzfrequenz, Elektrolytstörungen und unter Einnahme von Medikamenten, die entweder gleichfalls zu einer Verlängerung der QTc-Zeit führen oder den Abbau von QTc-Zeit verlängernden Medikamenten hemmen. Verlängerungen der QTc-Zeit werden unter verschiedenen FGA und SGA beobachtet. Bei den FGA sind dies hauptsächlich Thioridazin, Melperon, Pimozid und Haloperidol in hohen Dosen. Die Verabreichung von Haloperidol i. v. sollte unter allen Umständen vermieden werden. In der Gruppe der Antipsychotika der 2. Generation kann es unter Sertindol und Ziprasidon zu einer QTc-Zeit-Verlängerung kommen. Diese QTc-Zeit-Verlängerung ist dosisabhängig und tritt meist bereits bei Therapiebeginn auf.
Vegetative Nebenwirkungen
Vegetative Nebenwirkungen sind vor allem unter der Therapie mit niederpotenten Antipsychotika der 1. Generation vom Phenothiazin-Typ zu beobachten. Mundtrockenheit und Verstopfung, Blasenentleerungsstörungen sowie orthostatische Hypotonie und kompensatorische Tachykardie sind die häufigsten vegetativen Nebenwirkungen. Eine Zunahme des Augeninnendrucks mit der Gefahr von Glaukom-Anfällen ist zu beachten. Bei den SGA sind unter Clozapin orthostatische Hypotonien und Hypersalivaton besonders häufig. Mit Ausnahme von Quetiapin (orthostatische Dysregulation) sind bei den übrigen SGA vegetative Nebenwirkungen eher selten. Dosisreduktion bzw. ein Wechsel der Substanz sind primär anzuraten. Gegebenenfalls kann eine medikamentöse Gegenmaßnahme in Erwägung gezogen werden (Tab. 8).
Tab. 8. Vegetative Nebenwirkungen der Antipsychotika und medikamentöse Gegenmaßnahmen
|
Nebenwirkung |
Empfehlungen für medikamentöse Gegenmaßnahmen |
|
Hypersalivation |
Pirenzepin (50 mg/Tag), |
|
Hypotonie, orthostatische |
Dihydroergotamin (2,5–5 mg/Tag), |
|
Miktionsstörungen |
Distigmin (5–10 mg/Tag), |
|
Mundtrockenheit |
Zuckerfreier Kaugummi, künstlicher Speichel |
|
Obstipation |
Lactulose (5–10 g/Tag), |
|
Schwitzen |
Salbeiextrakt extern bzw. als Drg., in schweren Fällen Atropinsulfat (0,5–1,5 mg/Tag) |
|
Tachykardie |
Betablocker: Metoprolol (50–100 mg/Tag), Propranolol (10–40 mg/Tag) |
Hämatopoetisches System
Die Behandlung mit Antipsychotika kann zu Blutbildveränderungen, beispielsweise Neutropenie, Leukopenie, Leukozytose oder Thrombopenie, führen. Von Bedeutung ist vor allem eine Agranulozytose (Leukozyten < 500 cm³). Im Verlauf einer antipsychotischen Behandlung müssen deshalb regelmäßig, bei der Clozapin-Einstellung wöchentlich, Leukozyten-Kontrollen während der ersten 18 Behandlungswochen und danach monatlich durchgeführt werden. Durch regelmäßige Kontrolle des Differenzialblutbilds lässt sich eine solche Entwicklung jedoch meist frühzeitig erkennen, man geht von einer toxischen bzw. allergischen Genese bei der Entwicklung einer Agranulozytose unter Antipsychotika aus. Unter den Antipsychotika sind vor allem Clozapin, Olanzapin und Quetiapin in Betracht zu ziehen, unter den Antidepressiva Mianserin und trizyklische Antidepressiva, unter den Antiepileptika Carbamazepin, Phenytoin und Valproinsäure. Auch Analgetika, Antirheumatika, Antibiotika, Antimykotika, Immunsuppressiva, Thyreostatika und Zytostatika können eine Blutbildstörung auslösen. Clozapin sollte keinesfalls mit anderen Substanzen, die eine Blutbildstörung auslösen können, kombiniert werden. Bei Auftreten einer Agranulozytose sind Antipsychotika grundsätzlich sofort abzusetzen und eventuell intensivmedizinische Maßnahmen zu ergreifen.
Da es gelegentlich unter antipsychotischer Therapie zum Auftreten von Thrombosen kommen kann, sollten bettlägerige Patienten unter Antipsychotika heparinisiert werden.
Störungen des Leberstoffwechsels
Transaminasen-Erhöhung sind die häufigsten hepatischen Nebenwirkungen von Antipsychotika. Diese sind meist harmlos und erfordern nur bei längerfristigen Andauern oder starker Erhöhung ein Absetzen des Präparats. Abgesetzt werden muss auf jeden Fall beim seltenen Auftreten eines Verschluss-Ikterus.
Allergische Reaktionen
Generalisierte Arzneimittelexantheme und Photosensibilisierung mit erhöhtem Sonnenbrandrisiko sowie Pigmentablagerungen, vor allem unter Phenothiazinen, können auftreten. Seltene schwere allergische Reaktionen sind eine nichtthrombozytopenische Purpura, ein angioneurotisches Ödem sowie eine exfoliative Dermatitis und Stevens-Johnson-Syndrom.
Tabelle 9 zeigt einen Überblick über Differenzialindikationen für Antipsychotika abhängig vom jeweiligen Nebenwirkungsprofil.
Tab. 9. Differenzialindikation für Antipsychotika nach Nebenwirkungsprofil
|
Problematik |
Empfohlen |
Nicht empfohlen |
|
Extrapyramidal-motorische Störungen |
|
|
|
Tardive Dyskinesien |
|
|
|
Sedierung |
|
|
|
Gewichtszunahme |
|
|
|
Anticholinerge Nebenwirkungen |
|
|
|
Kardiovaskuläre Nebenwirkungen |
|
|
|
Kognitive Nebenwirkungen |
|
|
|
Hyperprolaktinämie |
|
|
|
Malignes neuroleptisches Syndrom (MNS) |
|
|
Interaktionen
Bei der Kombination von Antipsychotika mit anderen Arzneimitteln können sowohl pharmakodynamische als auch pharmakokinetische Interaktionen auftreten.
Pharmakodynamische Interaktionen
- Die Kombination von anticholinerg wirkenden Antipsychotika, beispielsweise Clozapin, Chlorprothixen, Levomepromazin mit Anticholinergika bzw. Arzneimitteln mit anticholinergem Wirkprofil führt zu verstärkten anticholinergen Wirkungen, beispielsweise Obstipation, Harnverhalt und bei älteren Menschen zur Verwirrtheit.
- Die Kombination von anticholinerg wirksamen Antipsychotika, beispielsweise Clozapin, Chlorprothixen, Levomepromazin, mit Cholinergika, beispielsweise Acetylcholinesterase-Hemmer, führt zu einer gegenseitigen Wirkungsabschwächung
- Die Kombination von Antipsychotika mit potenziellen myelotoxischen Eigenschaften (Clozapin) mit Arzneimitteln mit potenziellen myelotoxischen Eigenschaften führt zu einer Gefahr der Leukopenie und Agranulozytose.
- Die Kombination von Antipsychotika mit Arzneimitteln mit Dopamin-agonistischen Eigenschaften führt zu einer wechselseitigen Wirkungsabschwächung.
- Die Kombination von Antipsychotika mit Sympathomimetika kann zu hypertensiven Krisen führen.
- Kombinationen von Antipsychotika mit QTc-Zeit verlängernden Eigenschaften werden zur Gefahr von Arrhythmien und schwerwiegenden kardialen Komplikationen.
- Die Kombination von Antipsychotika mit alpha1-antagonistischer Wirkung kann die Wirkungen von Antihypertensiva verstärken (Prazosin) oder vermindern (Clonidin).
Pharmakokinetische Interaktionen
Antipsychotika sind in der Regel weder Inhibitor noch Induktor des CYP-Systems. Sie sind deshalb vorwiegend als Substrate von Interaktionen über das CYP-System betroffen (Tab. 10).
- Bei Kombination von Antipsychotika wie Clozapin, Olanzapin, aber auch Asenapin mit potenten Inhibitoren des CYP1A2 wie Fluvoxamin und Ciprofloxacin ist ein starker Anstieg des Plasmaspiegels der Antipsychotika mit vermehrten Nebenwirkungen bis hin zur Toxizität möglich.
- Bei Antipsychotika wie Clozapin und auch Olanzapin und Asenapin ist durch Induktoren des CYP1A2-Systems (und hier vor allem durch das Rauchen) eine Plasmaspiegel-Absenkung der Antipsychotika möglich.
- Bei Kombination von Risperidon mit potenten Inhibitoren des CYP2D6-Systems wie Fluoxetin, Paroxetin und Bupropion ist ein starker Anstieg des Plasmaspiegels des Antipsychotikums mit vermehrten Nebenwirkungen bis hin zur Toxizität möglich.
- Bei Kombination von Antipsychotika wie Quetiapin mit potenten Inhibitoren des CYP3A4-Systems wie Azol-Antimykotika, Makrolidantibiotika oder Protease-Inhibitoren ist ein starker Anstieg des Plasmaspiegels der Antipsychotika mit vermehrten Nebenwirkungen bis zur Toxizität möglich.
- Eine Kombination von Quetiapin mit potenten Induktoren des CYP3A4-Systems wie Carbamazepin führt zu einer deutlichen Plasmaspiegelabsenkung des Antipsychotikums.
- Die gleichzeitige Gabe von Olanzapin i. m. und einem parenteralen Benzodiazepin kann zu schweren Komplikationen führen.
- Antipsychotika und Alkohol sollten nicht kombiniert werden (Gefahr der wechselseitigen Wirkungsverstärkung bis hin zum Koma).
Tab. 10. Antipsychotika, die durch Cytochrom-P450-(CYP-)Enzyme metabolisiert werden
|
Enzym |
Substrat |
|
CYP1A2 |
Clozapin, Fluphenazin, Olanzapin, Perphenazin |
|
CYP2C9 |
Perazin |
|
CYP2C19 |
Clozapin |
|
CYP2D6 |
Aripiprazol, Fluphenazin, Haloperidol, Levomepromazin, Perphenazin, Risperidon, Sertindol, Zuclopentixol |
|
CYP3A4/5/7 |
z. B. Aripiprazol, Clozapin, Haloperidol, Perazin, Pimozid, Quetiapin, Risperidon, Sertindol, Ziprasidon |
Schwangerschaft und Stillzeit
Wenn möglich, sollte im ersten Trimenon auf die Gabe eines Antipsychotikums verzichtet werden. Bei entsprechender Behandlungsindikation können sowohl FGA als auch SGA in der Schwangerschaft eingesetzt werden. Eine teratogene Wirkung ließ sich bisher nicht eindeutig nachweisen. Bei Neueinstellung sind Haloperidol sowie die Antipsychotika der 2. Generation Quetiapin, Risperidon und Olanzapin Mittel der ersten Wahl. Auf Aripiprazol sowie niederpotente Antipsychotika der 1. Generation muss verzichtet werden. Grundsätzlich ist die niedrigstmögliche Dosis eines entsprechenden Antipsychotikums zu wählen und eine engmaschige gynäkologische, wie auch psychiatrische Behandlung dringend zu empfehlen.
Antipsychotika können in unterschiedlichem Umfang in die Muttermilch übergehen. Bei Behandlung mit Antipsychotika ist vom Stillen abzuraten.
Therapieresistenz
Therapieresistenz ist als eine unbefriedigende klinische Wirkung trotz antipsychotischer Therapie in adäquater Dosis über sechs Wochen mit mindestens zwei Antipsychotika definiert.
Etwa 30 % aller Schizophrenie-Patienten erfüllen die Kriterien einer Therapieresistenz. Primär ist eine Kontrolle der Therapieadhärenz mit therapeutischem Drug-Monitoring (Plasmaspiegel-Bestimmung) angezeigt (Tab. 11). Abhängig vom Befund kann dann eine Dosisanpassung oder die Umstellung auf ein anderes Antipsychotikum erfolgen. Kontrollierte Studien in den vergangenen Jahren belegten mehrfach die Überlegenheit von Clozapin in diesen Fällen, allerdings sind die Anwendungsbeschränkungen von Clozapin zu beachten. Clozapin zeigt eine etwa 30- bis 60%ige Erfolgsquote nach 6-wöchiger Therapie bei primären Nonrespondern auf andere Antipsychotika. Die bisher vorliegenden Daten geben keine Hinweise zur Verordnung eines spezifischen Antipsychotikums der 2. Generation außer Clozapin. Bei Wechsel von Clozapin auf ein anderes Antipsychotikum der 2. Generation sind Verschlechterungen des psychischen Befindens relativ häufig. Die Zahl antipsychotischer Kombinationstherapien nimmt in den letzten Jahren zu. Positive Ergebnisse von Kombinationen mit Antipsychotika mit unterschiedlichem Wirkprofil werden beschrieben, systematische Studien und Metaanalysen konnten bisher nur schwach positive Effekte vorwiegend für Kombinationen mit Clozapin belegen. Aktuell ist nicht eindeutig geklärt, ob die höheren Nebenwirkungs- und Interaktionsrisiken einer Polypharmazie den frühzeitigen Einsatz von Antipsychotika-Kombinationen rechtfertigen. Bei allen Kombinationstherapien mit Antipsychotika sind unerwünschte Arzneimittelwirkungen sowie Wechselwirkungen intensiv zu prüfen und regelmäßig zu kontrollieren. Die Kombination zweier Antipsychotika der 1. Generation erscheint wenig sinnvoll. In der Wirksamkeit am besten belegt ist die Kombination von Clozapin mit einem Antipsychotikum der 1. Generation wie Haloperidol oder Pimozid. Die Kombination von Clozapin mit Antipsychotika der 2. Generation, wie Sulpirid oder Amisulprid, scheint bezüglich der Positiv- wie auch der Negativsymptome Vorteile zu zeigen, wobei die Kombination von Clozapin mit Aripiprazol metabolische Parameter sowie Prolactinwerte verbessern kann.
Tab. 11. Therapeutisches Drug-Monitoring (TDM) verschiedener Antipsychotika
|
Antipsychotika |
Empfohlene Plasmakonzentration+ |
Empfehlung zur Anwendung von TDM++ |
|
Atypische Antipsychotika |
||
|
Amisulprid |
100–320 ng/ml |
1 |
|
Aripiprazol |
150–500 ng/ml |
2 |
|
Clozapin |
350–600 ng/ml |
1 |
|
Olanzapin |
20–80 ng/ml |
1 |
|
Paliperidon |
20–60 ng/ml |
2 |
|
Quetiapin |
100–500 ng/ml |
2 |
|
Risperidon |
20–60 ng/ml |
2 |
|
Ziprasidon |
50–200 ng/ml |
2 |
|
Konventionelle Antipsychotika |
||
|
Chlorpromazin |
30–300 ng/ml |
2 |
|
Fluphenazin |
1–10 ng/ml |
1 |
|
Flupentixol |
0,5–5 ng/ml |
2 |
|
Haloperidol |
1–10 ng/ml |
1 |
|
Perazin |
100–230 ng/ml |
1 |
|
Perphenazin |
0,6–2,4 ng/ml |
1 |
|
Zuclopenthixol |
4–50 ng/ml |
3 |
+ Empfohlene Plasmakonzentrationen bezeichnen Arzneimittelkonzentrationen in Serum oder Plasma von Patienten im Steady-State, bei denen mit höchster Wahrscheinlichkeit mit Therapieansprechen gerechnet werden kann.
++ Die Graduierung beziffert die Einschätzung des Nutzens von TDM für die Dosisoptimierung:
1: Sehr empfohlen: Verschiedene Studien belegen den Nutzen von TDM
2: Empfohlen: Mindestens eine prospektive Studie belegt, dass bei den empfohlenen Plasmakonzentrationen mit Therapieansprechen gerechnet werden kann, und es gibt Berichte über Intoxikationen bei zu hohen Plasmakonzentrationen
3: Nützlich: Retrospektive Untersuchungen und Einzelfallberichte machen wahrscheinlich, dass bei den empfohlenen Plasmakonzentrationen mit Therapieansprechen gerechnet werden kann
4: Potenziell nützlich: Pharmakokinetische Studien (im Steady-State) berichten Plasmakonzentrationen bei therapeutisch wirksamen Dosen
Die Kombination von Antipsychotika mit verschiedenen Antidepressiva (vor allem SSRI) kann bei Patienten mit chronischer Schizophrenie zu einer Verbesserung der Negativsymptome und der depressiven Symptomatik führen, die Kombination von Antipsychotika mit Benzodiazepinen ist bei ausgeprägter Agitiertheit, Anspannung, Ängstlichkeit und Aggressivität möglich. Eine mittelfristige oder längerfristige Kombination ist nicht zu empfehlen, zumal sich ein deutlich erhöhtes Gesamtmortalitätsrisiko bei der Kombination von Antipsychotika mit Benzodiazepinen in einer Studie feststellen ließ. Die Kombination von Clozapin und parenteralem Olanzapin mit einem Benzodiazepin ist kontraindiziert (erhöhtes Risiko für Atemdepressionen).
Umstellungen des Antipsychotikums
Ein Wechsel von einem Antipsychotikum auf ein anderes sollte in Betracht gezogen bei:
- Unzureichender therapeutischer Wirkung bzw. Therapieresistenz
- Störenden unerwünschten Arzneimittelwirkungen oder dem Auftreten von Kontraindikationen
- Vorhandenen oder möglichen störenden Interaktionen
- Unzureichender Adhärenz oder auf Wunsch des Patienten im Rahmen eines „shared decision making“
In Abhängigkeit vom primär eingesetzten Antipsychotikum sollte eine Umsetzung möglichst rational mit dem Ziel einer Antipsychotika-Monotherapie erfolgen (Tab. 12). Potenzielle antipsychotische Umstellungsstrategien sind in Abbildung 3 dargestellt. Im Allgemeinen kann als Prozedere der ersten Wahl die Variante 2, ein überlappendes Umsetzen (cross titration) zweier Antipsychotika durch sukzessives Auf- bzw. Abdosieren über zwei bis vier Wochen, dienen, insbesondere dann, wenn die primär oder auch die neu eingesetzte Substanz anticholinerge und sedierende Eigenschaften besitzt oder Interaktionen möglich sind.
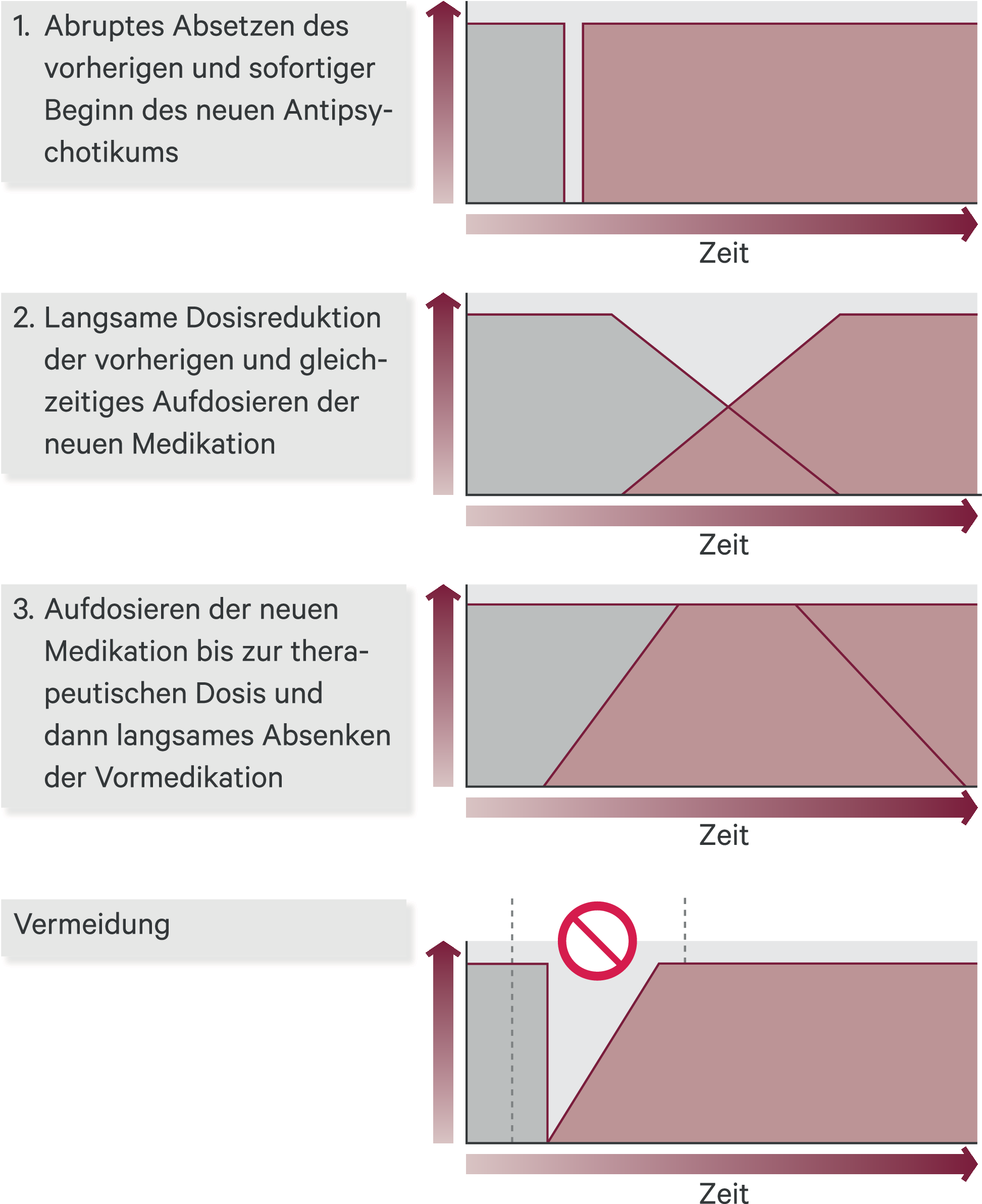
Abb. 3. Antipsychotische Umstellungsstrategien
Die Variante 3 in Abbildung 3 zeigt das Aufdosieren des neuen Antipsychotikums bis zur therapeutischen Dosis und dann erst das langsame Absenken des vorher verordneten Antipsychotikums. Dabei handelt es sich um die sicherste Variante des überlappenden Umsetzens in Bezug auf die Wirkung. Eine vorübergehende Zunahme unerwünschter Arzneimittelwirkungen lässt sich bei diesen Prozedere jedoch nicht völlig ausschließen. Für Aripiprazol ist diese Umstellungsstrategie immer Methode der ersten Wahl.
Der Wechsel von Clozapin auf andere Antipsychotika ist meist besonders komplex. Literaturangaben sprechen von 50 bis 80 % erfolglosen Umstellungsversuchen von Clozapin auf andere Antipsychotika der 2. Generation. Phänomene wie ein „Wirkverlust“ bei Umstellung einer Antipsychotika-Medikation lassen sich immer wieder beobachten. Dies kann mit einer massiven D2-Rezeptorblockade des primär verabreichten Antipsychotikums mit entsprechender Hochregulation der Rezeptorendichte in Zusammenhang gebracht werden: Nach dem Absetzen des Antipsychotikums kommt es unter dem neuen Antipsychotikum wegen noch nicht ausreichender Rezeptorbesetzung in der Übergangsphase zu Rezidiven.
Bei zu schnellem Absetzen bzw. zu langsamen Aufdosieren eines Antipsychotikums können auch Entzugs- und Absetzphänomene wie Rebound, EPS oder ein vegetatives Entzugssyndrom beobachtet werden. Generell muss ein Antipsychotikum umso langsamer ausgeschlichen werden, je höher die D2-Blockade, die anticholinerge Aktivität und die Dauer und Dosis dieses Antipsychotikums war.
Tab. 12. Anhaltspunkte für die Auswahl eines Antipsychotikums (Monotherapie) bei Therapieresistenz, Nebenwirkungen und pharmakokinetischen Interaktionen
|
Problem |
Prinzipiell besonders geeignet |
Prinzipiell ungeeignet |
|
Therapieresistenz |
Clozapin, danach Olanzapin, Risperidon, |
Bereits früher unwirksame oder ähnlich wirkende Antipsychotika, abhängig vom Behandlungsverlauf |
|
Persistierende Negativsymptomatik |
Amisulprid, Clozapin, Olanzapin, Quetiapin, wahrscheinlich auch andere AAP |
KAP in höheren Dosen |
|
Ausgeprägte EPS unter KAP, M. Parkinson |
AAP, v. a. Clozapin, Quetiapin |
Hochpotente KAP |
|
Spätdyskinesien unter KAP |
Clozapin, Quetiapin |
Hochpotente KAP |
|
Deutliches Übergewicht, Gewichtszunahme unter AP |
Aripiprazol, Cariprazin, Ziprasidon, ggf. Amisulprid |
Clozapin, Olanzapin |
|
Sedierung, Müdigkeit unter AP |
Amisulprid, Aripiprazol, Cariprazin, Ziprasidon, hochpotente KAP |
Clozapin, Quetiapin, niederpotente KAP |
|
Sexuelle Funktionsstörungen mit |
Aripiprazol, Cariprazin, Clozapin, Olanzapin, Quetiapin |
KAP, Amisulprid, Risperidon |
|
Krampfanfälle in der Vorgeschichte, bekannte Epilepsie |
Risiko für Erniedrigung der Krampfschwelle bei allen AP; daher suffiziente antikonvulsive Therapie bei bekannter Epilepsie, geringes Risiko für Risperidon, Butyrophenone, Melperon |
Phenothiazine, Clozapin, Olanzapin, Quetiapin |
|
Anticholinerge NW von AP oder anderen Pharmaka |
Amisulprid, Aripiprazol, Cariprazin, Melperon, Paliperidon, Pipamperon, Quetiapin, Risperidon, Ziprasidon |
Clozapin, Levomepromazin |
|
Pharmakokinetische Interaktionen (CYP450) mit anderen Pharmaka |
Amisulprid, u. U. Paliperidon |
AP mit extensivem hepatischem Stoffwechsel und deren Kombinationen |
AP: Antipsychotika; AAP: atypische Antipsychotika; EPS: extrapyramidal-motorische Störungen; KAP: konventionelle Antipsychotika; NW: Nebenwirkungen; PRL: Prolactin
Kontrolluntersuchungen
Vor Beginn einer antipsychotischen Therapie ist eine ausführliche körperliche und neurologische Untersuchung erforderlich. Die Messung von Blutdruck und Puls sind obligat. Laborchemisch sollten Blutbild, Leber-, Nieren- und Schilddrüsenwerte sowie Nüchtern-Blutzucker bestimmt werden. Bei häufig auftretender Komorbidität Schizophrenie – Drogenmissbrauch ist ein Drogenscreening sinnvoll. Bei Frauen im gebärfähigen Alter ist die Durchführung eines Schwangerschaftstests zu empfehlen. Ein EEG wird heute nur noch bei Risikopatienten (z. B. Anfallsleiden, hirnorganische Störungen, ältere Patienten, Clozapin-Patienten) empfohlen. Ein Basis-EKG scheint aufgrund einer möglichen QT-Zeit-Verlängerung unter antipsychotischer Therapie erforderlich. Antipsychotika der 2. Generation, vor allem Clozapin und Olanzapin, gehen mit einem erhöhten Risiko für ein metabolisches Syndrom einher. Dazu gehören Gewichtszunahme, Glucose- und Lipidstoffwechselstörungen und Hypertonie. Deshalb wird heute bei allen Patienten unter einer Behandlung mit Antipsychotika der 2. Generation ein Screening verschiedener Parameter empfohlen. Hierzu gehören:
- Gewicht, BMI und Bauchumfang (Männer < 102 cm, Frauen < 88 cm)
- Blutdruck und Puls
- Nüchtern-Blutzucker und Lipidwerte
Dabei sollte das Gewicht bei Baseline, nach 4, 8 und 12 Wochen und dann jährlich überprüft werden, die Messung des Bauchumfangs und des Blutdrucks sollte bei Baseline, nach 4 und 12 Wochen und dann jährlich, die Messung der Nüchtern-Glucose und des Nüchtern-Lipidprofils bei Baseline, nach 12 Wochen und dann jährlich erfolgen. Das Differenzialblutbild sollte bei Baseline, nach 4 und 12 Wochen und dann jährlich kontrolliert werden.
Für Clozapin gibt es hinsichtlich der Kontrolluntersuchung Sonderbestimmungen. Während bei den Leber- und Nierenwerten die Empfehlungen der anderen Antipsychotika angewandt werden sollten, gelten für Blutbild, EKG und EEG besondere Bestimmungen.
In den ersten 18 Wochen einer Clozapin-Therapie ist das Blutbild wöchentlich, danach mindestens alle zwei Wochen während der gesamten Behandlungszeit zu bestimmen. Auch nach Absetzen ist das Blutbild noch über vier Wochen zu überwachen. Die Anwendung von Clozapin ist mit einem erhöhten Risiko einer Myokarditis, insbesondere in den ersten acht Wochen der Behandlung verbunden. Diese verläuft in seltenen Fällen tödlich. Aus diesem Grund werden bei Clozapin in den ersten zwei Monaten 2-wöchentliche EKG-Kontrollen empfohlen. Im weiteren Verlauf sind 6-monatige EKG-Kontrollen ausreichend. Clozapin kann zu Veränderungen des EEG führen, es kann myoklonische Zuckungen oder generalisierte Krampfanfälle induzieren. Für Clozapin ist deshalb ein Baseline-EEG vor Therapiebeginn zu empfehlen, EEG-Kontrolle nach einem Monat, im weiteren Verlauf 6-monatige Kontrolle.
Interessenkonflikterklärung
MS: Vortrags- und Beraterhonorare von Aristo, Janssen-Cilag, Lundbeck, Neuraxpharm, Otsuka und Recordati
JB: Keine Interessenskonflikte
WEM: Vortrags- und Beraterhonorare von Lundbeck und Schwabe
1 Der Begriff Neuroleptika, der sich sehr stark auf das vegetative und extrapyramidalmotorische Nebenwirkungsprofil bezog, ist heute durch den sich auf die therapeutische Wirkung beziehenden Begriff Antipsychotika ersetzt.
Literatur
1. Benkert O, Hippius H, et al. Kompendium der Psychiatrischen Pharmakotherapie. 11. Auflage. Berlin, Heidelberg: Springer, 2017.
2. DGPPN. S3 Leitlinie Schizophrenie 2019. AWMF Register Nr. 038-009.
3. Falkai P, Schennach R, Lincoln T, Schaub A, et al. Schizophrenie, Schizophrenie ähnliche Störungen und nichtorganische Wahnerkrankungen. In: Möller HJ, Laux G, Kapfhammer HP (Hrsg.). Psychiatrie, Psychosomatik, Psychotherapie. 5. Auflage. Berlin, Heidelberg: Springer 2017:1583–674.
4. Lambert M, Karamatskos E, Naber D, Fleischhacker W. Pharmakotherapie der Schizophrenie. In: Voderholzer U, Hohagen F (Hrsg.). Therapie psychischer Erkrankungen – State of the Art. 14. Auflage. München: Elsevier, 2019:93–127.
5. Laux G, Dietmaier O. Praktische Psychopharmakotherapie. 7. Auflage. München: Elsevier, 2020.
6. Lieb K, Frauenknecht S, Brunnhuber S. Intensivkurs Psychiatrie und Psychotherapie, 8. Auflage. München: Elsevier, 2016.
7. Messer T, Tiltscher C, Schmauss M. Behandlung der Schizophrenie. In: Messer T, Schmauß M. (Hrsg.). Polypharmazie in der Behandlung psychischer Erkrankungen. 3. Auflage. Wien: Springer, 2016:41–83.
8. Müller WE, Eckert A. Psychopharmakotherapie: pharmakologische Grundlagen. In: Möller HJ, Laux G, Kampfhammer HP (Hrsg.). Psychiatrie, Psychosomatik, Psychotherapie. 5. Auflage. Band 2. Heidelberg: Springer, 2017:749–93.
9. Müller WE. Therapeutische Anwendung von Aripiprazol-Depot. Pharmakologische und pharmakokinetische Grundlagen. Psychopharmakotherapie 2014;21:97–105.
10. Müller WE. Vergleichende Betrachtung der pharmakologischen Eigenschaften von Dopamin-D2-Rezeptor-Partialagonisten. Psychopharmakotherapie 2019;26:192–204.
11. Unterecker S, Hefner G, Baumann P, et al, Therapeutisches Drug-Monitoring in der Neuropsychopharmakologie. Zusammenfassung der Konsensusleitlinien 2017 der TDM-Arbeitsgruppe der AGNP. Nervenarzt 2019;90:463–71.
Prof. Dr. med. Max Schmauß, Dr. med. Jessica Baumgärtner, Bezirkskrankenhaus Augsburg, Klinik für Psychiatrie, Psychotherapie und Psychosomatik der Universität Augsburg, Dr.-Mack-Straße 1, 86156 Augsburg, E-Mail: m.schmauss@bkh-augsburg.de
Prof. Dr. Walter E. Müller, Pharmakologisches Institut, Biozentrum, Universität Frankfurt
Psychopharmakotherapie 2019; 26(05)
