Roland Wörz, Bad Schönborn
Akuter Schmerz ist ein nützliches Warnsignal vor drohenden und sich entwickelnden Schäden in biologischer, somatischer, psychischer und sozialer Hinsicht, ein Korrektiv menschlicher Reifung. Bei starker Ausprägung und anhaltender Dauer kann Schmerz aber eine schädigende Kraft sein. In Erklärung und Verständnis akuter Schmerzen hat sich das ätiopathogenetische Modell der Nozizeption bewährt. Für die Behandlung akuter und chronischer Schmerzzustände gibt es eine Vielzahl von Methoden. Hierzu gehört der Einsatz von Antidepressiva. Sie haben bei akutem Schmerz keinen bedeutenden Anwendungsbereich gewonnen – zumal mögliche Effekte nicht sofort eintreten –, hingegen aber im Rahmen chronischer Schmerzsyndrome.
Bei Schmerz können relativ einfache Formen von sehr komplexen differenziert werden (Tab. 1).
Tab. 1. Relativ einfache vs. komplexe Schmerzzustände
|
Relativ einfach |
Komplex |
|
Monokausal |
Multifaktoriell |
|
Eingleisig |
Multidimensional |
|
Reiz-Reaktion |
Interaktionen |
|
Linear |
Nonlinear |
|
Kausalkette |
Netzwerk |
|
Deterministisch |
Nondeterministisch |
Neben monokausal entstandenen chronischen Schmerzen, etwa durch Trauma, Entzündung oder Operation ist in unserem Kulturraum die Mehrzahl der chronischen Schmerzsyndrome bzw. -erkrankungen multifaktoriell bedingt [68]. Die Entwicklung solcher Syndrome kann nicht eingleisig über das Reiz-Reaktions-Schema erklärt werden, sondern nur über die Komplexitätstheorie mit non-linearen und non-deterministischen Zusammenhängen. Ein linearer Zusammenhang zwischen Schädigung und Schmerz besteht etwa bei Hitzeeinwirkung im engen experimentellen Bereich, aber weder bei Migräne noch bei Fibromyalgie-Syndromen und schon gar nicht bei Schmerzerlebnissen im Rahmen einer depressiven Störung.
Chronische Schmerzen kommen häufig vor. Nach einer repräsentativen Erhebung in 15 europäischen Ländern und in Israel ergab sich eine Prävalenz von 12 bis 30 % erheblicher Schmerzen im Erwachsenenalter, in Deutschland bei 17 % [5]. Dabei handelte es sich in 54 % um intermittierende und in 46 % um anhaltende Schmerzen. Intermittierende und besonders chronische Schmerzzustände besitzen aus verschiedenen Gründen eine besondere psychiatrische Relevanz: In 15 Zentren der Primärversorgung, in Deutschland erhoben in Berlin und Mainz, waren durchschnittlich 22 % (5,5–33 %) aller 25 961 Patienten von anhaltenden Schmerzen betroffen. Die chronischen Schmerzpatienten waren dabei 4-fach häufiger von depressiven Störungen und oft von Beeinträchtigungen der täglichen Aktivitäten betroffen als die Patienten ohne Dauerschmerz [21]. Eine Studie, in der 3197 Patienten der ärztlichen Primärversorgung in 14 Ländern auf anhaltenden Schmerz, Angst, Depression und berufliche Beeinträchtigungen untersucht wurden, erbrachte enge Zusammenhänge zwischen psychischen Störungen und Schmerz [22]. Erhebungen in 17 Ländern von 85 088 Erwachsenen ergaben hohe Korrelationen zwischen chronischem Schmerz, Angst- und affektiven Störungen [23].
Schmerzsyndrome als psychiatrische Probleme
Schmerzerlebnisse treten bei psychischen Störungen etwa gleich oft wie bei somatischen Erkrankungen auf. Depressive Störungen gehen in etwa 60 % der Fälle mit Schmerzphänomenen einher [69]. Schmerzerlebnisse können als Bewusstseinsinhalt sowohl bei somatischen Schädigungen als auch bei verschiedenen psychischen Störungen gemeinsam auftreten und integrativ, als Symptom verschiedener Krankheitsentitäten erlebt werden.
Auch depressive Störungen selbst sind häufig: In einer repräsentativen Stichprobe der deutschen Bevölkerung im Alter von 18 bis 79 Jahren fand sich eine depressive Symptomatik bei 10 % der Frauen und bei 6 % der Männer, im Durchschnitt bei rund 8 % [6]. Die 12-Monate-Prävalenz wurde bei Erwachsenen im Alter von 18 bis 65 Jahren mit 14,2 % der Frauen und 7,6 % der Männer, insgesamt mit 10,9 % bestimmt [67]. Gegenwärtig wird davon ausgegangen, dass die Lebenszeitprävalenz von Depressionen bei Frauen 25 % und bei Männern 12 % beträgt [29].
Richtungsweisende Frühsymptome (Schmerzen, Schlaf- und Appetitstörung, Konzentrationsminderung) sind für die rechtzeitige Diagnose depressiver Störungen relevant [10]. Bei Ersterkrankungen von affektiven Störungen sind zahlreiche somatische Erkrankungen als Ursachen in Erwägung zu ziehen, so Infektions-, kardiovaskuläre und pulmonale Erkrankungen, Neoplasmen, Endokrinopathien, metabolische Störungen, gastrointestinale Erkrankungen, Kollagenosen und Hirnerkrankungen [18]. Ebenso wie bei chronischen Schmerzzuständen wirken in der Entstehung von Depressionen biologische, psychische und soziale Faktoren oft zusammen [67].
Die Ursachen somatogener Depressionen sind vielfältig und liegen auf zahlreichen medizinischen Gebieten – Neurologie, Endokrinologie, Kardiologie, Gastroenterologie, Nephrologie, Stoffwechsel- und Infektionskrankheiten, Gynäkologie und Onkologie [18, 43]. Sie können durch eine große Zahl von Pharmaka ausgelöst werden [18]. Zusätzlich ist zu beachten, dass neben der meist psychischen Kernsymptomatik in Einzelfällen zahlreiche vegetative Beschwerden vorliegen können [51] bzw. dass Schmerz in manchen Fällen dominiert [69].
Bei der doppelten, hohen Komplexität der Depressionen und der chronischen Schmerzsyndrome bezüglich Ätiopathogenese, Beschwerden und Symptomatik ist es angemessen, bei der Therapieplanung nicht wie vielfach üblich von vermeintlicher Nozizeption bzw. dem Ergebnis bildgebender Verfahren, den Röntgen-, Computertomographie-, Magnetresonanztomographie-Befunden auszugehen, sondern von Schmerzerleben und -verhalten, letztlich dem Bewusstsein der Betroffenen [70].
Depressionen sind oft mit Angst assoziiert [32, 60, 62]. Bei Schmerzkrankheiten findet man einen Überlappungsbereich mit depressiven und mit Angststörungen (Abb. 1). Dabei können Schmerzerlebnisse bei Depressionen und verschiedenen Angststörungen in das integrative Bewusstsein eingehen. Für generalisierte Angststörungen ist Komorbidität typisch [28].
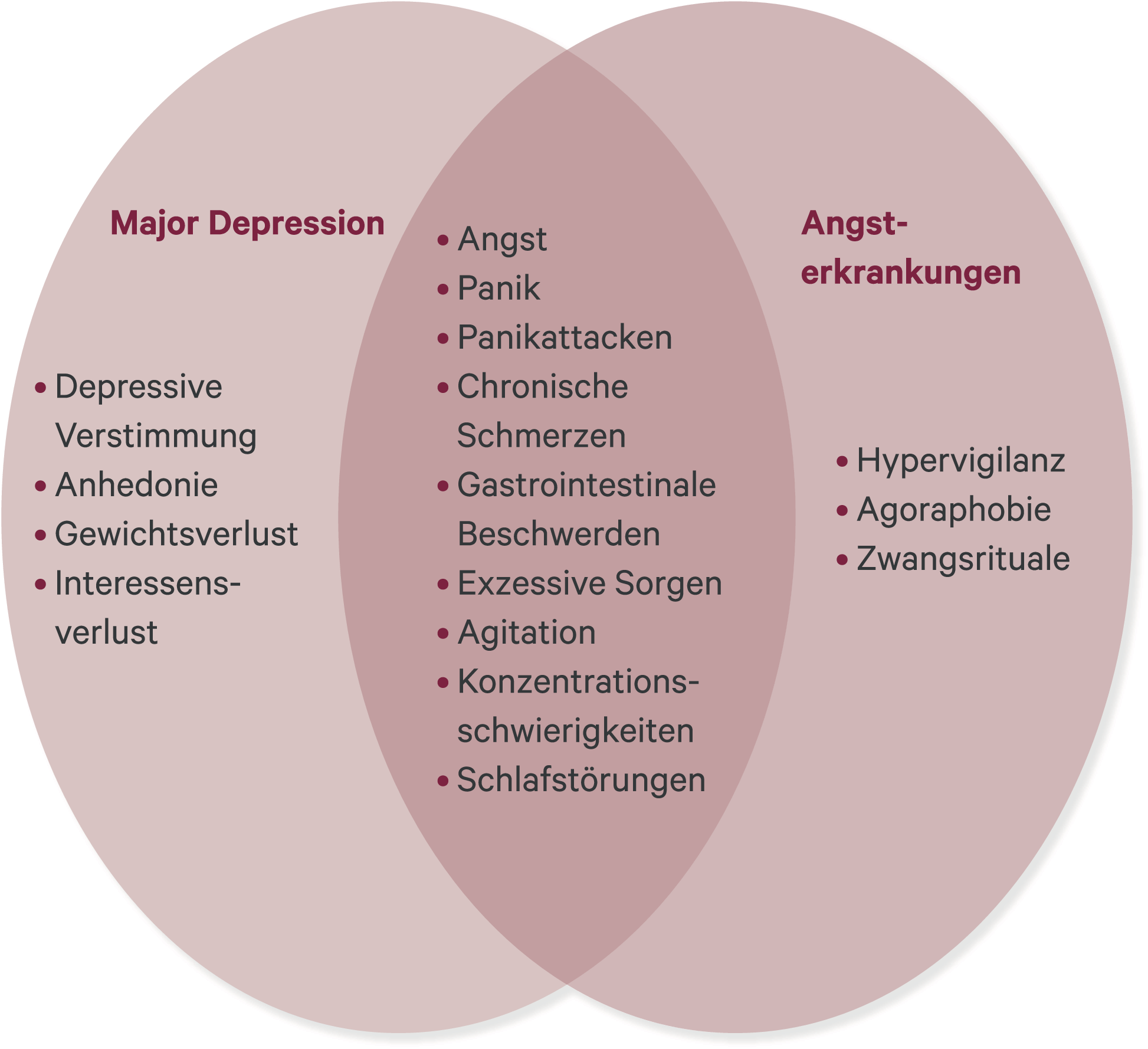
Abb. 1. Gemeinsame Symptome von Major Depression und Angsterkrankungen (mod. nach [31, 52])
Bei der Basisdiagnostik von Patienten mit Ängsten ist eine umfassende körperliche Untersuchung Pflicht. Sie sollte im Screening Störungen des Zuckerstoffwechsels und der Schilddrüsenfunktion, Herz-Kreislauf-Erkrankungen, Lungenerkrankungen, Abhängigkeitserkrankungen, Tumoren und neurologische Erkrankungen beinhalten [9]. In der Regel sind einzuschließen: Blutbild, Elektrolyte, Blutzucker, Schilddrüsenwerte (TSH-Basalwert, freies T3, freies T4), Leberwerte (Gamma-GT, Transaminasen), EKG und gegebenenfalls Langzeit-EKG. Antidepressiva besitzen zum Teil auch anxiolytische Eigenschaften [9, 31, 43, 51].
In Anbetracht der vorgegebenen Komplexität ist es also angezeigt, bei chronischen Schmerzpatienten gründliche Untersuchungen durchzuführen, die nicht nur Schmerzerleiden und Depressivität, sondern auch Angststörungen erfassen. Dabei sind generalisierte Angst-, Panik- und posttraumatische Belastungsstörungen zu differenzieren. Erforderlich ist die gründliche Erhebung von Biographie, Persönlichkeit und gegebenenfalls Traumatisierungen somatischer, psychischer, sozialer und sexueller Art [11]. Bei einer Mehrzahl komplexer chronischer Schmerzsyndrome wie Fibromyalgie, Becken- oder Rückenschmerzen spielen erlebnisreaktive Traumatisierungen in der Kindheit eine wichtige dispositionelle Rolle, auch Erkrankungen mit Hospitalisierung.
Solche Störungen und Krankheiten können als Entitäten parallel voneinander auftreten, doch gleichzeitig interagieren und durch vielfältige Chronifizierungsprozesse verstärkt werden. Emotional bestimmte chronische Schmerzsyndrome in phänomenologischer Ähnlichkeit mit Angst und Depression und in häufiger Vermischung mit ihnen haben Swanson (1984) dazu angeregt, chronischen Schmerz als dritte pathologische Emotion zu bezeichnen [59]. Dieser Vorschlag erscheint interessant, hat sich jedoch in Anbetracht der enormen Vielzahl durchaus verschiedener chronischer Schmerzzustände nicht durchgesetzt.
Der Problematik angemessen sind nicht nur Schmerzanamnese und Schmerzanalyse, sondern auch die Auswirkungen und Verhaltensweisen vor dem sozialen Hintergrund zu erheben.
Schmerzzustände sind in heftiger Ausprägung und vor allem bei anhaltender Dauer keine Epiphänomene. Die Coping-Forschung auf dem Gebiet der Schmerzmedizin seit den 80er-Jahren hat ergeben, dass maladaptive Coping-„Mechanismen“ wie Katastrophisieren, Fear-Avoidance, prolongierte Schonung einerseits und rigides Durchhalten andererseits für das aktuelle Zustandsbild und die Beeinträchtigungen im somatischen, psychischen und sozialen Bereich oft wichtiger sind als die primäre Verursachung. Die Reaktionen und Verhaltensweisen auf Schmerzerleben und Beeinträchtigungen erhöhen die Komplexität und können eine eigenständige Bedeutung annehmen [71].
Warum nicht einfach Analgetika langfristig verordnen?
Schmerz wurde von der International Association for the Study of Pain (IASP) definiert: “Pain is an unpleasant sensory and emotional experience associated with actual or potential tissue damage, or described in terms of such damage” [26] („Schmerz ist ein unangenehmes Sinnes- und Gefühlserlebnis, das mit aktueller oder potenzieller Gewebeschädigung verknüpft ist oder mit Begriffen einer solchen Schädigung beschrieben wird“). Die Definition chronischen Schmerzes als „any pain that persists beyond the anticipated time of healing“ [1], also Schmerz, welcher über die antizipierte Heilungszeit andauert, erscheint bedenklich. Sie legt die Assoziation mit körperlicher Schädigung und eine entsprechende Behandlung mit somatischen Therapieformen, mit Analgetika und bei starker Ausprägung mit Opioidanalgetika nahe. Das Modell der Nozizeption mit der Differenzierung von nozizeptivem und neuropathischem Schmerz, zu dem in den letzten Jahren auch die Grundform des noziplastischen Schmerzes gerechnet wird [33], ist bei vielen chronischen Schmerzpatienten unangemessen.
Das Beispiel der Marketing-bezogenen Popularisierung und Verharmlosung von Risiken der Opioidanalgetika mit dem aktuellen Gesundheitsdesaster in den USA ist ein Warnbeispiel. Christoph Maier (2018) kommentiert hierzu aktuell: „Die Zahl der Opioid-Süchtigen ist dramatisch gestiegen, einhergehend mit einer erschreckenden Zahl von Todesfällen“. Er befürchtet negative Auswirkungen für Opioid-bedürftige Patienten [38].
Drogenszene und Schmerzmedizin sind in den USA nach vielen Mitteilungen nicht mehr getrennt. Dabei führen ärztlich verordnete Opioidanalgetika, speziell retardiertes Oxycodon und Fentanyl, schon häufiger zu Atemstillstand als das „traditionelle“ Heroin der Drogenabhängigen.
Anstelle der allgemeinen Verordnung von Opioiden ist demnach auch nach anderen therapeutischen Optionen in der Schmerzmedizin zu suchen. Dabei wurde die Opioid-Unterdosierung in der Schmerzbehandlung bis in die 80er-Jahre von der WHO und zahlreichen internationalen und nationalen Schmerzinstitutionen beklagt. Nicht zuletzt aufgrund der Opioid-Katastrophe in den USA wird heute aber vor dem unreflektierten Einsatz verfügbarer Opioidanalgetika gewarnt. Auch vor der langfristigen Verordnung nichtsteroidaler Antirheumatika (NSAR) ist wegen der häufigen und gefährlichen Schädigungsfolgen bei langer Anwendung möglichst Abstand zu nehmen. Durch ihre Schädigungen an den gastrointestinalen, renalen und kardiovaskulären Organsystemen besitzen sie allerdings ein anderes Toxizitätsprofil.
Antidepressiva in der Schmerzbehandlung
Historisches
Schon 1960, also wenige Jahre nachdem Ronald Kuhn (1957) beobachtet hatte, dass eine als Neuroleptikum geprüfte Substanz (Imipramin) zwar keine antipsychotischen, jedoch antidepressive Wirkeigenschaften besitzt, erschienen zahlreiche Berichte über analgetische Effekte von Imipramin bei Karzinomschmerz, Neuralgien und Myalgien [16, 30, 39, 40, 41, 45, 47, 48]. Auch Clomipramin erwies sich bei verschiedenen chronischen Schmerzzuständen als wirksam. Weiterhin ergaben zahlreiche Untersuchungen analgetische Wirkungen von Amitriptylin, speziell bei Spannungskopfschmerzen und Gesichtsschmerzen. Ähnliche Ergebnisse erbrachten Untersuchungen von Doxepin und von Trimipramin, von Desipramin und Nortriptylin [30, 47]. Die statistische Wirksamkeit der trizyklischen Antidepressiva (TCA) ist also bei einer Vielzahl von Schmerzsyndromen definitiv erwiesen, doch wurde die 70%-Grenze bezüglich einer Schmerzlinderung von 50 % (als Response) in größeren Studienkollektiven nicht überschritten (Abb. 2).
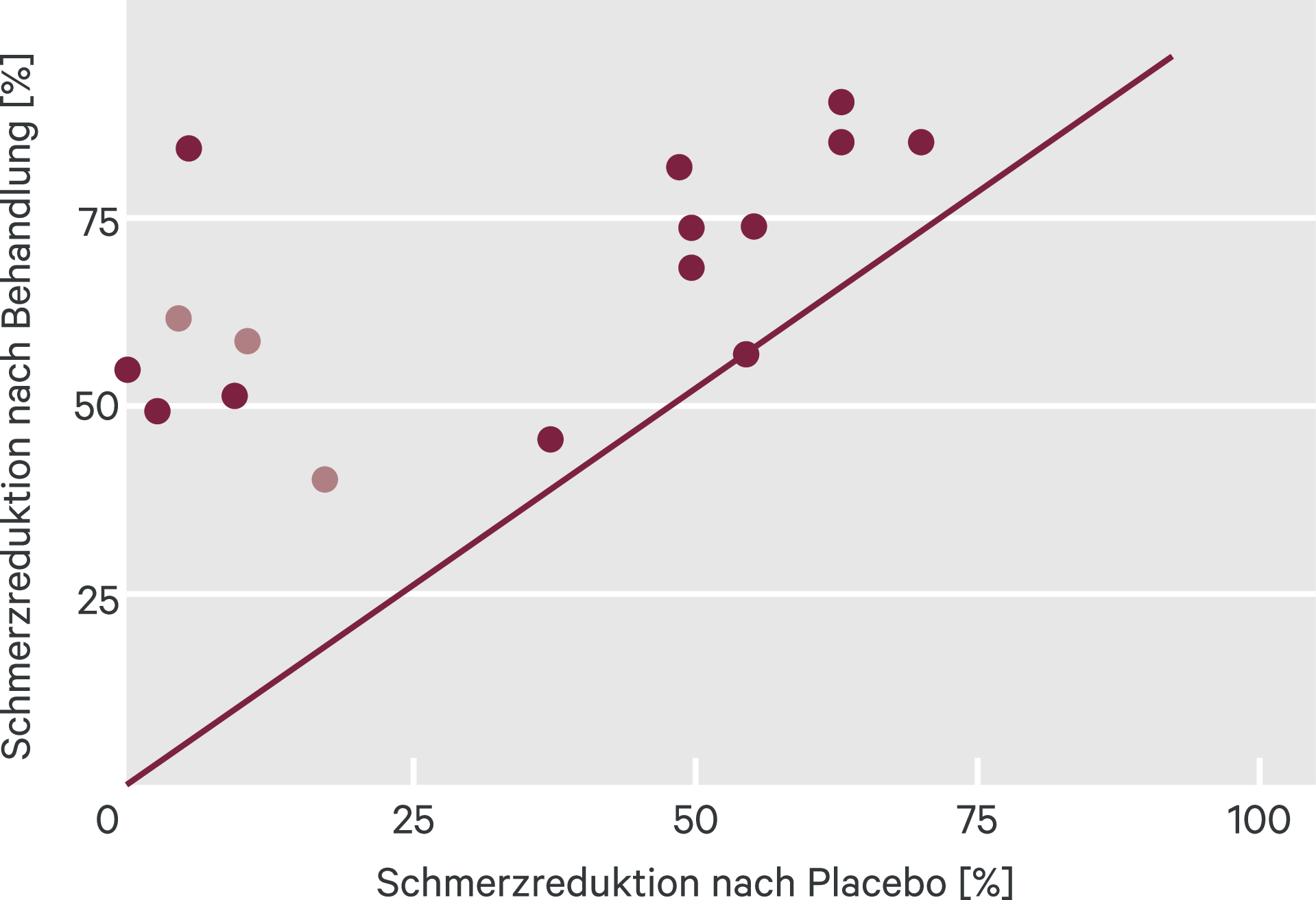
Abb. 2. Prozentsatz der Patienten mit 50%iger Schmerzverringerung durch Antidepressiva vs. Placebo (nach [42]). Ergebnisse von 13 Studien mit diabetischer Neuropathie und von drei mit postherpetischer Neuralgie; Abszisse: Prozentsatz der Schmerzlinderung unter Placebo; Ordinate: Prozentsatz der Schmerzlinderung durch Antidepressiva
Mit der Einführung tetrazyklischer Antidepressiva (Maprotilin, Mianserin) ließen sich bei chronischem Schmerz keine besseren Linderungen erzielen. Auch sie sind mit anticholinergen Effekten und kardialen Risiken verbunden. Die selektiven Serotonin-Wiederaufnahmehemmer Citalopram, Escitalopram, Fluoxetin, Fluvoxamin, Paroxetin und Sertralin führten im Vergleich zu den TCA eher zu weniger Schmerzverringerung [38], jedoch zu einer besseren Verträglichkeit, zu anderen Nebenwirkungen und zu mehr Sicherheit bei Überdosierung [35].
Die Monoaminoxidase-(MAO-)Hemmer Moclobemid und Tranylcypromin haben nach ihrer Einführung bei Schmerzpatienten einen gewissen Anwendungsbereich gewonnen und nach den jüngsten Erhebungen von Fritze und Mitarbeitern (2017) behalten [17]. In ihrer Erhebung dokumentieren sie die Anwendung der klassischen trizyklischen und tetrazyklischen Antidepressiva, der selektiven Serotonin-Wiederaufnahmehemmer (SSRI), von Bupropion, Reboxetin und Agomelatin bei den Diagnosen „chronischer, unbeeinflussbarer Schmerz, sonstiger chronischer Schmerz, Migräne, Spannungskopfschmerz“.
Bezüglich der analgetischen Wirkung wurden die serotonerg und noradrenerg ansetzenden Substanzen Duloxetin, Milnacipran und Venlafaxin eingehend geprüft. Bei den neueren Substanzen ist das schmerzmedizinisch gut untersuchte Duloxetin Spitzenreiter in den Verordnungen, während beispielsweise das bei dieser Indikation unzureichend geprüfte und dabei nicht beworbene Agomelatin etwa so häufig verordnet wird wie Fluoxetin, Sertralin und Venlafaxin [17]. Diese Feststellungen erinnern, dass aus den wissenschaftlich erfassten Gegebenheiten dessen was ist, nicht hervorgeht, was ethisch bzw. medizinethisch sein soll („naturalistischer Fehlschluss“ der Philosophen).
Rationale Begründung der Schmerztherapie mit Antidepressiva
Dieser Beitrag zielt darauf, das Leiden und die Beeinträchtigungen Betroffener zu lindern und unerwünschte Ereignisse bis hin zu Suiziden zu vermeiden. Methodologisch kann bemängelt werden, dass keine umfassende Übersicht von Metaanalysen doppelblinder, randomisierter, Placebo-kontrollierter Studien über Wirksamkeit, Verträglichkeit und Sicherheit vorgelegt wird. In diesem Zusammenhang ist aber der Kritik an der „Massenproduktion redundanter und irreführender, methodologisch fehlerhafter Reviews und Metaanalysen“ aufgrund von randomisierten, kontrollierten Untersuchungen von Antidepressiva in der Behandlung von depressiven Episoden zuzustimmen [27]. Systematische Reviews und Metaanalysen können bei dem Einfluss, den sie haben, gefährlich sein [19]. Sie sollten von systematischen Fehlern und Täuschungen befreit werden, ihr diktatorisches Verhalten aufgeben und der Innovation, der Produktion wissenschaftlicher Evidenz dienen [19, 27]. Empirische Studien erbringen immer nur vorläufig gültige Ergebnisse. Diese im Nachhinein (a posteriori) erfassten Ergebnisse sind natürlich keinesfalls wertlos. Sie bedürfen aber bei der Umsetzung in die Patientenanwendung kritischer Überlegungen.
Auch wenn die Beschäftigung mit chronischen Schmerzpatienten in der psychiatrischen Wissenschaft verhältnismäßig wenig Beachtung gefunden hat, so bleiben doch humanitäre, allgemein- und medizinethische Bedeutung bestehen. Fehlentwicklungen in der Schmerzmedizin erfordern ein Umdenken. Gegenwärtig mehren sich Stimmen, welche die personalisierte, individuell ausgerichtete Medizin anstelle des Ausgangs von der Nozizeption fordern. Antidepressiva rücken wegen der vielen Todesfälle durch Überdosierung von Opioidanalgetika wieder in den Vordergrund des Interesses. Eine Ursache für das gegenwärtige Opioiddesaster, vor allem in den USA, ist die enge Konzeption des Schmerzes in Verbindung zur Nozizeption: Sie legt die Behandlung mit Analgetika bzw. bei starkem Schmerz mit Opioidanalgetika nahe. Das nozizeptive System besteht aber nicht nur aus der aszendierenden Nozizeption mit den exitatorischen Transmittern Glutamat und Substanz P. Es steht unter der Kontrolle der serotonergen und noradrenergen Hemmsysteme. Mit Opioidanalgetika wird das erregende System gehemmt, während die deszendierenden Systeme eher von Antidepressiva beeinflusst werden können.
Nachdem bei Patienten mit Neuralgien und Karzinomschmerz mitgeteilt wurde, dass durch Analgetika nicht nur depressive Störungen, sondern auch Schmerzerleiden besser wurden, erhebt sich die Frage, ob die Wirkung über den Ansatz am nozizeptiven System erfolgt, über Depressionslösung oder Sedierung. Dabei ist der Placebo-Effekt mit seinen intrinsischen Mechanismen jeweils in Rechnung zu stellen und therapeutisch zu nutzen. Eine Metaanalyse von Onghena und van Houdenhove (1992) mit Auswertung von 39 Placebo-kontrollierten Studien ergab ein mittleres Wirkungsausmaß (Effect size: ES) von 0,64. Unter Antidepressiva hatten Schmerzpatienten in 74 % der Fälle weniger Schmerzen als unter Placebo. Dabei wurden vor allem Studien mit Amitriptylin, Imipramin und Doxepin einbezogen.
Bei den (unspezifisch wirkenden) trizyklischen Antidepressiva ist der Angriff am nozizeptiven System nachgewiesen worden, so bei Imipramin, Amitriptylin, Clomipramin und Trimipramin. Für die Anwendung in der Praxis ist wichtig, dass die TCA die Opioidanalgesie verstärken können [2]. Speziell serotonerge Neurone beeinflussen Opioidpeptid-haltige Neurone im Hinterhorn. Auch Noradrenalin-Aufnahmehemmer verstärken die Morphinanalgesie. Das pharmakologische Wissen um die deszendierende serotonerge und noradrenerge Hemmung bei chronischem Schmerz stimmt mit rationalen Überlegungen überein, dass dual ansetzende Substanzen besser wirken sollten als eingleisig serotonerge oder noradrenerge Antidepressiva. Nach dem Ergebnis kontrollierter Studien ist das auch der Fall bei Duloxetin [4, 20], Milnacipran [12, 29, 56] und Venlafaxin [25, 49, 53]. Bei all diesen Substanzen ist die serotonerge Aktivität deutlich ausgeprägter als die noradrenerge, welche bei Duloxetin 10 %, bei Milnacipran 38 % und bei Venlafaxin nur 3 % beträgt [29]. Bei Schmerzsyndromen erwiesen sich vor allem Duloxetin [54, 63, 64] und Milnacipran als wirksam [12, 57, 61].
Die Anwendung von SSRI-Antidepressiva ist im Hinblick auf Schmerzlinderung und Besserung damit verbundener funktioneller Beeinträchtigungen fragwürdig. Allerdings können sie Schmerzerlebnisse im Rahmen von Depressionen verringern. Darüber hinaus sind sie auch bei verschiedenen Angstkrankheiten, bei Panikstörungen, generalisierter Angst, Agoraphobie und sozialen Phobien statistisch wirksam. So bieten sich bei verschiedenen Konstellationen in ihrer situativen Abhängigkeit, bei Beachtung potenziell erwünschter und unerwünschter Effekte verschiedene Substanzen an. Dabei kommen verschiedene „Mechanismen“ in Betracht:
- Analgetische Wirkung
- Antidepressive Wirkung
- Anxiolytische Wirkung
- Schlafregulation
- Placebo-Effekt
Differenzierte Schmerztherapie mit Antidepressiva
Wenn sich bei einer Schmerzanalyse ergibt, dass nozizeptive Aspekte im Hintergrund sind oder überhaupt nicht vorliegen, hingegen Angst und Depression im Vordergrund stehen, so ergibt sich in differenzialtherapeutischer, pharmakologischer Hinsicht die Indikation für die primäre Anwendung antidepressiver und anxiolytischer Substanzen. Trizyklische Antidepressiva sind bei einer großen Zahl rezidivierender und bei chronischen Schmerzzuständen aufgrund ihres Angriffs am nozizeptiven System wirksam, speziell Amitriptylin, Clomipramin, Imipramin, Doxepin und Trimipramin. Das gilt sowohl für Nozizeptor- als auch für Nervenschmerzen und für komplexe Syndrome wie Fibromyalgien [55]. Diese Substanzen sind aber kardial nicht unbedenklich und führen oft zu Gewichtszunahme und teilweise zu Tagesmüdigkeit.
Wegen der besonderen Bedeutung kardialer Todesfälle ist auf kardiovaskuläre Wirkungen von Antidepressiva besonders zu achten, insbesondere auch auf Risikofaktoren und die Kombination mit mehreren potenziell kardiotoxischen Arzneimitteln [66]. Die SSRI haben diese unerwünschten Wirkungen nicht. Sie erwiesen sich jedoch analgetisch als weniger effektiv und spielen bei nozizeptiven bzw. neuropathischen oder noziplastischen Schmerzen eine geringere Rolle. Zudem erhöhen sie die Gefahr speziell gastrointestinaler Blutungen, über die Reduktion des thrombozytären Serotonins und verminderte Plättchenaggregation und -aktivierung [58]. Das Risiko einer gastrointestinalen Blutung steigt unter Komedikation mit NSAR und Thrombozytenaggregationshemmern, sodass vor Beginn einer Therapie mit SSRI nach vorangegangenen Blutungsereignissen, Störungen der Blutgerinnung und Thrombozytenfunktion sowie einer bestehenden Medikation gefragt werden sollte [58].
Evidenzbasierte Untersuchungen, verstanden als solche mit Ausgang von randomisierten, doppelblinden, Placebo-kontrollierten Studien mit Bestimmung der Numbers needed to treat (NNT) und Numbers needed to harm (NNH) (Kasten) zielen auf die Bestimmung von Wirksamkeit und Sicherheit von Medikamenten. Im Rahmen dieser Thematik wurden vor allem sogenannte neuropathische Schmerzen besonders untersucht [3, 41, 50]. Darunter sind die Folgen von Störungen oder Erkrankungen somatogener/sensorischer Strukturen im peripheren oder im zentralen Nervensystem zu verstehen. Bei ihnen sind Sensibilitätsstörungen charakteristisch – nächtliche Hyperästhesie oder Hypoästhesie, Hyperalgesie oder Hypoalgesie und Allodynie, das heißt Schmerzempfindung auf Reize, die normalerweise nicht zu Schmerz führen.
NNT
Cook und Sackett, 1995: “Number needed to treat (NNT) is defined as the number of patients needed to treat with a drug to obtain one patient with a defined pain relief, in the present context 50 % pain relief.” [8]
McQuay und Mitarbeiter (1996) führten eine NNT-Kalkulation unter Einschluss der Placeboresponder-Korrektur ein [41]: NNT = 1/ [(goal achievedACTIVE/ totalACTIVE) – (goal achievedPLACEBO/totalPLACEBO)]
Eine systematische Cochrane-Analyse von Saarto et al. (2005) ergab für Amitriptylin eine NNT von 2 (95%-Konfidenzintervall [KI] 1,7–2,5) und eine NNH für schwerwiegende Nebenwirkungen, die zum Studienabbruch führten, von 16 (95%-KI 10–45) sowie eine NNH für leichte Nebenwirkungen von 4,6 (95%-KI 3–6,7). Eine Zusammenfassung von Finnerup et al. (2005) erbrachte bei trizyklischen Antidepressiva über die verschiedenen Konditionen (schmerzhafte diabetische Polyneuropathie, postherpetische, zentrale Schmerzen nach Schlaganfall u. a.) eine NNT von 2 bis 3. Bei schmerzhaften Polyneuropathien ergab sich eine Tendenz der besseren Wirkung von balancierten Serotonin- und Noradrenalin-Wiederaufnahmehemmern (NNT 2,1) gegenüber vorwiegend noradrenergen Substanzen (NNT 2,5 [13]) und insgesamt deutlich bessere Wirkungen als bei selektiven Serotonin-Wiederaufnahmehemmern mit einer NNT zwischen 6 und 7.
Placebo-kontrollierte Studien wurden vor allem bei schmerzhaften diabetischen Polyneuropathien und postherpetischen Syndromen durchgeführt. Aber auch Phantomschmerz, HIV-Neuropathie und zentrale Schmerzsyndrome nach Schlaganfall wurden einbezogen. Besonders umfangreich wurde Duloxetin bei verschiedenen neuropathischen Syndromen und auch bei Fibromyalgie geprüft [54, 63, 64]. Eine große Metaanalyse mit Einschluss von 229 kontrollierten Studien ergab [14], dass sich in Studien, die in Peer-Review-Zeitschriften veröffentlicht wurden, größere Effekte eingestellt hatten als in nichtveröffentlichten Untersuchungen. Serotonin-Noradrenalin-Wiederaufnahmehemmer ergaben in Kombination eine NNT von 6,4 (95%-KI 5,2–8,4). In 9 von 14 Studien wurde dabei Duloxetin geprüft. In Cross-over-Studien zeigten sich bessere Effekte als in Placebo-Verum-Untersuchungen im Parallelvergleich. Zudem ist bei diesen Ergebnissen kritisch anzumerken, dass in methodologisch hochwertigen Studien so viele Ausschlusskriterien gelten, dass sie der klinischen Realität nicht entsprechen.
In der Betreuung etwa von Schmerzpatienten mit diabetischen Neuropathien lassen sich aber mit den genannten Antidepressiva weitere therapeutische Ziele anstreben, nicht nur
- Linderung von Schmerz und Dysästhesien, sondern auch
- Schlafverbesserung
- Stimmungsaufhellung
- Verbesserung der Funktionalität
- Teilnahme an sozialen Aktivitäten [24]
In diesem Zusammenhang ist darauf hinzuweisen, dass eine Reihe weiterer Medikamente bei peripheren neuropathischen Schmerzen in Betracht kommen. Zentrale neuropathische Schmerzen sind nach allgemeiner Erfahrung schwieriger zu behandeln. Entsprechend ist die Number needed to treat höher [3]. Aus klinischer Sicht werden bei der Differenzialindikation auch phänomenologische Merkmale einbezogen – so werden einschießende Schmerzen eher mit Antikonvulsiva behandelt, Brennschmerzen eher mit Antidepressiva.
Ein aufgrund der Häufigkeit wichtig gewordener Problembereich ist Adipositas, metabolisches Syndrom und Diabetes mellitus Typ 2. Metabolische Erkrankungen stellen einerseits einen Risikofaktor für Schmerzsyndrome dar, vor allem in der unteren Körperhälfte, aber andererseits auch für das Auftreten einer Depression. Depressive Störungen sind wiederum ein Risikofaktor für das metabolische Syndrom [46], sodass sich komplexe Interaktionen bilden können. Da trizyklische Antidepressiva und Mirtazapin eine Gewichtszunahme stark fördern und für Diabetes mellitus Typ 2 ungeeignet sind, sollten bei einer diesbezüglichen Gefährdung eher Milnacipran oder die an der Nozizeption allerdings nicht ansetzenden Agomelatin oder Bupropion in Erwägung gezogen werden. Da sexuelle Dysfunktionen unter serotonerger antidepressiver Therapie häufig auftreten [65], sind hier Mirtazapin, Tianeptin bzw. Agomelatin, Bupropion oder Trazodon günstig zu bewerten [36, 37], während SSRI und Venlafaxin zu vermeiden sind [35].
Bei den sogenannten somatoformen Störungen, speziell den anhaltenden Schmerzstörungen [15] mit somatischen, psychischen und sozialen Faktoren bzw. Auswirkungen, kommt Antidepressiva eine willkommene Mitwirkung im Rahmen eines mehrdimensionalen Gesamtkonzepts zu. Die in Entstehung, Verlauf und Folgen heterogenen Syndrome bedürfen eingehender Untersuchungen und Verlaufskontrollen, zumal bei den heute zur Verfügung stehenden Antidepressiva die erwünschte Schmerzlinderung mit Verzögerung eintritt, nicht gleich nach der Verabreichung wie bei Analgetika. Zusätzlich ist zu beachten, dass unerwünschte Wirkungen vor den intendierten eintreten, was zur Forderung des Beginns mit niedriger Dosierung einhergeht. Im Fall von Amitriptylin bedeutet das, dass zu Beginn nur etwa 10 mg zur Nacht verordnet werden sollten, damit nicht unerwünschte Effekte sofort zum Abbruch dieser medikamentösen Option führen. Im späteren Verlauf werden bei Schmerzpatienten nach allgemeiner Erfahrung erheblich niedrigere Dosen als in der Behandlung von Depressionen angewandt, in der Größenordnung von etwa 50 % bei den trizyklischen Antidepressiva. Die SSRI und die dualen Antidepressiva sind in dieser Hinsicht noch nicht ausreichend evaluiert worden. – Bei den häufigen, komplexen und schwierig zu behandelnden Fibromyalgie-Syndromen wurden zahlreiche Antidepressiva-Studien durchgeführt, speziell von Amitriptylin. Unter TCA ergab sich ein signifikantes klinisches Ansprechen bei 25 bis 37 % [55], doch war die Effektstärke bei der Verbesserung der Schlafqualität (0,69) höher als die Schmerzreduktion (0,56). Die Wirksamkeit war bei Serotonin-Wiederaufnahmehemmern (Fluoxetin, Paroxetin, Citalopram) gering, in einigen Studien nicht besser als bei Placebo [55].
Die Toxizität von Antidepressiva rückte in den letzten Jahrzehnten in den Vordergrund der Aufmerksamkeit (Abb. 3). Im Rahmen einer verantwortungsvollen therapeutischen Gesamtkonzeption ist das Wirkungs- und Risikoprofil in die Überlegungen einzubeziehen. Hierzu ist kritisch anzumerken, dass Tranylcypromin in der rationalen Schmerzbehandlung eine wenig berechtigte Bedeutung besitzt. Bei den kontrollierten Studien ergab sich dabei nur in der Minderheit der Untersuchungen eine Wirksamkeit von MAO-Hemmern.
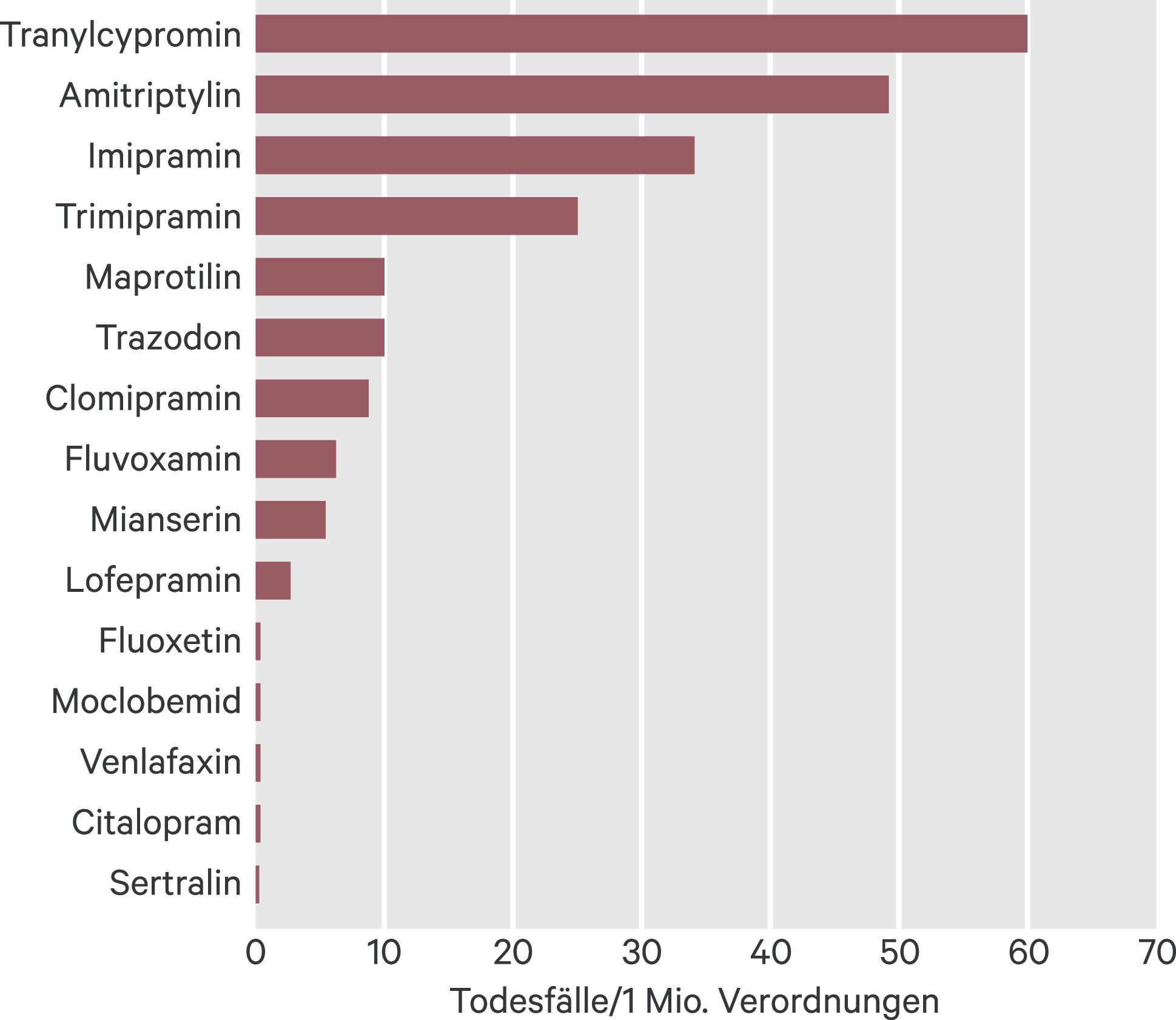
Abb. 3. Toxizität von Antidepressiva; fataler Toxizitätsindex (nach [35])
Die Abbildung entspricht recht gut den klinischen Erfahrungen. Während TCA und Mirtazapin sedieren, ist das bei Duloxetin, Milnacipran und Venlafaxin nicht der Fall. Mit dem Ziel der Risikominimierung, vor allem von letalen Komplikationen, sind deshalb die neueren dualen Substanzen zu favorisieren. Bei ihrem Einsatz ist aber gleichzeitig auch die begleitende Psychopathologie zu beachten und speziell Schlafstörungen, welche in der Mehrzahl der Fälle sowohl bei chronischen Schmerzsyndromen als auch bei depressiven Störungen vorliegen.
Abschließend ist aber erneut auf das Kontingenzprinzip in der Behandlung mit diesen Medikamenten hinzuweisen. Es spricht jeweils nur ein Teil der Patienten aller Schmerzsyndrome mit hinreichender Linderung (Response) an, das heißt mit 50 % Schmerzverringerung, in schweren und komplexen Fällen mit 30 % Besserung. Neben der Intensität ist allerdings die gegebenenfalls vorliegende Begleitsymptomatik in die therapeutischen Überlegungen einzubeziehen.
Zusammenfassung
Antidepressiva spielen eine wichtige Rolle in der Behandlung chronischer Schmerzpatienten. Beim kleineren Teil liegt dabei eine monokausale Ätiopathogenese vor durch Trauma, somatische Erkrankung oder Operation. Häufiger findet man eine komplexe Entstehung durch somatische, psychische, soziale und berufliche Faktoren. Zahlreiche chronifizierende Prozesse und maladaptives Coping können im Spiel sein.
Nach Analyse der Patientencharakteristika und situativen Besonderheiten können unter Berücksichtigung der Wirkungs-Nebenwirkungs-Profile verschiedene Antidepressiva im Rahmen eines therapeutischen Gesamtkonzepts nützlich sein.
Gegenwärtig werden zahlreiche Antidepressiva bei Schmerzsyndromen eingesetzt, insbesondere bei Assoziation mit Insomnie, Angst, Depression, posttraumatischen und anderen psychischen Störungen, doch ergab sich die besondere Eignung der dualen Substanzen Duloxetin und Milnacipran.
In der antidepressiven, analgetischen und anxiolytischen Behandlung mit sogenannten Antidepressiva gilt das Kontingenzprinzip: Wirkungen können eintreten oder aber nicht. Das erfordert die Verlaufsbeobachtung mit Dokumentation und Reflexion, wiederkehrende Erfassungen von Beschwerden, psychopathologischem Bild und somatischem Befund mit dem Funktionieren in Beruf und Familie.
Aus der Vielschichtigkeit und Komplexität chronischer Schmerzsyndrome ergibt sich die Forderung der gründlichen mehrdimensionalen Diagnostik mit einer entsprechenden personalen Vorgehensweise, bei Beachtung ethischer Werte und des Wirkungs-Toxizitätsprofils der verschiedenen Antidepressiva.
Interessenkonflikterklärung
Es liegen keine materiellen Konflikte vor.
Literatur
1. American Academy of Pain Medicine. Chronic pain medical treatment guidelines. MTUS (Effective July 18, 2009), 8 C.C.R. §§9792.20–9792.26: Page 1 of 127.
2. Baraldi M, Poggioli R, Santi A, Vergoni AV, et al. Antidepressants and opiates interactions: pharmacological and biochemical evidences. Pharmacol Res Commun 1983;15:843–57.
3. Baron R, Ludwig J, Binder A. Therapie Tabellen „Neuropathische Schmerzen“. Pentenried: Westermayer Verlag, 2006: 1–30.
4. Brannan SK, Mallinekrodt CH, Brown EB, Wohlreich MM, et. al. Duloxetine 60 mg once-daily in the treatment of painful physical symptoms in patients with major depressive disorder. J Psychiatr Res 2005;39:43–53.
5. Breivik H, Collett B, Ventafridda V, Cohen R, et al. Survey of chronic pain in Europe: Prevalence, impact on daily life, and treatment. Eur J Pain 2006;10:287–333.
6. Busch MA, Maske UE, Ryl L, Schlack R, et al. Prevalence of depressive symptoms and diagnosed depression among adults in Germany: results of the German Health Interview and Examination Survey for Adults (DEGSI). Bundesgesundheitsblatt, Gesundheitsforschung, Gesundheitsschutz 2013;56:733–9.
7. Cipriani A, Furukawa TA, Salanti G, Chaimani A, et al. Comparative efficacy and acceptability of 21 antidepressant drugs for the acute treatment of adults with major depressive disorder; a systematic review and network meta-analysis. Lancet 2018;391:1357–66.
8. Cook RJ, Sackett DL. The number needed to treat: a clinically useful measure of treatment effect. BMJ 1995;310:452–4.
9. Dengler W, Selbmann H-K. Praxisleitlinien in Psychiatrie und Psychotherapie. Angsterkrankungen. Darmstadt: Steinkopff, 2000.
10. Ebel H, Weichert K. Depressive Störungen bei Patienten in der Allgemeinmedizin. Dtsch Ärztebl 2002;99:A124–30.
11. Egle U, Hoffmann S, Lehmann K, Nix W. Handbuch chronischer Schmerz. Grundlagen, Pathogenese, Klinik und Therapie aus bio-psycho-sozialer Sicht. Stuttgart: Schattauer, 2002.
12. Erfurth A. Milnacipran. Ein neuer seroton-noradrenerger Wiederaufnahmehemmer. Thieme Drug Report 2016;10:1–12.
13. Finnerup NB, Otto M, McQuay HJ, Jensen TS, et al. Algorithm for neuropathic pain treatment: An evidence based proposal. Pain 2005;118:289–305.
14. Finnerup NB, Attal N, Haroutounian S, McNicol E, et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol 2015;14:162–73.
15. Fishbain DA, Cutler RB, Rosomoff HL, Rosomoff RS. Do antidepressants have an analgesic effect in psychogenic pain and somatoform pain disorder? A meta-analysis. Psychosom Med 1998;60:503–9.
16. Fisbain DA. Analgesic effects of antidepressants. J Clin Psychiatry 2003;64:96–7.
17. Fritze J, Riedel C, Escherich A, Beinlich P, et al. Antidepressiva: Spektrum der Verordnung und Morbidität. Explorative Analyse anhand einer Vollerfassung der Abrechnungsdaten der Gesetzlichen Krankenversicherung. Psychopharmakotherapie 2017;24:211–29.
18. Gaebel W, Falkai P. Praxisleitlinien für Psychiatrie und Psychotherapie. Affektive Erkrankungen. Darmstadt: Steinkopff, 2000.
19. Gillman K. Lancet ‘21 antidepressants’ meta-analysis. PsychoTropicalResearch published online February 26, 2018. https://psychotropical.info/lancet-21-antidepressants-meta-analysis (Zugriff am 06.04.2018).
20. Goldstein DJ, Lu Y, Detke MJ, Lee TC, et al. Duloxetine vs. placebo in patients with painful diabetic neuropathy. Pain 2005;116:109–18.
21. Gureje O, Von Korff M, Simon G, Gater R. Persistent pain and well-being: a World Health Organization study in primary care. JAMA 1998;280:147–51.
22. Gureje O, Simon GE, Von Korff M. A cross-national study of the course of persistent pain in primary care. Pain 2001;92:195–200.
23. Gureje O, Von Korff M, Kola L, et al. The relation between multiple pains and mental disorders: Results from the world mental health surveys. Pain 2008;135:82–91.
24. Haanpää M, Hietaharju A. Halting the march of painful diabetic neuropathy. Pain Clin Updates 2013;23:1–7.
25. Holliday SM, Benfield P. Venlafaxine. A review of its pharmacology and therapeutic potential in depression. Drugs 1995;49:280–94.
26. International Association for the Study of Pain. Classification of chronic pain. Descriptions of chronic pain syndromes and definitions of pain. Seattle: IASP Press, 1979, 1994.
27. Joannidis JPA. The mass production of redundant, misleading, and conflicted systematic reviews and meta-analyses. Milbank Q 2016;94:485–514.
28. Judd LL, Kessler RC, Paulus MP, Zeller PV, et al. Comorbidity as a fundamental feature of generalized anxiety disorders: results from the National Comorbidity Study (NCS). Acta Psychiatr Scand 1998;98(Suppl 393):6–11.
29. Kasper S. Produktmonographie: Milnacipran. Ein neuer Wirkstoff. Langenfeld: neuraxpharm Arzneimittel, 2016.
30. Keller C. Schmerz und Depression. Bremen: Uni-Med Verlag, 2004.
31. Keller MB, Hanks DL. Anxiety symptom relief in depression treatment outcomes. J Clin Psychiatry 1995;56(Suppl 6):22–9.
32. Kessler RC, Nelson CB, Mc Gonagle KA, et al. Comorbidity of DSM III R major depressive disorder in the general population: results from the US National Comorbity Survey. Br J Psychiatry 1996;168(Suppl 30):17–30.
33. Kosek A, Cohen M, Baron R, Gebhart GF, et al. Do we need a third mechanistic descriptor for chronic pain states? Pain 2016;157:1382–6.
34. Kuhn R. Über die Behandlung depressiver Zustände mit einem Iminodibenzylderivat (G 22355). Schweiz Med Wschr 1957;87:1135–40.
35. Laux G, Dietmaier O. Antidepressiva. Praktische Psychopharmakotherapie. 6. Auflage. München: Urban und Fischer, 2012: 106–61.
36. Laux G, Huttner N. Agomelatin in der Depressionsbehandlung über 12 Monate. Follow-up der Vivaldi-Studie. Psychopharmakotherapie 2013;20:119–27.
37. Laux G, Müller WE. PPT-Serie Weiterbildungs-Curriculum Psychopharmakologie/Pharmakotherapie Folge 2: Verhaltenspharmakologie und klinische Psychopharmakotherapie der Antidepressiva. Psychopharmakotherapie 2018;25:21–39.
38. Maier C. Wieder ein „War on drugs“. Ein Krieg gegen Süchtige und ein „roll-back“ für opioidbedürftige Patienten? Schmerz 2018;32:167–70.
39. Max MB. Antidepressants as analgesics. In: Fields HL, Liebeskind JC (eds.). Progress in Pain Research and Management. Vol 1. Seattle: IASP Press, 1994:229–46.
40. McQuay HJ, Moore RA. Antidepressants in chronic pain. Br Med J 1998;314:763–4.
41. McQuay HJ, Tramér M, Nye BA, et al. A systematic review of antidepressants in neuropathic pain. Pain 1996;68:217–27.
42. Milligan K. Prescribing antidepressants in general practice. Br Med J 1997;314:827–8.
43. Möller HJ, Laux G, Deister A. Psychiatrie und Psychotherapie. 2. Auflage. Stuttgart: Thieme, 2001.
44. Müller WE, Laux G. PPT-Serie Weiterbildungs-Curriculum Psychopharmakologie/Pharmakotherapie Teil 1: Allgemeine Psychopharmakotherapie, allgemeine Pharmakologie, Antidepressiva – Pharmakologie. Psychopharmakotherapie 2017;24:276–82.
45. Onghena P, van Houdenhove B. Antidepressant-induced analgesia in chronic non-malignant pain: a meta-analysis of 39 placebo-controlled studies. Pain 1992;49:205–19.
46. Otte Ch. Einfluss von Depression und Antidepressiva auf Adipositas, metabolisches Syndrom und Diabetes mellitus Typ 2. Psychopharmakotherapie 2017;24:204–10.
47. Philipp M, Fickinger M. Psychotropic drugs in the management of chronic pain syndromes. Pharmacol Psychiatry 1993;26:221–34.
48. Pilowsky I. Affective disorders and pain. In: Dubner R, Gebhardt GF, Bond MR (eds.). Proceedings, Vth World Congress on Pain. Amsterdam, New York, Oxford: Elsevier, 1988:263–75.
49. Rowbotham MC, Goli V, Kunz NR, Lei D. Venlafaxin extended release in the treatment of painful diabetic neuropathy: A double-blind placebo-controlled study. Pain 2004;110:697–706.
50. Saarto T, Wiffen P. Antidepressants for neuropathic pain. Cochrane Database Syst Rev 2005;20(3):CD005454.
51. Schmauß M, Messer T. Depressive Episoden und rezidivierende depressive Störungen. Fortschr Neurol Psychiat 2003;71:341–57.
52. Schmauß M. Depression. Therapietabellen. Pentenried: Westermayer Verlag, 2013.
53. Sindrup SH, Bach FW, Madsen C, Gram LF, et al. Venlafaxine versus imipramine in painful polyneuropathy: a randomized, controlled trial. Neurology 2003;60:1284–9.
54. Smith EM, Pang H, Cirrincione C, Fleishman S, et al. Alliance for clinical trials in oncology. Effect of duloxetine on pain, function and quality of life among patients with chemotherapy-induced painful peripheral neuropathy: a randomized clinical trial. JAMA 2013;309:1359–67.
55. Sommer C, Häuser W, Berliner M, Brückle W, et al. Medikamentöse Therapie des Fibromyalgiesyndroms. Schmerz 2008;22:313–23.
56. Spencer CM, Wilde MI. Milnacipran: A review of its use in depression. Drugs 1998;56:405–27.
57. Stein P, Kasper S. Antidepressive Therapie. Stellenwert neuer Antidepressiva. DNP Der Neurologe und Psychiater 2011;12:68–72.
58. Strubel T, Birkhove H, Mößmer G, Förstel H. Blutungsrisiko unter SSRI-Behandlung. Nervenarzt 2010;81:549–55.
59. Swanson DW. Chronic pain as third pathologic emotion. Am J Psychiatry 1984;141:201–4.
60. Symreng I, Fishman SM. Anxiety and pain. Pain Clin Updates 2004;XII:1–6.
61. Vitton O, Gendreau M, Gendreau J, Kranzler J, et al. A double-blind placebo-controlled trial of milnacipran in the treatment of fibromyalgia. Hum Psychopharmacol 2004;19(Suppl 1):27–35.
62. Vlaeyen JWS, Crombez G. Fear and pain. Pain Clin Updates 2007;XV:1–4.
63. Vollmer TL, Robinson MJ, Risser RS, Malcolm SK. A randomized, double-blind, placebo-controlled trial of duloxetine for the treatment of pain in patients with multiple sclerosis. Pain Pract 2014;14:732–44.
64. Vranken J, Hollmann MW, van der Vegt MH, Kruis MR, et al. Duloxetine in patients with central neuropathic pain caused by spinal cord injury or stroke: A randomized, double-blind, placebo-controlled trial. Pain 2011;152:267–73.
65. Wenzel-Seifert K, Ostermaier C-P, Conca A, Haen E. Sexuelle Funktionsstörungen unter antidepressiver Pharmakotherapie. Psychopharmakotherapie 2015;22:205–11.
66. Wenzel-Seifert K, Ostermaier C-P, Werneck A, Omar NB, et al. Unerwünschte kardiovaskuläre Wirkungen von Psychopharmaka. Pathophysiologie und Risikominimierung. Psychopharmakotherapie 2013;20:148–57.
67. Wittchen H-U, Jacobi F, Klose M, Ryl L. Gesundheitsberichterstattung des Bundes. Heft 51: Depressive Erkrankungen. Berlin: Robert Koch Institut, 2010.
68. Wörz R. Die multidimensionale, nonlineare Schmerzkonzeption. Ein breiter Ansatz für Erklärung und Verständnis komplexer Schmerzsyndrome. Fortschr Med 2001;119:129–33.
68. Wörz R. Pain in depression – depression in pain. Pain Clin Updates 2003;XI:1–4.
70. Wörz R. Schmerz ist ein Bewusstseinsphänomen. Diagnostischer Ausgang von Erleben und Verhalten. Nervenheilkunde 2009;11:839–42.
71. Wörz R. Schmerz und Ethik. Remscheid: Rediroma-Verlag, 2016.
Priv.-Doz. Dr. med. habil. Roland Wörz, Arzt für Neurologie und Psychiatrie, Schmerztherapie, Friedrichstraße 73, 76669 Bad Schönborn, E-Mail: woerz.roland@t-online.de
Antidepressants in chronic pain – Administration in the frame of personalized medicine
Antidepressants play an important role in the treatment of chronic pain patients. In a part of them, there is a monocausal etiopathogenesis due to trauma, disease or operation. In the majority however, a complex of somatic, mental, social or job-related factors is found. Numerous chronifying processes and mal-adaptive coping-mechanisms may interact.
In the analgesic, antidepressant and anxiolytic management with antidepressants, the contingency principle is to consider: Efficacy and side effects can occur or not. Due to these facts, regular controls of the treatment course with assessment of signs and symptoms, of psychopathological features and functioning in family and job are necessary. The complexity of chronic pain syndromes in association with other disorders and diseases requires a multidimensional diagnostic procedure respecting ethical values and situational characteristics, with thorough history and careful examination, with assessing special situational influences, and reflecting possible efficacy and risk profiles.
At present, a great number of antidepressant drugs may be administered in pain syndromes, especially in association with insomnia, anxiety, depression, post-traumatic stress and other mental disorders. However, according to scientific evidence, the dual-acting pharmaceutic drugs duloxetine and milnacipran have significant advantages in the treatment of chronic pain patients.
Key words: Pain, tricyclic antidepressants, dual antidepressants, specific serotonin reuptake-inhibitors, personalized pain medicine
Psychopharmakotherapie 2019; 26(01):16-23
