Analyse von CYP450-Wechselwirkungen: kleiner Aufwand, große Wirkung
Holger Petri, Bad Wildungen
Zu den Cannabis-basierten Arzneimitteln zählen die als Fertigarzneimittel verfügbaren Wirkstoffe Nabilon und Nabiximols, die Reinstoffe Cannabidiol und Dronabinol sowie Cannabisextrakte und Cannabisblüten. Die für die therapeutischen Effekte verantwortlichen Cannabinoide sind das psychoaktive Tetrahydrocannabinol (THC) und Cannabidiol (CBD). In Abhängigkeit der Anwendungsart unterscheidet sich die Pharmakokinetik der Cannabis-basierten Arzneimittel und damit auch das Potenzial für Cytochrom-P450-bedingte Wechselwirkungen.
Der metabolische Weg von Δ9-Tetrahydrocannabinol führt zum pharmakologisch äquipotenten, psychoaktiven Metaboliten 11-Hydroxy-Δ9-Tetrahydrocannabinol (11-OH-THC). 11-OH-THC wird weiter zum inaktiven Metaboliten 11-nor-9-Carboxy-Δ9-Tetrahydrocannabinol (Tetrahydrocannabinolsäure, THC-COOH) verstoffwechselt (Abb. 1). Cannabidiol wird zu inaktiven Metaboliten abgebaut. Die Reaktionsschritte werden primär über Cytochrom-P450-Isoenzyme katalysiert [9]. Es gibt nur wenige pharmakokinetische In-vivo-Interaktionsstudien mit Cannabis-basierten Arzneimitteln.
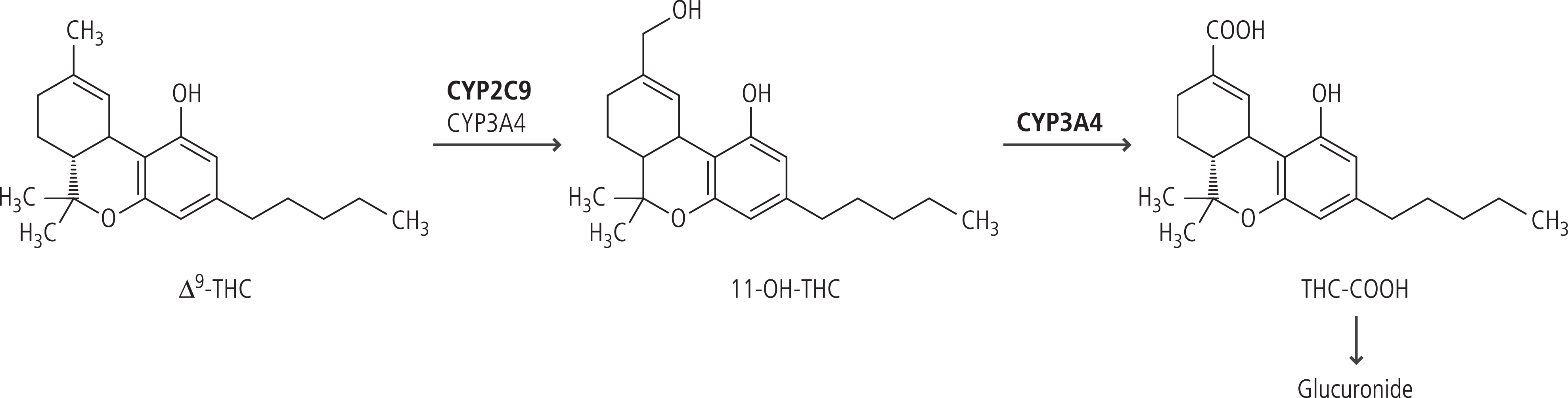
Abb. 1. Metabolismus von Δ9-Tetrahydrocannabinol (Δ9-THC). 11-OH-THC: 11-Hydroxy-Δ9-Tetrahydrocannabinol; THC-COOH: Tetrahydrocannabinolsäure
Cannabidiol
Cannabidiol systemisch eingenommen beugt Anfällen beim Dravet-Syndrom und Lennox-Gastaut-Syndrom vor. Clobazam ist bei diesen Erkrankungen ein häufig eingesetztes Antikonvulsivum. Clobazam wird über CYP3A4 zum aktiven Metaboliten N-Desmethylclobazam (N-CLB) verstoffwechselt. Dieser wird anschließend über CYP2C19 weiter abgebaut [4]. Cannabidiol erhöhte bei Kindern die Clobazam-Plasmaspiegel um 60 ± 80 %, die seines Metaboliten N-CLB um 500 ± 300 % [7]. In einer weiteren Untersuchung wurden Plasmaspiegeländerungen häufig eingesetzter Antikonvulsiva durch Cannabidiol bei Erwachsenen und Kindern gemessen. Mit zunehmender Cannabidiol-Dosis stiegen die AUC-Werte (Fläche unter der Konzentrations-Zeit-Kurve) von Clobazam, Topiramat und Rufinamid. Bei Erwachsenen stiegen auch die Plasmaspiegel von Eslicarbazepin und Zonisamid. Nur bei Clobazam und N-Desmethylclobazam lagen die Plasmaspiegel im Durchschnitt überhalb der empfohlenen Referenzwerte. Bei den anderen Antikonvulsiva lagen nur in Einzelfällen zu hohe Plasmaspiegel vor, die eine Dosisreduktion erforderlich machten [6]. Zonisamid ist ein Substrat von CYP3A4. Somit wirkt Cannabidiol in höheren Dosen als CYP3A4-Hemmer.
Cannabis geraucht und vaporisiert
Die durch den Verbrennungsprozess von Cannabis und Zigaretten gebildeten polyzyklischen Kohlenwasserstoffe induzieren die Bildung von CYP1A2 [1, 14]. Theophyllin ist ein CYP1A2-Indexsubstrat. Marihuana-Raucher hatten in einer Studie eine um 42 % höhere Theophyllin-Clearance. Dieser Wert lag im Bereich von Zigaretten rauchenden Probanden. Der Nettoeffekt war bei Marihuana- und Zigaretten-Rauchern signifikant größer mit einer um 79 % höheren Theophyllin-Clearance [14]. Diese Ergebnisse spiegeln sich wider in einer pharmakokinetischen Analyse bei Patienten unter Chlorpromazin-Therapie. Die geschätzte Clearance war gegenüber Nichtrauchern um 38, 50 und 107 % höher bei regelmäßigen Zigaretten-Rauchern, Marihuana-Rauchern oder in Kombination [1]. Dies ist zu beachten bei Patienten, die Arzneimittel einnehmen, deren Metabolismus wesentlich von CYP1A2 abhängig ist, wie Clozapin, Duloxetin und Olanzapin. Die Induktion zeigt sich ab zweimaligem Cannabis-Rauchen in der Woche [14].
Der präsystemische First-Pass-Effekt wird durch die inhalative Anwendung umgangen. Somit sind die zu erwartenden pharmakokinetischen Interaktionen mit CYP-Modulatoren von geringerem Ausmaß im Vergleich zur systemischen Einnahme [8]. Untersuchungen hierzu liegen nicht vor. Beim Verdampfen mittels Vaporisator kommt es nicht zu Abbauprodukten durch Verbrennungsprozesse und somit auch nicht zur Induktion von CYP1A2.
Dronabinol
Dronabinol ist das pharmakologisch aktive (–)-Δ9-trans-Tetrahydrocannabinol-Isomer von THC. In Deutschland ist Dronabinol nur als Rohsubstanz verfügbar, in den USA ist es als Arzneimittel zugelassen (Marinol®). Der Abbau von THC zu seinem Hauptmetaboliten wird primär über das polymorph exprimierte Enzym CYP2C9 katalysiert (Abb. 1).
Träger der beiden Allele CYP2C9*2 und *3 exprimieren Enzyme mit verminderter Enzymaktivität [2]. Etwa 1 bis 3 % der Mitteleuropäer sind homozygote Träger dieser Genvarianten und können CYP2C9-Substrate nur in stark reduziertem Umfang verstoffwechseln. Wesentlich häufiger sind heterozygote Allelträger (intermediate metabolizer) (Tab. 1). Der Einfluss des CYP2C9-Polymorphismus auf die Exposition des oral eingenommenen Dronabinols in einer Dosis von einmalig 15 mg wurde mit gesunden Probanden in einer Studie untersucht [12]. Bei den homozygoten CYP2C9*3-Allelträgern waren die Plasmaspiegel von THC um das Dreifache erhöht, bei den heterozygoten verdoppelt. Die 11-OH-THC-Plasmaspiegel waren unbeeinflusst. Dies könnte auf den vermehrten Abbau von Dronabinol über CYP3A4 zurückzuführen sein. Weshalb sich die pharmakokinetischen Parameter der homo-und heterozygoten CYP2C9*2-Allelträger nicht von denen der Wildträger unterschieden, kann nur vermutet werden. Studien mit potenten CYP2C9-Inhibitoren (Abb. 2) sind notwendig, um den Einfluss auf die Exposition von Dronabinol und THC zu evaluieren.
Nabilon
Nabilon ist ein vollsynthetisches Derivat von THC. Am extensiven Metabolismus von Nabilon sind zahlreiche Cytochrom-P450-Isoenzyme beteiligt. Durch direkte Oxidation entstehen Hydroxyl- und Carboxylanaloga [3]. Vermutlich hat CYP2C9 hier die größte Bedeutung [11]. Klinische pharmakokinetische Studien liegen nicht vor. Problematisch ist, dass Nabilon (Canemes®) in Deutschland nur als 1-mg-Kapsel vorliegt [3]. 1 mg Nabilon entspricht der Wirkung von 7 bis 8 mg Dronabinol und somit sind Dosisanpassungen, die CYP-bedingt sein können, nur in größeren Schritten möglich [8].
THC/CBD (Nabiximols) als Mundspray
Nabiximols ist ein spezieller Cannabis-Extrakt, der THC und CBD im Verhältnis 1 : 1 enthält. In einer klinischen Studie mit Probanden wurden die Veränderungen der pharmakokinetischen Parameter von THC, 11-OH-THC und CBD nach Anwendung von vier Sprühstoßen des Nabiximols-Mundsprays in Kombination mit den CYP-Modulatoren Rifampicin, Ketoconazol und Omeprazol gemessen [13].
Rifampicin als mittelstarker Induktor von CYP2C9 und starker Induktor von CYP3A4 senkte die AUC von THC um 20 %. Eine 87%ige Reduktion von 11-OH-THC und eine 60%ige Reduktion von CBD wurden beobachtet. Ketoconazol als starker CYP3A4-Hemmer führte zu einer Erhöhung der AUC von THC um das 1,8-Fache, von 11-OH-THC um das 3,6-Fache und von CBD um das 2-Fache. Der Einfluss von Omeprazol als mittelstarker CYP2C19-Inhibitor war ohne signifikanten Effekt auf die Bioverfügbarkeit von THC, 11-OH-THC und CBD [5, 13]. Somit sind THC, in höherem Ausmaß 11-OH-THC sowie CBD Substrate von CYP3A4. Vorsicht ist geboten in Kombination mit CYP3A4-Modulatoren (Abb. 2). In vitro sind THC und CBD Substrate von CYP2C19 [10, 12]. Die Ergebnisse dieser Studie deuten auf eine geringe klinische Bedeutung dieses Enzyms im Metabolismus hin.
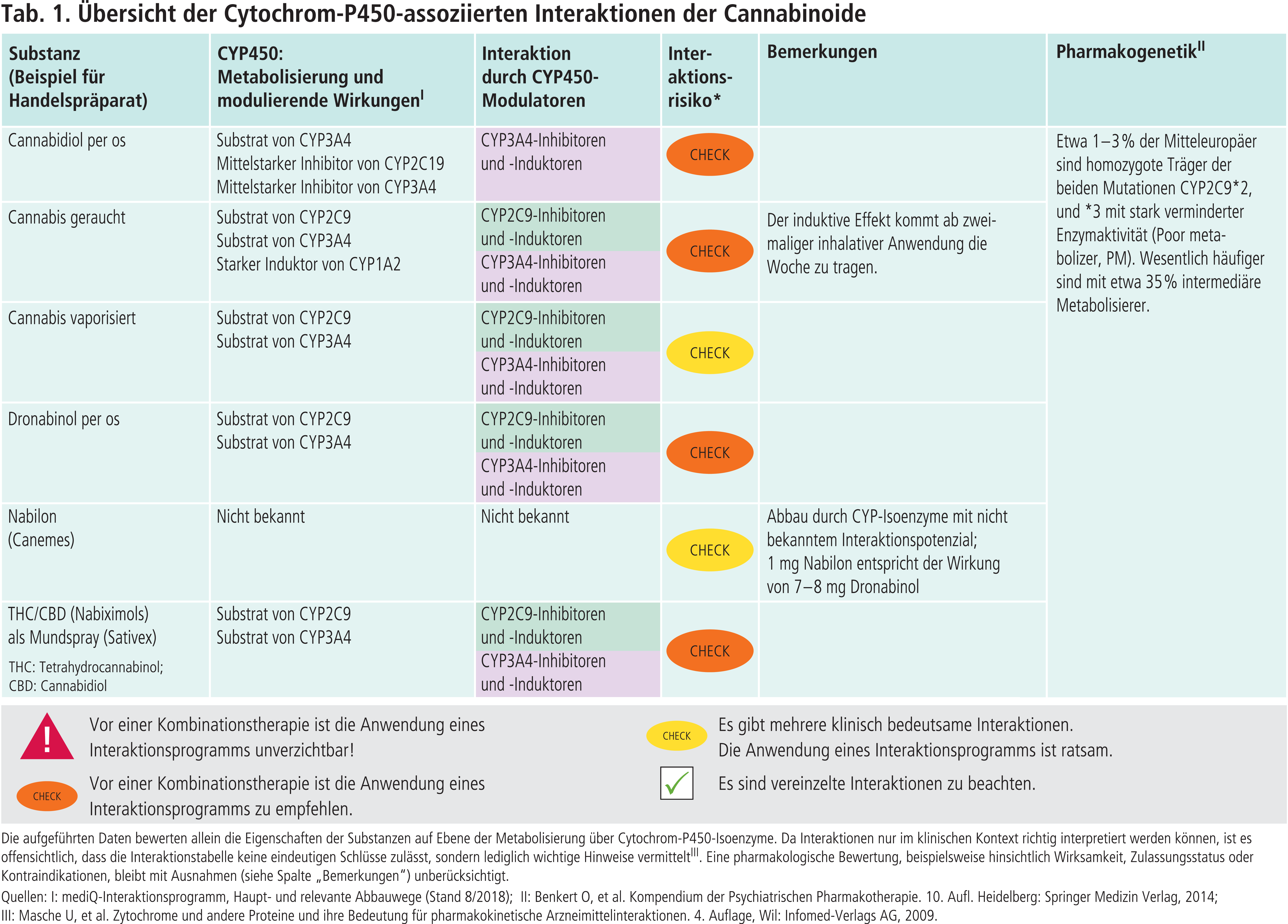
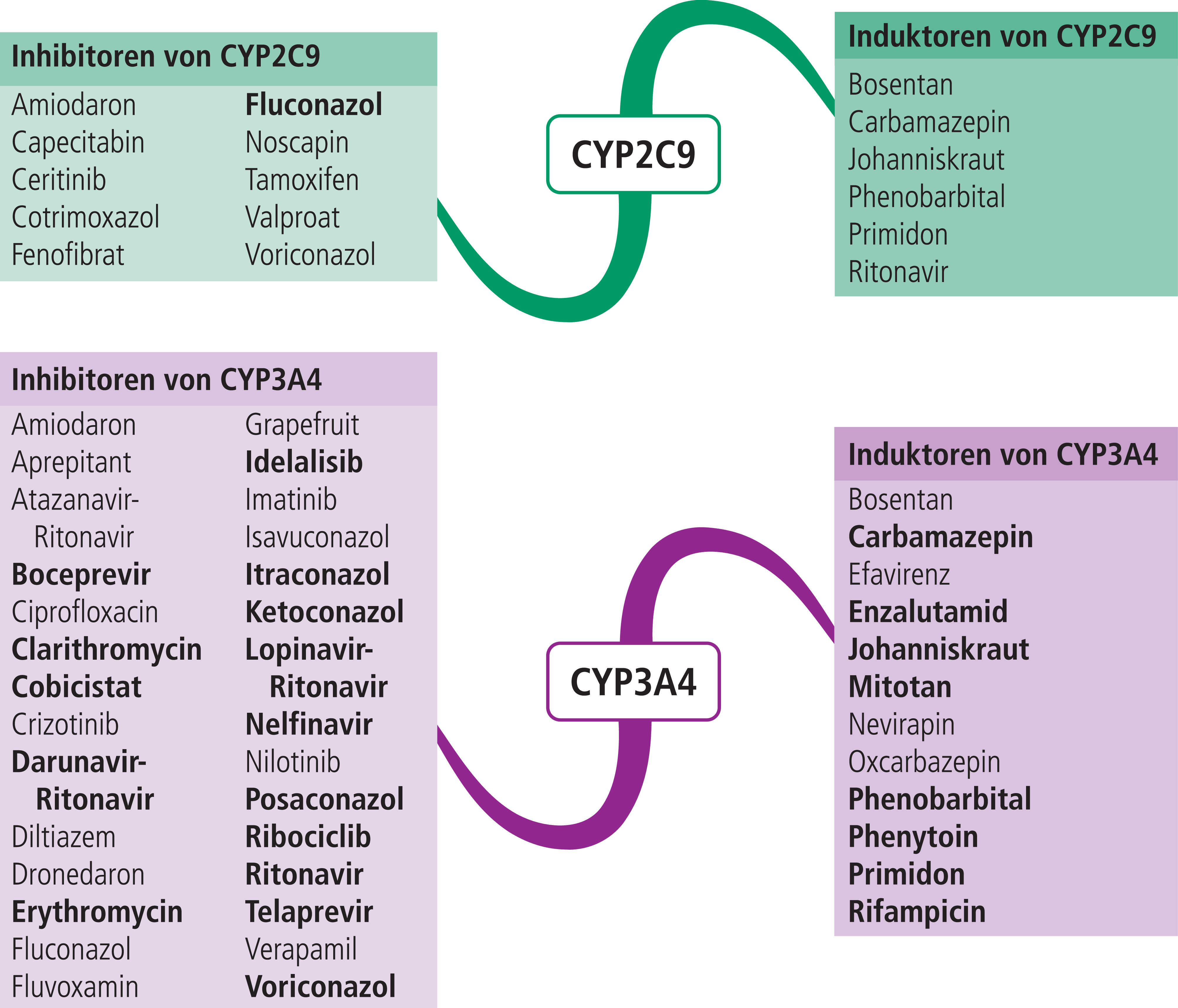
Abb. 2. Auswahl von modulierenden Substanzen (stark wirkende fettgedruckt) mit klinisch relevanter Wirkung auf Cytochrom P450 (CYP) 2C9 und 3A4 (Stand 8/2018) [Quelle: mediQ-Interaktionsprogramm]
Literatur
1. Anderson GD, Chan LN. Pharmacokinetic drug interactions with tobacco, cannabinoids and smoking cessation products. Clin Pharmacokinet 2016;55:1353–68.
2. Caudle KE, Rettie AE, Whirl-Carrillo M, et al. Clinical pharmacogenetics implementation consortium guidelines for CYP2C9 and HLA-B genotypes and phenytoin dosing. Clin Pharmacol Ther 2014;96:542–8.
3. Fachinformation Canemes®. Stand: Oktober 2016.
4. Fachinformation Frisium®. Stand: März 2017.
5. Fachinformation Sativex®. Stand: März 2015.
6. Gaston TE, Bebin EM, Cutter GR, et al. Interactions between cannabidiol and commonly used antiepileptic drugs. Epilepsia 2017;58:1586–92.
7. Geffrey AL, Pollack SF, Bruno PL, et al. Drug-drug interaction between clobazam and cannabidiol in children with refractory epilepsy. Epilepsia 2015;56:1246–51.
8. Grotenhermen F, Häußermann K. Cannabis-Verordnungshilfe für Ärzte 2., aktualisierte Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft Stuttgart, 2017.
9. Grotenhermen F. Pharmacokinetics and pharmacodynamics of cannabinoids. Clin Pharmacokinet 2003;42:327–60.
10. Lucas CJ, Galettis P, Schneider J. The pharmacokinetics and the pharmcodynamics of cannabinoids. Doi: 10.1111/bcp.1371011.
11. Maida V, Daeninck PJ. A user’s guide to cannabinoid therapies in oncology. Curr Oncol 2016;23:398–406.
12. Sachse-Seeboth C, Pfeil D, Sehrt D, et al. Interindividual variation in the pharmacokinetics of Delta9-tetrahydrocannabinol as related to genetic polymorphisms in CYP2C9. Clin Pharmacol Ther 2009;85:273–6.
13. Stott C, White L, Wright S, et al. A Phase I, open-label, randomized, crossover study in three parallel groups to evaluate the effect of rifampicin, ketoconazole, and omeprazole on the pharmacokinetics of THC/CBD oromucosal spray in healthy volunteers. Springerplus 2013 doi: 10.1186/2193-1801-2-236.
14. Stout SM, Cimino NM. Exogenous cannabinoids as substrates, inhibitors, and inducers of human drug metabolizing enzymes: a systematic review. Drug Metab Rev 2014;46:86–95.
Herrn Prof. Dr. Winfried Häuser, Saarbrücken, gewidmet.
*Nachdruck aus Krankenhauspharmazie 2018;39:397–401.
Der Artikel wurde unter Einbeziehung von Diskussionsbeiträgen von Dr. Jörg Brüggmann, Berlin, Prof. Dr. Christoph Hiemke, Mainz, und Dr. Jochen Weber, Bad Wildungen, erstellt.
Holger Petri, Zentral-Apotheke der Wicker Kliniken, Im Kreuzfeld 4, 34537 Bad Wildungen, E-Mail: hpetri@werner-wicker-klinik.de
Psychopharmakotherapie 2018; 25(05):259-262
