Timo Greiner, Michael Schneider, Rüdersdorf, Detlef Degner, Göttingen, Sermin Toto, Stefan Bleich, Hannover, Renate Grohmann, München, und Martin Heinze, Rüdersdorf
Myocloni under polypharmacy. Case-report from the project “Arzneimittelsicherheit in der Psychiatrie” (AMSP)
Myocloni are short, sudden and involuntary muscle twitches that can occur as adverse drug effect of many pharmaceuticals. They are also known as a symptom of the serotonin syndrome. In the following case a patient experienced muscle twitches at night that worried him. At the time the patient took venlafaxine, risperidone, and lorazepam, the latter in the process of being tapered off. Pipamperone was present as medication to be taken as needed.
The presented case has been documented in the project “Arzneimittelsicherheit in der Psychiatrie” (AMSP) and it has been evaluated in national conferences. Since 1993 AMSP systematically monitors the occurence of severe, new and unusual adverse drug reactions of psychopharmaceuticals in the treatment of psychiatric inpatients.
Key words: Polypharmacy, myoclonus, serotonin-noradrenaline-reuptake-inhibitor, AMSP
Kasuistik
Ein 46-jähriger Patient wurde wegen einer schweren depressiven Episode (F32.3) stationär behandelt. Ihm wurde aufgrund akuter Suizidalität und drängender Gedanken Risperidon (1 mg/Tag) und Lorazepam (1-3 mg/Tag) verordnet. Zur Verbesserung der depressiven Symptomatik wurde er langsam auf Venlafaxin (Enddosis 225 mg/Tag) eingestellt. Lorazepam wurde nach drei Wochen in mehreren Schritten reduziert, wobei zum Zeitpunkt des Auftretens der unerwünschten Arzneimittelwirkung (UAW) nur mehr 0,5 mg zur Nacht gegeben wurden. Pipamperon wurde als Bedarfsmedikation verschrieben und wurde auch im zeitlichen Umfeld der UAW eingenommen (40 mg/Tag; Abb. 1). Weitere Arzneimittel, die der Patient mitbrachte, waren Ramipril (10 mg/Tag), Amlodipin (10 mg/Tag) und Hydrochlorothiazid (HCT; 25 mg/Tag). Lorazepam und HCT wurden etwa zeitgleich abgesetzt. Zudem wurde, auch zu diesem Zeitpunkt, wegen benigner Prostatahyperplasie Silodosin neu angesetzt.
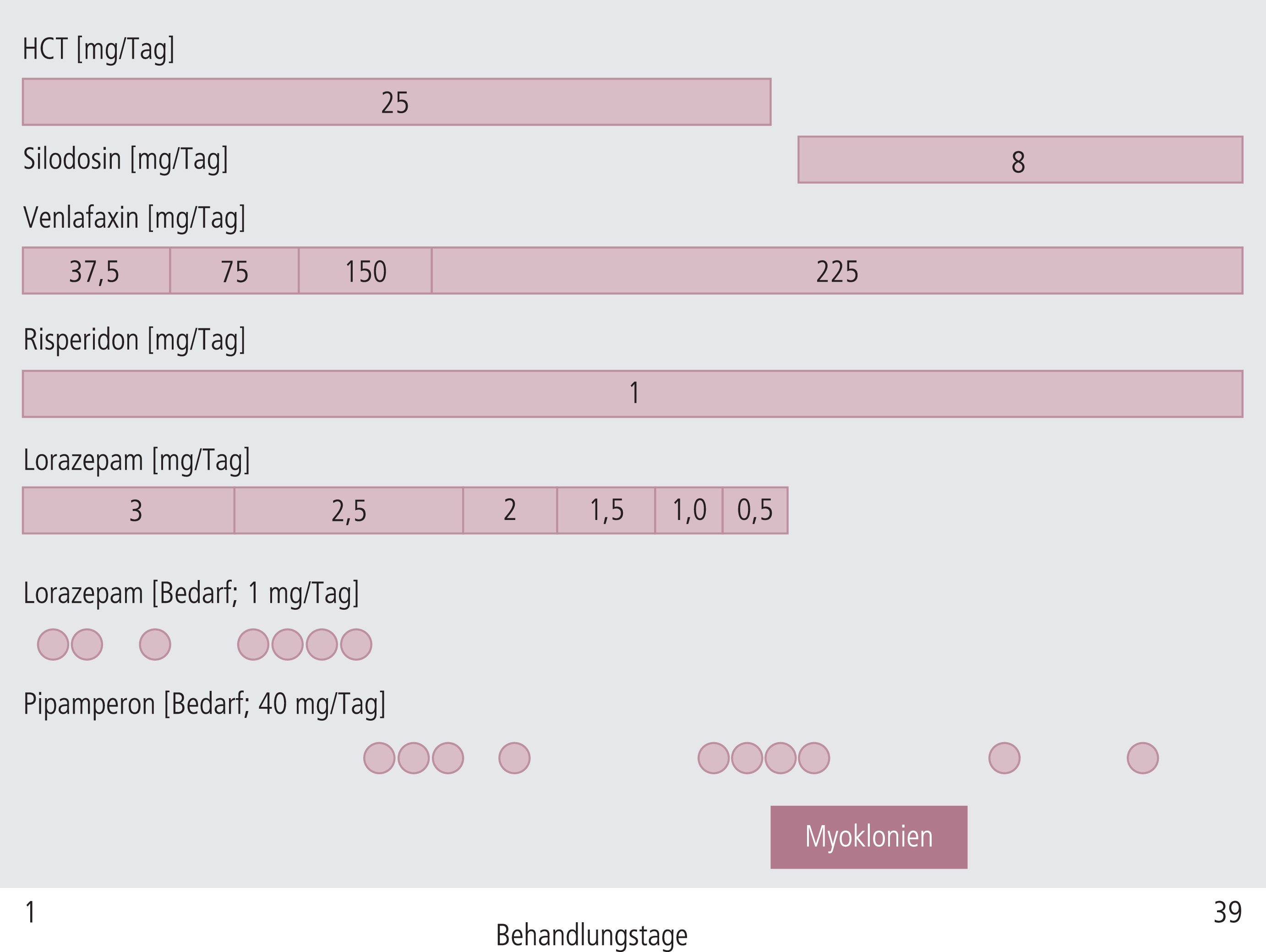
Abb. 1. Übersicht zum Verlauf der medikamentösen Behandlung im dargestellten Fall. Zusätzlich nahm der Patient im gesamten Zeitraum Ramipril (10 mg/Tag) und Amlodipin (10 mg/Tag).
Einige Tage nach Erreichen der Venlafaxin-Zieldosis berichtete der Patient über ihn sehr beunruhigende nächtliche Muskelzuckungen, die nicht näher beschrieben und dokumentiert wurden. Der Bericht erfolgt daher nach Angaben des Patienten. Die Myoklonien traten etwa zeitgleich mit der letzten Einnahme von Lorazepam auf und sistierten etwa sechs Tage später von allein. Venlafaxin wurde unverändert weitergeführt, auch Pipamperon wurde nach Abklingen noch zweimal genommen (Abb. 1).
Die Blutwerte lagen zumindest eine Woche vor Auftreten der Myoklonien alle im Normalbereich. Über weiteres Auftreten von Myoklonien während des restlichen Aufenthalts wurde vonseiten des Patienten nicht berichtet. Daher wurden keine weiteren Maßnahmen getroffen.
Diskussion
Myoklonus ist definiert als kurzes, plötzlich eintretendes Muskelzucken, das im Gegensatz zu Faszikulationen einen Bewegungseffekt hat [3]. Von einem „positiven“ Muskelklonus spricht man bei einer synchronisierten Kontraktion mit anschließender Relaxation, ein „negativer“ Muskelklonus beschreibt einen kurz andauernden Muskeltonusverlust (auch: Asterixis). Dieses Phänomen lässt sich in die Gruppe der hyperkinetischen Bewegungsstörungen wie Chorea, Dystonie, Tics, Akathisie und Tremor einordnen [14].
Verlässliche Zahlen zur Epidemiologie sind selten zu finden. Caviness et al. geben für Olmsted County in Minnesota eine Inzidenzrate von 1,3 Fällen auf 100 000 Einwohner im Jahr an. Die Lebenszeit-Prävalenz wird mit 8,6 auf 100 000 Einwohner angegeben [3]. Garvey und Tollefson beschrieben das Auftreten von Myoklonien bei 30 % der mit Trizyklika behandelten Patienten. Klinisch bedeutsam waren die Myoklonien allerdings nur bei 9 % der Patienten [5].
Das klinische Bild stellt sich hochvariabel und inkonsistent dar. Myoklonien können in Ruhe, in Bewegung oder durch Reize provoziert auftreten. Die Lokalisation kann ein Hinweis auf den Sitz des jeweiligen „Reizgenerators“ geben: Ein fokales Auftreten ist typisch für einen Ursprung im primären somatosensorischen Kortex, während ein generalisierter Myoklonus eher im Hirnstamm generiert wird [12]. Ein subkortikaler Ursprung kann ein eher segmentales Bild ergeben. Typisch für einen spinal gelegenen Sitz des Reizgenerators ist die segmentale Ausprägung in Verbindung mit Reizsensitivität [12]. Ein peripherer Myoklonus kann nach Nervenläsionen auftreten und ist bis auf den hemifazialen Spasmus selten.
Myoklonien können kontinuierlich oder intermittierend, rhythmisch oder irregulär auftreten. Eine ätiologische Zuordnung ist aufgrund einer Vielzahl von zugrunde liegenden physiologischen Mechanismen und möglichen Differenzialdiagnosen oft nicht sicher möglich.
Grundsätzlich lässt sich eine Einteilung in physiologische, essenzielle, epileptische und symptomatische Myoklonien vornehmen [5]. Zu den physiologisch auftretenden Formen gehören der Singultus, der Aktionsmyoklonus und die Einschlafmyoklonien. Der essenzielle Myoklonus (11 % der dokumentierten Fälle) als klinisch isoliertes Phänomen ohne Hinweise auf Epilepsie oder Ataxie tritt als hereditäre oder sporadisch idiopathische Variante auf [3]. 17 % der Fälle entfallen auf Myoklonien als Symptom einer zugrunde liegenden Erkrankung aus dem epileptischen Formenkreis. Die mit Abstand meisten Fälle (72 %) werden als symptomatische Myoklonien nichtepileptischer Genese klassifiziert. Als Beispiele für Grunderkrankungen werden neurodegenerative Prozesse, Schlaganfälle und Hirntumoren vor allem in den Basalganglien, Infektionen und Entzündungen, Toxine und Drogen, metabolische Verschiebungen und Arzneimittel genannt [3, 12].
Jiménez-Jiménez et al. führen in einem 2004 erschienenen Review zu medikamenten-induzierten Myoklonien Beispiele zu einer Vielzahl von verursachenden Medikamenten an. Es finden sich Fallberichte zu Anti-Parkinson-Arzneimitteln, Antidepressiva, Antipsychotika, Antiepileptika, Opiaten, Anxiolytika, Anästhetika, Chemotherapeutika, Antibiotika usw. [7].
Wie die Vielfalt der klinischen Symptomatik sowie der auslösenden Arzneimittel erahnen lässt, ist die Frage nach möglichen pathophysiologischen Mechanismen nur unzureichend beantwortet. Jiménez-Jiménez et al. sehen für die Beteiligung des serotonergen sowie GABA-ergen Systems die beste Evidenz [7]. Bei Levodopa-induzierten Myoklonien konnten Klawans et al. mit dem Serontoninantagonisten Methysergid eine Besserung bei allen zwölf behandelten Patienten erreichen. Die Autoren nahmen daher als Ursache der Myoklonien den indirekt vom Dopamin beeinflussten Serotoninstoffwechsel als ursächlich an [8]. In einem weiteren Experiment mit einem Tiermodell konnten sie durch eine Gabe von 5-Hydroxytryptophan und Imipramin Myoklonien zuverlässig auslösen [9]. Weitere Autoren konnten zeigen, dass eine erhöhte wie auch verringerte Serotonin-Transmission Myoklonien auslösen können [7]. Benzodiazepine als Modulatoren des GABA-ergen Systems können selbst Myoklonien auslösen, sind auf der anderen Seite jedoch als Therapie wirksam. Dieses Phänomen wird mit unterschiedlichen Pathomechanismen begründet [13]. Als weitere zumindest interagierende Mechanismen werden Veränderungen in den Transmittersystemen von Glycin, Dopamin, exzitatorischen Aminosäuren und Acetylcholin genannt [7].
Die Polypharmazie und die Änderung der Medikation machen es in diesem Fall schwierig, eine eindeutige Ursache für die Myoklonien auszumachen. Dazu kommt, dass die genauen Mechanismen, die bei verschiedenen Arzneimitteln zu einem Myoklonus führen, nicht im Detail bekannt sind.
Für trizyklische Antidepressiva, zum Beispiel Clomipramin, ist Myoklonus als häufige UAW beschrieben, während er bei dem selektiven Serotonin-Noradrenalin-Wiederaufnahmehemmer Venlafaxin als gelegentliche UAW aufgeführt wird [2, 4]. Myoklonus ist auch als Symptom im Rahmen des Serotoninsyndroms denkbar. Bei diesem Syndrom kommt es durch Anhäufung von Serotonin in Geweben zu vielfältigen Symptomen, die auch neuromuskuläre Symptome umfassen [1]. Im vorliegenden Fall wurden allerdings keine weiteren Symptome des Serotoninsyndroms beobachtet.
Myoklonien wurden als UAW von Antipsychotika, beispielsweise für Clozapin, beschrieben [11]. Es ist daher denkbar, dass auch Risperidon und/oder Pipamperon für die Muskelzuckungen ursächlich waren. Für Risperidon wurden Myoklonien bisher jedoch nur in einem Fall in Kombination mit Venlafaxin beschrieben [4]. Für Pipamperon liegen keine Fallberichte über Myoklonien vor. Da der Patient vor den Myoklonien an vier Tagen in Folge Pipamperon einnahm, ist es aber denkbar, dass dieses zumindest additiv zu den Myoklonien beitragen konnte.
Auffällig ist das zeitgleiche Auftreten der Myoklonien zusammen mit dem Absetzen von Lorazepam. Da Lorazepam muskelrelaxierend wirkt, wäre möglich, dass die Myoklonien erst durch das Absetzen sichtbar wurden oder dass sie als Folge des Absetzens auftraten.
Durch die Polypharmazie ergibt sich eine Vielzahl an möglichen Interaktionen, jedoch ist für keine Arzneimittelkombination eine besonders riskante Interaktion zu erwarten, die Myoklonien erklären könnten [10].
Es gab keine Hinweise für neurodegenerative Erkrankungen oder Epilepsie. Die Alkoholanamnese war unauffällig. Über eventuelle Mangelerscheinungen (z. B. Magnesium, Vitamin B6, Vitamin B12 oder Folat) liegen keine Daten vor. Ebenso wurde der Venlafaxin-Spiegel nicht bestimmt, da man ursprünglich davon ausging, dass Pipamperon für die Myoklonien ursächlich wären. Da die Myoklonien von selbst sistierten, wurden weder EEG noch MRT gemacht. Auf mögliche Belastung durch Schwermetalle wurde ebenfalls nicht getestet.
Insgesamt gehen wir davon aus, dass die Myoklonien eine Folge der Eindosierung von Venlafaxin sind und dass mögliche additive Effekte von Risperidon und/oder Pipamperon einen Einfluss hatten. Des Weiteren wäre denkbar, dass die Myoklonien durch Lorazepam verdeckt wurden oder ein Absetzphänomen von Lorazepam sind. Durch das isolierte Auftreten über wenige Tage und die Beunruhigung des Patienten gehen wir nicht davon aus, dass es sich hier um Einschlafmyoklonien handelte.
Therapeutisch sollte zunächst mit den Patienten eine Einordnung des Symptoms vorgenommen werden. Eine epileptische Genese gilt es auszuschließen. Wenn möglich, kann ein abwartendes Verhalten vereinbart werden. Bei anhaltender Symptomatik oder nicht tolerierbarer Intensität kann eine Reduktion oder Absetzen der verdächtigten Medikation in den meisten Fällen Abhilfe schaffen. Sollten diese Maßnahmen nicht ausreichen, kann die Gabe von Clonazepam, Valproinsäure oder anderen Antiepileptika erwogen werden [3, 7]. Es gilt hierbei zu beachten, dass die empfohlene Medikation selbst Myoklonien auslösen/verstärken kann.
Interessenkonflikterklärung
TG, MS, DD, RG, SB, MH: Keine Interessenkonflikte
ST: Vortragshonorare für Janssen Cilag GmbH, Otsuka/Lundbeck und Servier sowie Advisory Board Otsuka
Literatur
1. Annamalai A. Myoclonus and serotonin syndrome. In: Medical management of psychotropic side effects. Cham: Springer, 2017.
2. Benkert O, Hippius H. Kompendium der psychiatrischen Pharmakotherapie. 11. Auflage. Berlin, Heidelberg: Springer Verlag, 2017.
3. Caviness JN, Truong DD. Myoclonus. In: Handbook of clinical neurology, Vol. 100 (3rd series), Hyperkinetic movement disorders. Weiner WJ, Tolosa E, editors. Elsevier B.V., 2011.
4. Dutra LA, Pedroso JL, Felix EPV, Barsottini OGP. Venlafaxine-induced myoclonus in a patient with mixed dementia. Arq Neuro-Psiquiatr 2008;66:894–95.
5. Garvey MJ, Tollefson GD. Occurrence of myoclonus in patients treated with cyclic antidepressants. Arch Gen Psychiatry 1987;44: 269–72.
6. Grohmann R, Engel RR, Rüther E, Hippius H. The AMSP drug safety program: methods and global results. Pharmacopsychiatry 2004;37(Suppl 1):S4-11.
7. Jiménez-Jiménez FJ, Puertas I, de Toledo-Heras M. Drug-induced myoclonus. CNS Drugs 2004;18:93-104.
8. Klawans HL, Carvey PM, Tanner CM et al. Drug-induced myoclonus. Adv Neurol 1986;43:251-64.
9. Klawans HL, Goetz CG, Weiner WJ. 5-hydroxytryptophane-induced myoclonus in guinea pigs and the possible role of serotonin in infantile spasms. Neurology 1973;23:1234–40.
10. mediQ.chmediQ.ch: Interaktionsdatenbank. https://mediq.ch/welcome_publichttps://mediq.ch/welcome_public (Zugriff am 05.06.2018).
11. Praharaj SK, Babu V, Sarkhel S, Zia-ul-Haq M, Sinha VK. Clozapine-induced myoclonus: A case study and brief review. Prog Neuropsychopharmacol Biol Psychiatry 2010;34:242–3.
12. Sarva H, Panichpisal K. Gentamicin-induced mycoclonus: A case report and literature review of antibiotics-induced mycoclonus. Neurologist 2012;18:385–8.
13. Valin A, Cepeda C, Rey E et al. Opposite effects of lorazepam on two kinds of myoclonus in the photosensitive Papio papio. Electroencephalogr Clin Neurophysiol 1981;52:647–51.
14. Zesiewicz TA, Sullivan KL. Drug-induced hyperkinetic movement disorders by nonneuroleptic agents. In: Handbook of clinical neurology, Vol. 100 (3rd series), Hyperkinetic movement disorders. Weiner WJ, Tolosa E, editors. Elsevier B.V., 2011.
Dr. rer. nat. Timo Greiner, Dr. med. Michael Schneider, Prof. Dr. med. Martin Heinze, Hochschulklinik für Psychiatrie und Psychotherapie, Immanuel Klinik Rüdersdorf, Seebad 82/83, 15562 Rüdersdorf bei Berlin; Medizinische Hochschule Brandenburg, Fehrbelliner Straße 38, 16816 Neuruppin, E-Mail: t.greiner@immanuel.de
Prof. Dr. med. Detlef Degner, Klinik für Psychiatrie und Psychotherapie der Universitätsmedizin Göttingen, Von-Siebold-Straße 5, 37075 Göttingen
Priv.-Doz. Dr. med. Sermin Toto, Prof. Dr. med. Stefan Bleich, Medizinische Hochschule Hannover, Klinik für Psychiatrie, Sozialpsychiatrie und Psychotherapie, Carl-Neuberg-Straße 1, 30625 Hannover
Dr. med. Renate Grohmann, Klinik für Psychiatrie und Psychotherapie, Ludwig-Maximilians-Universität, Nussbaumstraße 7, 80336 München
Psychopharmakotherapie 2018; 25(04):208-210
