Hans-Peter Volz, Werneck, und Walter E. Müller, Worms/Frankfurt a. M.
Grundlagen, allgemeine Pharmakologie
Die ersten Möglichkeiten, Angst- und Spannungszustände zu therapieren, waren niedrig-dosierte Barbiturate und Alkohol (nicht medizinisch) und das aus älteren Carbamat-Hypnotika abgeleitete Meprobamat. Allen diesen Substanzen gemeinsam waren deutliche sedierende Effekte schon im anxiolytischen Dosisbereich, hypnotische Effekte bei höheren Dosierungen gefolgt von Atemdepression und Koma. Daraus abgeleitet entstand die Vorstellung einer engen Beziehung zwischen Sedierung und Anxiolyse. Sie wurde auch auf die die anxiolytische Therapie für viele Jahrzehnte dominierenden Benzodiazepine angewendet, wenngleich die schweren ZNS-depressiven Eigenschaften hier eher fehlen. Gemeinsam war diesen älteren Anxiolytika ein Eingriff in die Neurotransmission des inhibitorischen Neurotransmitters Gamma-Aminobuttersäure (GABA), der in alle ZNS-Funktionen involviert ist. Erst das Anxiolytikum Buspiron (ein Serotonin-1A-Rezeptor-Ligand) und initiale gute therapeutische Effekte einiger Antidepressiva bei Panik- und Zwangserkrankungen (Imipramin, Clomipramin) wiesen den Weg zu den Serotonin-betonten Antidepressiva (SSRI, SSNRI, siehe Teile 1 und 2) als Anxiolytika – Wirkstoffe, die anders als alle GABAergen Substanzen kein Abhängigkeitsrisiko aufweisen und deshalb heute die Therapie von Angst und Spannung beziehungsweise von allen Angsterkrankungen dominieren. Ähnlich wie bei ihrer Anwendung zur Therapie depressiver Störungen zeigen die Antidepressiva auch bei der Anwendung als Anxiolytika eine deutliche Wirklatenz und benötigen gleiche Dosierungen, wenn auch die ausreichenden Dosen der Trizyklika bei Angstpatienten oft noch schwieriger umzusetzen sind als in der Depressionstherapie. Auch bei Angst scheint eine gestörte Neuroplastizität eine wichtige Rolle zu spielen und eine Verbesserung der Neuroplastizität durch Antidepressiva ist analog anzunehmen [10]. Die Tatsache, dass hier eher serotonerge oder duale Antidepressiva wirksam sind, weist auf eine besondere Bedeutung serotonerger Mechanismen in der bei diesen Patienten gestörten Neuroplastizität hin. Diese Mechanismen werden wahrscheinlich durch die Therapie eher stabilisiert als korrigiert, da Angstsymptomatik häufig nicht remittiert, sondern nach Absetzen der Therapie wieder auftritt und eine Fortsetzung der Therapie benötigt.
Benzodiazepine, herausragende Anxiolytika mit Problemen in der Langzeittherapie
Die Ära der Benzodiazepine begann in den 60er-Jahren des letzten Jahrhunderts mit der Einführung von Chlordiazepoxid und Diazepam (beide wirken zumindest nach Mehrfach-Dosierung über den gleichen aktiven Metaboliten Desmethyldiazepam). Die Benzodiazepine haben aufgrund der hervorragenden akuten anxiolytischen Wirkung bei vergleichsweise sehr günstigem Nebenwirkungsspektrum die Therapie mit Anxiolytika über viele Jahrzehnte dominiert. Mit der Erkenntnis, dass, entgegen ursprünglichen Einschätzungen, auch diese Substanzen zu einer Abhängigkeit führen können, und aufgrund des besonderen Risikos von Angstpatienten für eine Langzeittherapie als wesentlichem Risikofaktor einer Abhängigkeitsentwicklung wurde der Einsatz von Benzodiazepinen in der Behandlung von Angsterkrankungen in den letzten Jahren erheblich reduziert. In der Behandlung schwerer Angstzustände besonders in der Akuttherapie sind sie aber weiterhin unverzichtbar.
Benzodiazepine werden gerne als „Bremskraftverstärker“ bezeichnet, weil sie die Wirkung von GABA, des wichtigsten inhibitorischen Neurotransmitters in unserem Gehirn, verstärken. Über die Interaktion mit einer spezifischen Bindungsstelle (auch nicht ganz korrekt Benzodiazepin-Rezeptor genannt) am GABA-A-Rezeptorkomplex wird der damit verbundene Chlorid-Ionenkanal häufiger geöffnet, was zu einer verstärkten Hyperpolarisation der neuronalen Membran führt (Abb. 3–1).
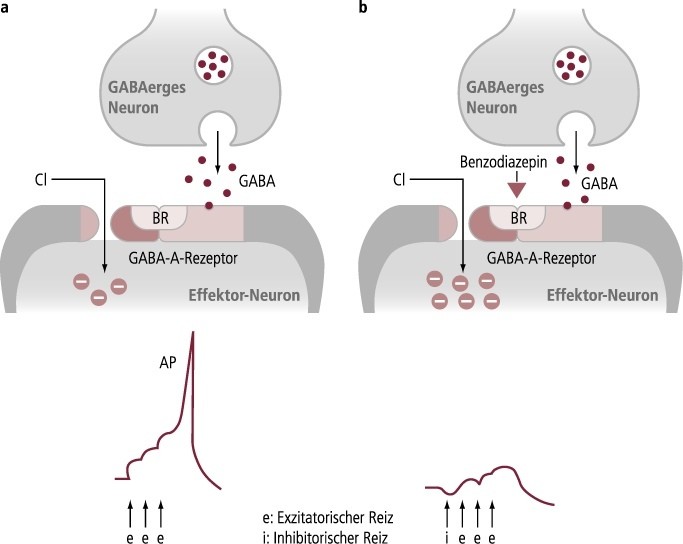
Abb. 3–1. Wirkungsmechanismus der Benzodiazepine. a) Unter physiologischen Bedingungen bewirkt GABA durch Wechselwirkung mit dem GABA-A-Rezeptor einen Chlorid-Einstrom und dadurch eine Hyperpolarisation der postsynaptischen Membran des Effektor-Neurons. Die exzitatorische Wirkung exzitatorischer Reize wird gehemmt, ab einer gewissen Reizdichte wird diese Hemmung aber durchbrochen und ein Aktionspotenzial (AP) ausgelöst. b) Benzodiazepine bewirken durch Angriff am „Benzodiazepin-Rezeptor“ (BR), einer spezifischen Bindungsstelle am GABA-A-Rezeptorkomplex, dass der Chlorid-Einstrom und damit die Hyperpolarisation verstärkt wird. Das postsynaptische Effektor-Neuron ist infolgedessen weniger leicht erregbar.
Die damit verbundene deutliche, aber maximal begrenzte vermehrte neuronale Inhibition findet im gesamten ZNS statt und führt zu verschiedenen pharmakologischen Eigenschaften der Benzodiazepine und den daraus abzuleitenden therapeutischen Einsatzmöglichkeiten; je nach Einsatzgebiet stellen diese Eigenschaften auch die wichtigsten unerwünschten Arzneimittelwirkungen (UAW) dar.
- Anxiolyse und Stress-Abschirmung: Angst- und Spannungszustände
- Antikonvulsion: Krampfzustände und einige Epilepsien
- Sedierung: Schlafstörungen, Prämedikation
- Anterograde Amnesie: Prämedikation
- Zentral ausgelöste Muskelrelaxation: Muskelverspannungen
Diese Effekte treten bei zunehmender Dosis und damit verbundener zunehmender Rezeptorokkupation auf (beginnend mit Anxiolyse). Die Frage, ob sich die vielen heute zur Verfügung stehenden Benzodiazepine im Hinblick auf diese Eigenschaften und deren Abhängigkeit von der Dosis unterscheiden, ist schon immer von Pharmakologen und Klinikern unterschiedlich gesehen worden. Im pharmakologischen Experiment sind die Dosisunterschiede für die einzelnen Wirkungsqualitäten bei allen Benzodiazepinen eher gleich, wie auch die für diese Effekte benötigten Rezeptorokkupationen. Die absoluten Dosen sind natürlich unterschiedlich, was sich in der Therapie in den für die einzelnen Substanzen benötigten therapeutischen Dosen widerspiegelt. In der Klinik sieht man durchaus bei den für die Therapie am Patienten empfohlenen Dosen unterschiedliche Effekte (z.B. im Hinblick auf Sedierung als UAW bei der Anwendung als Anxiolytikum). Dies lässt sich über Unterschiede in der Pharmakokinetik erklären (unterschiedlich schnelle Resorption und Anflutung im ZNS) sowie darüber, dass die für die einzelnen Substanzen empfohlenen Dosen nicht immer im Hinblick auf die Rezeptorokkupation wirkungsäquivalent sind. Ein Beispiel für den Einfluss der Pharmakokinetik wäre die deutlichere Sedierung bei schnell bioverfügbarem Lorazepam (Tavor® Expidet®) als bei der gleichen oralen Dosis mit einer Lorazepam-Tablette.
Der GABA-A-Rezeptorkomplex besteht aus mehreren Untereinheiten, die jeweils noch in mehreren unterschiedlichen Allelen vorliegen, sodass eine große Anzahl unterschiedlicher GABA-A-Rezeptoren möglich und zum Teil auch nachgewiesen ist. Die Hoffnung, über eine spezifischere Interaktion mit einer dieser Unterklassen Anxiolytika zu finden, die wesentliche Vorteile gegenüber den Benzodiazepinen aufweisen (z.B. weniger Sedierung) hat sich bis heute allerdings nicht bestätigt (siehe auch „Pharmakologie der Hypnotika“ in Folge 4).
Sehr deutliche Unterschiede sieht man bei den einzelnen Benzodiazepinen im Hinblick auf die Pharmakokinetik, wie die Geschwindigkeit der Resorption und der Anflutung im ZNS, auf die Eliminationshalbwertszeit und das Vorhandensein von wirksamen Metaboliten, die zum Teil sehr langsam eliminiert werden, sodass die biologische Halbwertszeit des ursprünglichen Präparats wesentlich länger sein kann als die pharmakokinetische Halbwertszeit (z.B. Diazepam). Da diese Aspekte der Pharmakologie der Benzodiazepine besonders bei der Anwendung als Schlafmittel eine Rolle spielen, wird die Pharmakokinetik der Benzodiazepine ausführlich im Teil „Pharmakologie der Hypnotika“ (Folge 4) besprochen.
Im Gegensatz zur verhaltenspharmakologischen Testung der Antidepressiva im Tierversuch gibt es für die Anxiolytika eine Reihe von Modellen, in denen anxiolytische Effekte bei experimentell ausgelöster Angst an Versuchstieren untersucht werden können. Allen diesen Tests gemeinsam ist, dass ein Angst-induziertes Verhalten, beispielsweise in einer neuen Umgebung, bei einem Konflikt zwischen Futteraufnahme und einer damit verbundenen Angst-auslösenden Situation oder bei Frustration nach fehlender Belohnung in einer sonst belohnenden Situation, durch die Benzodiazepine reduziert wird, wobei aber die Angst eher als real bezeichnet werden muss und damit nicht vergleichbar ist mit den häufig nicht realen Ängsten der Patienten. Auch die anderen pharmakologischen Eigenschaften der Benzodiazepine wie Schlafinduktion, zentrale Muskelrelaxation und Antikonvulsion können recht zuverlässig in Tierexperimenten abgebildet werden.
Neben Antidepressiva und Benzodiazepinen spielen noch einige andere Substanzen eine Rolle in der Behandlung von Angsterkrankungen. Opipramol gehört chemisch zu den Trizyklika, ist aber kein Wiederaufnahmehemmer, sondern wird bei Angststörungen und bei Angst- und Depression-Mischzuständen eingesetzt (zugelassen nur für generaliserte Angststörung und somatoforme Störungen). Es gehört seit mehreren Jahrzehnten zu den am meisten verordneten Psychopharmaka in Deutschland. Die Substanz ist ein Antagonist an H1-, 5-HT2- und D2-Rezeptoren, besonders aber zusätzlich an Sigma-1- und Sigma-2-Rezeptoren [11].
Das Antihistaminikum Hydroxyzin (H1-Antagonist) hat wie andere Substanzen dieser Klasse schwache anticholinerge, antiadrenerge, and antiserotonerge Eigenschaften. Darüber hinaus bindet Hydroxyzin aber auch deutlich an den Sigma-1-Rezeptor in vitro und in vivo, wobei möglicherweise eine Metabolit eine große Rolle spielt [11].
Das Antiepileptikum Pregabalin ist u.a. zur Therapie der generalisierten Angststörung zugelassen. Es wirkt über eine Hemmung präsynaptischer Calcium-Kanäle durch eine Bindung an eine regulatorische Untereinheit.
Auch Silexan® (ein standardisiertes Lavendelöl) hemmt präsynaptische Calcium-Kanäle in sehr niedrigen therapeutischen Konzentrationen. Ein entsprechendes Kapselpräparat ist zur Therapie subsyndromaler Ängste im OTC-Bereich zugelassen. Für alle anderen in dieser Indikation mit hohem Werbeaufwand im OTC-Bereich verkauften Präparate (pflanzlich, homöopathisch) gibt es keine klinischen Wirksamkeitsbelege.
Klinische Psychopharmakotherapie
Einzelne Substanzen
Benzodiazepine
Benzodiazepine weisen bei der Therapie der Angststörungen, insbesondere der Panikstörung (gerade auch bei der Akuttherapie der Panikattacke) und der generalisierten Angststörung (GAS), eine den anderen hier anxiolytisch eingesetzten Medikamenten (z.B. Antidepressiva) mindestens ebenbürtige Wirksamkeit auf, wobei insbesondere der frühe Wirkungseintritt hervorzuheben ist.
Die Benzodiazepine werden auch als Sedativa, Hypnotika und Muskelrelaxanzien eingesetzt. Tabelle 3–1 fasst die am häufigsten als Anxiolytika verwendeten Benzodiazepine mit ihren pharmakokinetischen Kernparametern zusammen.
Tab. 3–1. Die wichtigsten in der Anxiolyse verwendeten Benzodiazepine mit ihrer Halbwertszeit und dem Dosisbereich (mod. und ergänzt nach [2])
|
Substanz |
HWZ [h] |
Pharmakodynamisch aktiver Hauptmetabolit (HWZ [h]) |
Dosis [mg], in Klammern Maximaldosis |
|
Diazepam |
24–48 |
N-Desmethyldiazepam (36–200) |
5–10 (30) |
|
Alprazolam |
6–37 |
α-Hydroxyalprazolam (12–15) |
0,5–1,5 (4) |
|
Lorazepam |
12–16 |
– |
0,5–2,5 (7,5) |
|
Oxazepam |
4–15 |
– |
25–75 (150) |
Der anxiolytische Effekt tritt in der Regel rasch ein, wobei auch immer die anderen durch den Wirkungsmechanismus bedingten Wirkungen wie Muskelrelaxation und Sedierung auftreten können. Die therapeutische Breite dieser Substanzen ist hoch. Es sollte immer die niedrigste noch ausreichende Dosis gewählt werden und bevorzugt sollten Substanzen eingesetzt werden, die keinen pharmakodynamisch aktiven Metaboliten mit einer langen Halbwertszeit haben (z.B. Lorazepam, Alprazolam). Die niedrigst mögliche Dosis sollte nicht nur gewählt werden, um Nebenwirkungen möglichst zu vermeiden, sondern auch, um das Risiko der Entwicklung einer Abhängigkeit/Niedrigdosisabhängigkeit (low-dose dependency) gering zu halten. Das Risiko für die Entwicklung einer solchen Abhängigkeit scheint bei Benzodiazepinen mit einer kurzen Halbwertszeit höher zu sein als bei Benzodiazepinen mit einer längeren Halbwertszeit.
Benzodiazepine haben zum Teil gravierende Nebenwirkungen, wie Veränderungen der Reaktionszeit, Koordinationsstörungen mit Sturzgefahr, kognitiv-amnestische Störungen oder die Gefahr einer physischen und psychischen Abhängigkeitsentwicklung. Daher ist die aufklärende und beratende Begleitung des Patienten von besonderer Bedeutung [13] (siehe auch Tab. 3–2).
Tab. 3–2. Häufige Nebenwirkungen von Benzodiazepinen (mod. nach [2])
|
Häufige Nebenwirkungen Sedierung, Tagesmüdigkeit, Schläfrigkeit, Beeinträchtigung der Aufmerksamkeit und des Reaktionsvermögens, Muskelschwäche, Mattigkeit, Ataxie, Verwirrtheit, Depression, Demaskierung einer Depression, Schwindelgefühl. |
|
Besonders zu beachten: |
|
|
|
|
|
|
|
|
|
|
Eine weitere Besonderheit dieser Substanzgruppe ist die altersabhängige Häufung paradoxer Reaktionen, die sich durch Agitiertheit ausdrücken, in der Kindheit und im Senium. Aufgrund der zentral muskelrelaxierenden Wirkung dürfen Benzodiazepine nicht bei Myasthenia gravis und aufgrund der atemdepressiven Wirkung nicht bei akuter respiratorischer Insuffizienz oder in Verbindung mit anderen atemdepressiven Medikamenten verwendet werden. Weitere Anwendungsbeschränkungen ergeben sich für den Einsatz im ersten Trimenon aufgrund einer (fraglich) erhöhten Inzidenz von Lippen-Kiefer-Gaumen-Spalten sowie pränatal mit der Gefahr eines Floppy-Infant-Syndroms (Muskelschwäche mit Atemdepression, Hypothermie und Trinkschwäche) bei dem Neugeborenen. Während der Stillzeit sollte der Einsatz von Benzodiazepinen ebenfalls vermieden werden. Aufgrund einer möglichen Gewöhnung, Toleranzentwicklung und der Gefahr einer Abhängigkeit sollten Patienten mit einem Abusus- und Abhängigkeitsrisiko im Rahmen von Angststörungen nicht mit Benzodiazepinen behandelt werden. Aus diesem Grund ist auch die Behandlungsdauer mit einer abschließenden Ausschleichphase restriktiv zu handhaben (Tab. 3–2).
Pregabalin
Pregabalin ist ein Modulator spannungsabhängiger, präsynaptischer Calcium-Kanäle (greift an der α2δ-Subeinheit an) und besitzt eine Zulassung für die Therapie peripherer und zentraler neuropathischer Schmerzen, als Zusatzmedikation (add-on) bei partiellen epileptischen Anfällen und für die Therapie der GAS. Der Wirkungseintritt von Pregabalin scheint etwas schneller zu sein als bei den Antidepressiva, wobei das Ausmaß des Effekts insgesamt wohl etwas stärker ausgeprägt ist, wie eine Metaanalyse nahelegt [6]. Die Wirksamkeit ist ähnlich jener der Benzodiazepine bei besserer Verträglichkeit [5].
Pregabalin sollte einschleichend (Hauptdosis abends, Gesamtdosis auf zwei bis drei Tagesdosen verteilt) dosiert werden (z.B. beginnend mit 25 mg); bei der GAS sind Dosen bis zu 600 mg/Tag zugelassen, wobei häufig geringere Dosen ausreichend sind.
Zu beachten ist, dass Pregabalin keinem hepatischen Metabolismus unterliegt, also auch keine Interaktionen mit anderen Medikamenten über hepatische CYP450-Isoenzyme auftreten können, und nahezu unverändert renal eliminiert wird. Dies bedingt allerdings eine Senkung der Dosis bei ausgeprägteren Formen der renalen Insuffizienz. Pregabalin wird nicht an Plasmaeiweiße gebunden.
An Nebenwirkungen (dosisabhängig) sind, besonders zu Anfang der Behandlung, Schläfrigkeit und Benommenheit zu nennen, daneben Schwindel, Gedächtnisstörungen, Euphorie, Reizbarkeit, Verwirrung, Tremor, Gangstörungen, verschwommenes Sehen, Gewichtszunahme, mitunter können auch QTc-Zeit-Verlängerungen auftreten (Vorsicht bei Kombination mit anderen die QTc-Zeit verlängernden Pharmaka, beispielsweise bestimmten Antipsychotika oder bestimmen Antidepressiva). In den letzten Jahren wurden immer wieder Fälle eines nicht bestimmungsgemäßen Gebrauchs von Pregabalin bei drogenabhängigen (v.a. Opiat-abhängigen) Patienten berichtet, die zum Teil sehr hohe Dosen von Pregabalin einnahmen. Daher ist bei Verordnung von Pregabalin bei dieser Patientengruppe erhöhte Vorsicht geboten.
Antidepressiva
Antidepressiva werden in den Indikationen GAS, Panikstörung und soziale Angststörung als Anxiolytika eingesetzt, wobei der Zulassungsstatus für die einzelnen Substanzen durchaus Unterschiede aufweist. Zumeist handelt es sich um serotonerge Substanzen, entweder um selektive Serotonin-Reuptake-Inhibitoren (SSRI, z.B. Escitalopram) oder um selektive Serotonin- und Noradrenalin-Reuptake-Inhibitoren (SSNRI, z.B. Venlafaxin). Welche Substanzen für welche Indikationen eine Zulassung besitzen, wird im Kapitel zur Therapie spezieller Angststörungen behandelt. Die Wirkungsweise und allgemeine Verordnungsrichtlinien zu dieser Substanzgruppe sind unter Teil 2 dieser Fortbildungsserie bereits abgehandelt worden.
Der Wirkungseintritt der Antidepressiva ist verzögert, bei den serotonergen Substanzen (SSRI) können vor allem die typischen serotonergen Nebenwirkungen in Erscheinung treten (gastrointestinale Nebenwirkungen, Unruhe, sexuelle Dysfunktionen), bei den SSNRI können – dosisabhängig – typische noradrenerge Nebenwirkungen hinzutreten, wie Blutdruckerhöhung, Palpitationen, trockener Mund, Schwitzen sowie Obstipation.
Lavendelöl
Bei Lavendelöl ist die Besonderheit aller Phytopharmaka zu beachten, dass sie ein Gemisch aus zahlreichen Inhaltsstoffen sind; die Hauptkomponenten von Lavendelöl-Extrakt sind Linalylacetat und Linalool.
Lavendelölextrakt (Silexan®, Lasea®) wirkt an spannungsabhängigen, präsynaptischen Calcium-Kanälen (allerdings an anderen Bindungsstellen als Pregabalin; [12]) und hat in einer Reihe von Untersuchungen eine Placebo überlegene und Paroxetin (20 mg/Tag) vergleichbare Wirksamkeit bei subsyndromalen Angststörungen und bei der GAS gezeigt [7]. Außer Aufstoßen treten kaum Nebenwirkungen auf, zudem zeigt der Extrakt ein günstiges Interaktionspotenzial [4]. Die Tagesdosis von 80 mg wird in der Regel einmalig morgens gegeben. Der Extrakt ist frei über die Apotheke verkäuflich, die zugelassene Indikation lautet „zur Behandlung von Unruhezuständen bei ängstlicher Verstimmung“.
Opipramol
Opipramol ist ein trizyklisches Piperazin-Derivat, das seine sedierende Hauptwirkung über die Blockade von H1-Histaminrezeptoren entfaltet, daneben interagiert die Substanz mit Sigmarezeptoren (v.a. Sigma-1-Rezeptoren), die unter anderem eine Rolle bei Stimmungsschwankungen und Gedächtnisprozessen spielen. Opipramol ist zwar den trizyklischen Antidepressiva strukturverwandt, wirkt aber nicht als Wiederaufnahmehemmer biogener Amine.
Das Indikationsgebiet umfasst neben der GAS die somatoforme Störung. Die Dosis beträgt 50 bis 200 mg, verteilt auf zwei Dosen (Hauptdosis abends).
Häufige Nebenwirkungen der Substanz sind Müdigkeit, Mundtrockenheit, orthostatische Dysregulation sowie (etwas seltener) Schwindel, Benommenheit und Obstipation. Die Substanz weist keine Absetzphänomene und kein Abhängigkeitsrisiko auf.
Hydroxyzin
Antihistaminika (z.B. Hydroxyzin) haben aufgrund der Blockade von H1-Histaminrezeptoren sedierende und spannungslösende Eigenschaften, welche das Hyperarousal bei Angststörungen reduzieren können. Daneben wirkt Hydroxyzin adrenolytisch und anticholinerg und hat eine deutliche Sigmaaffinität, ähnlich Opipramol. Die Substanz ist für die symptomatische Behandlung von Angstzuständen zugelassen. Aufgrund der schnellen Toleranzentwicklung und eher unspezifischen Wirkung ist Hydroxyzin ein Anxiolytikum der zweiten Wahl. Die Dosierung beträgt in der Regel 50 mg/Tag auf drei Einzeldosen (Hauptdosis abends) verteilt. Die Dosis kann kurzzeitig auf bis zu 300 mg/Tag erhöht werden.
Die hauptsächlichen Nebenwirkungen bestehen in Schwindel, Benommenheit, Konzentrationsstörungen, verlängerter Reaktionszeit, Unruhe- und Angstzuständen. Auch typische anticholinerge Nebenwirkungen (cave bei Engwinkelglaukom sowie Blasenentleerungsstörungen) können auftreten.
Buspiron
Buspiron ist ein Azapiron und zur symptomatischen Behandlung von Angstzuständen mit den Leitsymptomen Angst, innere Unruhe und Spannungszuständen zugelassen. Die Substanz weist einen interessanten Wirkungsmechanismus auf: Es wirkt als reiner Agonist an präsynaptischen 5-HT1A-Rezeptoren (was zu einer Hemmung der Ausschüttung von Serotonin führt) und als partieller Agonist an postsynaptischen 5-HT1A-Rezeptoren, wirkt dort also direkt serotonerg. Der Metabolit 1-[2-Pyrimidinyl]-Piperazin (1-PP) wirkt als Alpha-2-Antagonist, was über Wirkungen am noradrenergen System mit stimulierenden und antidepressiven Wirkungen der Substanz assoziiert sein könnte [2].
Die Dosis beträgt 15 bis 30 mg/Tag (maximal 60 mg/Tag) auf drei Tagesdosen verteilt, es sollte mit 5 mg morgens einschleichend begonnen werden. Die Substanz sediert nicht und ist nicht zur Überbrückung von Benzodiazepin-Absetzsymptomen geeignet.
Häufige Nebenwirkungen bestehen unter anderem in unspezifischen Brustschmerzen, Nervosität, Erregung, Albträumen, Schläfrigkeit, Muskelschmerzen, Schwitzen sowie feuchten Händen.
Pharmakotherapie einzelner Angststörungen
Angsterkrankungen können eingeteilt werden in
- situationsgebundene Angststörungen (Agoraphobie ohne/mit Panikstörung),
- soziale Phobie (auch zunehmend als soziale Angststörung bezeichnet),
- spezifische Phobien (z.B. Klaustrophobie, Höhenangst, Tierphobien) sowie
- nicht situationsgebundene Angststörungen (Panikstörung, GAS).
Zugelassene Pharmakotherapien existieren für die Panikstörung, die GAS, die Agoraphobie mit Panikstörung sowie die soziale Phobie. Im Folgenden wird die Pharmakotherapie für diese einzelnen Störungen dargestellt. Für einen Überblick siehe Tabelle 3–3.
Tab. 3–3. Anxiolytika im Überblick
|
Substanzklasse/Substanz |
Panikstörung |
GAS |
Soziale Phobie |
Dosis [mg/Tag] |
t½ [h] |
Pharmakodynamisch aktiver Metabolit (t½ [h]) |
|
Selektive Serotonin-Reuptake-Inhibitoren (SSRI) |
||||||
|
X |
20–40 |
33 |
– |
||
|
X |
X |
X |
10–20 |
30 |
– |
|
X |
X |
20–60 |
16 |
– |
|
|
X |
X |
50–200 |
26 |
– |
|
|
Selektive Serotonin- und Noradrenalin- |
||||||
|
X |
30–60 |
9–19 |
– |
||
|
X |
X |
X |
75–225 |
14–18 |
+ (?) |
|
Reversibler und selektiver Hemmer |
||||||
|
X |
300–600 |
2–7 |
– |
||
|
Trizyklische Antidepressiva (TZA) |
||||||
|
X |
100–150 |
16–60 |
+ (36) |
||
|
Azapiron |
||||||
|
X |
10–30 |
2–3 |
+ (6) |
||
|
Sigma-Ligand |
||||||
|
X |
100–200 |
11 |
– |
||
|
Antihistaminikum |
||||||
|
X |
37,5–75,0 |
7–20 |
+ (7–10) |
||
|
Benzodiazepine |
||||||
|
X |
X |
0,5–1,5 |
6–37 |
+ (12–15) |
|
|
X |
X |
0,5–2,5 |
12–16 |
– |
|
GAS: generalisierte Angststörung; X =zugelassen in dieser Indikation oder in einem vergleichbaren Syndrom; bei der Rubrik „pharmakodynamisch aktiver Metabolit“ wurde + dann vergeben, wenn ein solcher in klinisch relevantem Ausmaß entsteht (t1/2=Plasmahalbwertszeit). Lavendelöl ist hier nicht berücksichtigt, da es keine Zulassung für Angststörungen besitzt, wenngleich positive Studien für GAS vorliegen.
Agoraphobie mit Panikstörung
Für die isolierte Agoraphobie existieren keine medikamentösen Strategien mit nachgewiesener Wirksamkeit. Für die Agoraphobie mit Panikstörung gelten dieselben pharmakotherapeutischen Prinzipien wie bei der Behandlung der Panikstörung, aus diesem Grunde wird auf die Ausführungen dort verwiesen.
Soziale Phobie
Für die soziale Phobie kommen in erster Linie Behandlungsansätze mit einem SSRI (Paroxetin und Escitalopram), einem SSNRI (Venlafaxin) oder mit einem reversiblen und selektiven Hemmer der Monoaminoxidase A (RIMA: Moclobemid) infrage, wobei die Datenlage für Moclobemid nicht so überzeugend ist wie für die SSRI und SSNRI. Hierbei handelt es sich allesamt um Antidepressiva. Die SSRI und auch das SSNRI verursachen, besonders in der Initialphase, bei einem Teil der Patienten ein Nebenwirkungscluster bestehend aus gastrointestinalen Nebenwirkungen (Magendrücken, „-grummeln“, Übelkeit, selten Erbrechen) sowie einer gewissen Unruhe, Nervosität. Insbesondere wenn die Patienten vorher nicht über diese möglichen Nebenwirkungen aufgeklärt worden sind (eine generelle Problematik bei der Pharmakotherapie aller Angststörungen), können diese initialen Nebenwirkungen vom Betroffenen als eine Zunahme der Angstsymptomatik missinterpretiert werden, was Compliance-Probleme nach sich ziehen kann.
Die Behandlung sollte langfristig, über Jahre (auch dies ist eine für alle Angststörungen gültige Regel) angelegt werden. Sind dann die Symptome zufriedenstellend stabil kontrolliert, kann ein vorsichtiger, schrittweiser Reduktions- und dann Absetzversuch über mehrere Monate unternommen werden.
Panikstörung
In dieser Indikation wurde das Benzodiazepin Alprazolam (Zulassungsindikation: symptomatische Behandlung von Angststörungen) sehr gut untersucht. Unter der Dosierung von 0,75 bis 1,5 mg/Tag (die in der Fachinformation empfohlen werden; im Rahmen von klinischen Studien wurden auch deutlich höhere Dosen verwendet) bessert sich die Symptomatik häufig innerhalb von wenigen Tagen. Eine andere Möglichkeit besteht in der Gabe von Lorazepam (Zulassungsindikation: symptomatische Kurzzeitbehandlung von Angst-, Spannungs- und Erregungszuständen sowie dadurch bedingte Schlafstörungen) in einer Dosis von 0,5 bis 2,5 mg/Tag, verteilt auf zwei bis drei Einzeldosen.
Um die Gefahr einer möglichen Abhängigkeitsentwicklung möglichst klein zu halten, sind bestimmte Verordnungsmodalitäten, wie nur kurze Behandlungsdauer und Ausschluss von Patienten mit erhöhtem Abhängigkeitspotenzial, einzuhalten (s.o.).
Bei leichteren Panikstörungen empfiehlt sich die langsam einschleichende Monotherapie mit einem Antidepressivum (in der Regel nicht das trizyklische Antidepressivum Clomipramin, das auch eine Zulassung für die Pharmakotherapie der Angststörungen besitzt). Bei schwereren Panikstörungen mit der Notwendigkeit einer raschen Symptomlinderung oder bei deutlichen initialen serotonergen Nebenwirkungen kann mit einem Benzodiazepin, beispielsweise Alprazolam, 0,75 bis 1,5 mg/Tag oder Lorazepam (0,5 bis 2,5 mg/Tag), komediziert werden.
Zu der Frage, wie lange eine Pharmakotherapie bei einer Panikstörung durchgeführt werden sollte, liegen nur wenige Daten vor. Falls es sich um eine leichte Form der Panikstörung handelt (weniger als vier Attacken pro vier Wochen), kann nach etwa einem Jahr ein vorsichtiger Reduktions- und dann Absetzversuch durchgeführt werden. Bei einer schweren Ausprägung der Störung (mehr als zehn Attacken/vier Wochen) sollte die Therapie in ausreichend hoher Dosis (hierbei handelt es sich in der Regel um die Dosis, die im Akutstadium der Behandlung zu einer Symptomverminderung geführt hat) über Jahre hinaus durchgeführt werden.
Generalisierte Angststörung (GAS)
Als Medikamente der ersten Wahl zur Behandlung der GAS gelten die Antidepressiva (SSRI, SSNRI, Anwendungregeln s.o.). Daneben kann, vor allem wenn typische serotonerge Nebenwirkungen bekannt sind oder bei Einsatz eines SSRI bzw. SSNRI antizipiert werden oder ein eher sedierender Therapieansatz gewünscht wird, Pregabalin eingesetzt werden. Des Weiteren liegen gute Evidenzen für die Wirksamkeit der Benzodiazepine (Diazepam und Alprazolam) sowie für das Azapiron Buspiron vor. Eine weitere Möglichkeit besteht in der Gabe von Opipramol, wobei hier nur eine randomisierte, Placebo-kontrollierte Studie vorliegt [9]. Hydroxyzin ist als Möglichkeit der zweiten Wahl zu erwägen.
Therapieresistenz
Belastbare Untersuchungen zu dem Vorgehen bei Therapieresistenz liegen nicht vor. In der Regel wird man – in Analogie zu dem Vorgehen bei der therapieresistenter Depression – nach der Ersttherapie ein Anxiolytikum mit einem anderen Wirkungsmechanismus wählen, dann zwei Anxiolytika mit unterschiedlichen Wirkungsmechanismen kombinieren. Mitunter wird auch die dauerhafte zusätzliche Gabe eines Benzodiazepins nicht zu umgehen sei. Hier ergeben sich bei der Pharmakotherapie der GAS angesichts der vielfältigen zugelassenen Pharmaka die meisten Wechsel- und Kombinationsmöglichkeiten.
Gute Studiendaten liegen zudem für das melatonerge Antidepressivum Agomelatin [3] sowie für das atypische Antipsychotikum Quetiapin [8] zur Therapie der GAS vor, sodass diese beiden Präparate als Ersatzpräparate im Off-Label-Gebrauch betrachtet werden können.
Interessenkonflikterklärung
WEM: Beratungstätigkeit für Schwabe Arzneimittel
HPV: Beraterhonorare von Lundbeck, Pfizer, Dr. Willmar Schwabe, Bayer Vital, Janssen-Cilag, neuraxpharm und Recordati; Vortragshonorare von Lundbeck, AstraZeneca, Pfizer, Dr. Willmar Schwabe, Bayer Vital, Janssen-Cilag, Servier Deutschland, neuraxpharm und Recordati; Aktien von Novartis
Literatur
1. Bandelow B, Zohar J, Hollander E, Kasper S, et al.; WFSBP Task Force on Treatment Guidelines for Anxiety, Obsessive-Compulsive and Post-Traumatic Stress Disoders. World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for the pharmacological treatment of anxiety, obsessive-compulsive and post-traumatic stress disorders – first revision. World J Biol Psychiatry 2008;9:248–312.
2. Benkert O, Hippius H. Kompendium der Psychiatrischen Pharmakotherapie. 9. Auflage. Berlin: Springer, 2013.
3. Buoli M, Grassi S, Serati M, Altamura AC. Agomelatine for the treatment of generalized anxiety disorder. Expert Opin Pharmacother 2017;18:1373–9.
4. Doroshyenko O, Rokitta D, Zadoyan G, Klement S, et al. Drug cocktail interaction study on the effect of the orally administered lavender oil preparation silexan on cytochrome P450 enzymes in healthy volunteers. Drug Metab Dispos 2013;41:987–93.
5. Generoso MB, Trevizol AP, Kasper S, Cho HJ, et al. Pregabalin for generalized anxiety disorder: an updated systematic review and meta-analysis. Int Clin Psychopharmacol 2017;32:49–55.
6. Hidalgo RB, Tupler LA, Davidson JR. An effect-size analysis of pharmacologic treatments for generalized anxiety disorder. J Psychopharmacol 2007;21:864–72.
7. Kasper S, Müller WE, Volz HP, Möller HJ, et al. Silexan in anxiety disorders: Clinical data and pharmacological background. World J Biol Psychiatry 2017;19:1–9.
8. Maneeton N, Maneeton B, Woottiluk P, Likhitsathian S, et al. Quetiapine monotherapy in acute treatment of generalized anxiety disorder: a systematic review and meta-analysis of randomized controlled trials. Drug Des Devel Ther 2016;10:259–76.
9. Möller HJ, Volz HP, Reimann IW, Stoll KD. Opipramol for the treatment of generalized anxiety disorder: a placebo-controlled trial including an alprazolam-treated group. J Clin Psychopharmacol 2001;21:59–65.
10. Müller WE. Normalisierung gestörter Neuroplastizitätsmechanismen als gemeinsame Endstrecke im Wirkungsmechanismus von Antidepressiva. Psychopharmakotherapie 2016;23:230–8.
11. Müller et al. Pharmacopsychiatry 2003;37 (Suppl 3):189–97.
12. Schuwald AM, Nöldner M, Wilmes T, Klugbauer N, et al. Lavender oil-potent anxiolytic properties via modulating voltage dependent calcium channels. PLoS One 2013;29:e59998.
13. Volz HP, Kasper S, Möller HJ. Psychopharmakotherapie – klinisch-empirische Grundlagen. In: Möller HJ, Laux G, Kapfhammer HP (Hrsg.): Psychatrie, Psychosomatik, Psychotherapie. Band 2. 5. Aufl. Berlin: Springer, 2017:795–842.
Prof. Dr. Hans-Peter Volz, Krankenhaus für Psychiatrie, Psychotherapie und Psychosomatische Medizin Schloss Werneck, Balthasar-Neumann-Platz 1, 97440 Werneck, E-Mail: hans-peter.volz@kh-schloss-werneck.de
Prof. Dr. Walter E. Müller, Höhenstraße 49A, 67550 Worms, E-Mail: w.e.mueller@em.uni-frankfurt.de
Psychopharmakotherapie 2018; 25(02):69-75
