Jürgen Fritze, Frankfurt a.M., Claudia Riedel, Angelika Escherich, Peggy Beinlich, Karl Broich und Thomas Sudhop, Bonn
In diesem Journal wurden bereits die Ergebnisse zum Off-Label-Use von Thrombozytenaggregationshemmern, Psychostimulanzien, Antidementiva und Antidepressiva präsentiert [5–9]. Die Hintergründe dieses Projekts wurden im Beitrag zu Thrombozytenaggregationshemmern [9] detailliert dargestellt und werden deshalb nur zusammengefasst: Der von der Bundesregierung akzeptierte „Nationale Aktionsplan für Menschen mit Seltenen Erkrankungen“ des Nationalen Aktionsbündnisses für Menschen mit Seltenen Erkrankungen (NAMSE) empfiehlt unter anderem, eine „Studie zur Erfassung des Umfangs des Off-Label-Use bei Seltenen Krankheiten anhand der Daten nach §303aff. SGB V […]“ durchzuführen. Darüber hinaus zielt das Projekt darauf, dem Gemeinsamen Bundesausschuss (G-BA) Informationen über Art und Häufigkeit von Off-Label-Use zumindest der am häufigsten verordneten Wirkstoffe für das Verfahren gemäß §35c Abs. 1 Sozialgesetzbuch V (SGB V) zu liefern.
Untersuchte Arzneimittel
Die 25 in Deutschland am häufigsten zulasten der gesetzlichen Krankenversicherung verordneten Neuroleptika (nach moderner Nomenklatur Antipsychotika) sowie Lithium wurden untersucht. Die Anwendungsgebiete der verschiedenen Neuroleptika unterscheiden sich – bei einigen auch zwischen verschiedenen Fertigarzneimitteln mit demselben Wirkstoff. Angesichts des Umfangs muss zu Details auf die Fachinformationen verwiesen werden. Insbesondere die schwach- bis mittelpotenten Neuroleptika (Chlorprothixen, Levomepromazin, Melperon, Perazin, Pipamperon, Prothipendyl, Thioridazin, Zuclopenthixol) haben historisch gewachsene, symptomorientiert formulierte Anwendungsgebiete wie „zur Dämpfung psychomotorischer Unruhe- und Erregungszustände“, teilweise auch ohne nosologischen Bezug. Symptomorientiert formulierte Anwendungsgebiete sind in der ICD-10-GM grundsätzlich abbildbar (ICD-10-GM: International Statistical Classification of Diseases and Related Health Problems, Tenth Revision, German Modification). Tiaprid wird im ATC (anatomisch-therapeutisch-chemisches Klassifikationssystem) den Neuroleptika subsumiert, ist aber nur für arzneimittelinduzierte Dystonien und Chorea-Huntington zugelassen. Tendenziell ist das Anwendungsgebiet nosologisch spezifischer formuliert, je jünger das Neuroleptikum ist. In Tabelle 1 sind die Operationalisierungen der Anwendungsgebiete durch Codes der ICD-10-GM synoptisch dargestellt. Bei Clozapin konnte nicht antizipiert werden, welche ICD-Codes dem Anwendungsgebiet „Psychosen im Verlauf eines Morbus Parkinson nach Versagen der Standardtherapie“ entsprechen könnten. Im Herbst 2010 – also innerhalb des Beobachtungszeitraums 2010 und 2011 – erfolgte eine Indikationserweiterung für Quetiapin im Sinne „Behandlung depressiver Erkrankungen (Episoden einer Major Depression) als Zusatztherapie bei Patienten, die unzureichend auf die Monotherapie mit einem Antidepressivum angesprochen haben“, sodass dieser Off-Label-Use nicht quantifizierbar sein konnte.
Tab. 1. Synopse der 25 in Deutschland am häufigsten zulasten der gesetzlichen Krankenversicherung verordneten Neuroleptika sowie Lithium mit Operationalisierung der als Freitext formulierten Anwendungsgebiete mittels Codes der ICD-10-GM (Fortsetzung nächste Seite)
|
ICD-Code |
Amisulprid |
Aripiprazol |
Benperidol |
Chlorprothixen |
Clozapin |
Flupentixol |
Fluphenazin |
Fluspirilen |
Haloperidol |
Levomepromazin |
Lithium |
Melperon |
Olanzapin |
Paliperidon |
Perazin |
Perphenazin |
Pimozid |
Pipamperon |
Prothipendyl |
Quetiapin |
Risperidon |
Sulpirid |
Thioridazin |
Tiaprid |
Ziprasidon |
Zuclopenthixol |
|
E10.4, E11.4, E14.4 Diabetes mellitus, mit neurologischen Komplikationen |
+ |
|||||||||||||||||||||||||
|
F00.- Demenz bei Alzheimer-Krankheit (G30.-†) |
+ |
|||||||||||||||||||||||||
|
F03 Nicht näher bezeichnete Demenz |
+ |
|||||||||||||||||||||||||
|
F05.- Delir, nicht durch Alkohol oder andere psychotrope Substanzen bedingt |
+ |
+ |
+ |
|||||||||||||||||||||||
|
F06.- Andere psychische Störungen aufgrund einer Schädigung oder Funktionsstörung des Gehirns oder einer körperlichen Krankheit |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
||||||||||||||||||
|
F10.4, F11.4, F12.4, F13.4, F16.4, F18.4 Psychische und Verhaltensstörungen durch Substanzen: Entzugssyndrom mit Delir |
+ |
+ |
||||||||||||||||||||||||
|
F20.- Schizophrenie |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|||||
|
F22.- Anhaltende wahnhafte Störungen |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|||||||||||||||||
|
F23.- Akute vorübergehende psychotische Störungen |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
||||||||||||||||
|
F25.- Schizoaffektive Störungen |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
||||||||||||||||
|
F28 Sonstige nichtorganische psychotische Störungen |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|||||||||||||||||
|
F29 Nicht näher bezeichnete nichtorganische Psychose |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|||||||||||||||||
|
F30.- Manische Episode |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
||||||||||
|
F31.- Bipolare affektive Störung |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
||||||||||||
|
F31.0 Bipolare affektive Störung, gegenwärtig hypomanische Episode |
+ |
+ |
||||||||||||||||||||||||
|
F31.1 Bipolare affektive Störung, gegenwärtig manische Episode ohne psychotische Symptome |
+ |
+ |
||||||||||||||||||||||||
|
F31.2 Bipolare affektive Störung, gegenwärtig manische Episode mit psychotischen Symptomen |
+ |
+ |
||||||||||||||||||||||||
|
F31.4 Bipolare affektive Störung, gegenwärtig schwere depressive Episode ohne psychotische Symptome |
+ |
|||||||||||||||||||||||||
|
F31.5 Bipolare affektive Psychose, gegenwärtig schwere depressive Episode mit psychotischen Symptomen |
+ |
|||||||||||||||||||||||||
|
F32.- Depressive Episode |
+ |
+ |
||||||||||||||||||||||||
|
F32.3 Schwere depressive Episode mit psychotischen Symptomen |
+ |
+ |
+ |
+ |
+ |
+ |
||||||||||||||||||||
|
F33.- Rezidivierende depressive Störung |
+ |
|||||||||||||||||||||||||
|
F33.3 Rezidivierende depressive Störung, gegenwärtig schwere Episode mit psychotischen Symptomen |
+ |
+ |
+ |
+ |
+ |
+ |
||||||||||||||||||||
|
F39 Nicht näher bezeichnete affektive Störung |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|||||||||||||||||||
|
F51.- Nichtorganische Schlafstörungen |
+ |
+ |
||||||||||||||||||||||||
|
F7- Intelligenzstörung |
+ |
+ |
||||||||||||||||||||||||
|
F84.- Tiefgreifende Entwicklungsstörungen |
+ |
|||||||||||||||||||||||||
|
F95.2 Kombinierte vokale und multiple motorische Tics [Tourette-Syndrom] |
+ |
|||||||||||||||||||||||||
|
G10 Chorea Huntington |
+ |
+ |
||||||||||||||||||||||||
|
G24.0 Arzneimittelinduzierte Dystonie |
+ |
|||||||||||||||||||||||||
|
G30.- Alzheimer-Krankheit (F00.-*) |
+ |
|||||||||||||||||||||||||
|
G47.- Schlafstörungen |
+ |
+ |
||||||||||||||||||||||||
|
G50.0 Trigeminusneuralgie |
+ |
|||||||||||||||||||||||||
|
G52.1 Krankheiten des N. glossopharyngeus [IX. Hirnnerv] |
+ |
|||||||||||||||||||||||||
|
G53.0* Neuralgie nach Zoster (B02.2†) |
+ |
|||||||||||||||||||||||||
|
H81.- Störungen der Vestibularfunktion |
+ |
|||||||||||||||||||||||||
|
M79.29 Neuralgie und Neuritis, nicht näher bezeichnet. Nicht näher bezeichnete Lokalisationen |
+ |
|||||||||||||||||||||||||
|
R45.- Symptome, die die Stimmung betreffen |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|||||||||||||||
|
R52.1 Chronischer unbeeinflussbarer Schmerz |
+ |
|||||||||||||||||||||||||
|
R52.2 Sonstiger chronischer Schmerz |
+ |
Methoden
Die Methodik wurde in diesem Journal insbesondere im Beitrag zu Thrombozytenaggregationshemmern [9] detailliert dargestellt und in einem gesonderten Beitrag [8] kritisch kommentiert, worauf verwiesen wird. Darüber hinaus wurde aus den Altersklassen näherungsweise das mittlere Alter jeder Gruppe (gemäß Wirkstoff und Off- bzw. In-Label-Use) errechnet. Für die allgemeinen somatischen Komorbiditäten wurden explorativ Pearson-Korrelationen zwischen deren Häufigkeit und dem mittleren Alter berechnet, um die Detektion bei einzelnen Wirkstoffen etwa gehäufter Komorbiditäten zu erleichtern. Zu möglicherweise einen gefundenen Off-Label-Use motivierenden Indikationen wurden vergleichend die Fachinformationen aus dem Jahr 1997 herangezogen und es erfolgten explorative Literaturrecherchen, die nur grobe Eindrücke vermitteln sollen und können. Dies auch, um nicht systematischen Recherchen, wie sie im Kontext des Verfahrens nach § 35c SGB V notwendig wären, vorzugreifen.
Ergebnisse
Zwischen den Neuroleptika bestanden Unterschiede in der Verteilung von Geschlecht (Tab. 2) und Alter (Abb. 1), die in Zusammenhang mit den unterschiedlichen zugelassenen und nicht zugelassenen Anwendungsgebieten stehen konnten. Insbesondere Fluspirilen wurde beim weiblichen Geschlecht (Anteil 80%) häufiger verordnet; in nicht so ausgeprägtem Maß Melperon und Ziprasidon (jeweils 65%). Bei Melperon, Pipamperon und Risperidon imponierten Häufungen im höheren Lebensalter sowohl bei In-Label- als auch Off-Label-Use, für Haloperidol bei Off-Label-Use; hier im Wesentlichen bedingt durch die Häufigkeit des unspezifischen Codes F03 (Nicht näher bezeichnete Demenz). Risperidon ragte außerdem bei Kindern und Jugendlichen heraus, ebenso Tiaprid bei Off-Label-Use.
Tab. 2. Verordnung von Neuroleptika und Lithium: Synopse der Ergebnisse (OLU =Off-Label-Use, min./max. gemäß Datenschutzregelung). Hinweis: die unterjährige Indikationserweiterung für Quetiapin konnte nicht gewürdigt werden, sodass dessen Off-Label-Use zwischen etwa 25% und 65% gelegen haben konnte.
|
Amisulprid |
Aripiprazol |
Benperidol |
Chlorprothixen |
Clozapin |
Flupentixol |
Fluphenazin |
Fluspirilen |
Haloperidol |
Levomepromazin |
Lithium |
Melperon |
Olanzapin |
|
|
Total [n] |
62966 |
65393 |
7458 |
94733 |
66068 |
39359 |
16463 |
170591 |
130158 |
69700 |
87548 |
472547 |
155107 |
|
Anteil weiblich min. [%] |
50,94 |
55,10 |
48,15 |
56,29 |
45,38 |
55,36 |
51,70 |
79,49 |
60,05 |
52,61 |
59,05 |
65,31 |
53,53 |
|
Anteil weiblich max. [%] |
50,94 |
55,06 |
48,83 |
56,31 |
45,39 |
55,32 |
51,66 |
79,45 |
60,05 |
52,58 |
59,02 |
65,31 |
53,55 |
|
OLU vor |
37,03 |
27,96 |
5,04 |
45,08 |
25,57 |
28,83 |
10,40 |
92,19 |
38,79 |
44,30 |
14,16 |
35,49 |
40,37 |
|
OLU nach |
37,03 |
27,96 |
5,04 |
45,08 |
12,50 |
28,83 |
10,40 |
92,19 |
22,26 |
44,30 |
7,79 |
35,49 |
40,37 |
|
Alter <18 Jahre min. [%] |
0,20 |
2,17 |
0,04 |
2,27 |
0,21 |
0,01 |
0,02 |
0,08 |
0,16 |
1,47 |
0,13 |
0,27 |
0,54 |
|
Alter <18 Jahre max. [%] |
0,34 |
2,17 |
1,18 |
2,33 |
0,29 |
0,23 |
0,72 |
0,13 |
0,18 |
1,51 |
0,23 |
0,27 |
0,56 |
|
Zugelassenes Mindestalter [Jahre] |
15 |
13 |
18 |
3 |
16 |
18 |
12 |
18 |
3 |
16 |
12 |
12 |
18 |
|
Orphan Diseases |
Keine |
Keine |
Keine |
Keine |
Keine |
||||||||
|
G10 Chorea Huntington |
+ |
+ |
+ |
+ |
+ |
+ |
|||||||
|
G31.0 Frontotemporale Demenzen |
+ |
+ |
+ |
+ |
+ |
+ |
|||||||
|
Paliperidon |
Perazin |
Perphenazin |
Pimozid |
Pipamperon |
Prothipendyl |
Quetiapin |
Risperidon |
Sulpirid |
Thioridazin |
Tiaprid |
Ziprasidon |
Zuclopenthixol |
|
|
Total [n] |
6061 |
65142 |
5606 |
4230 |
229663 |
54353 |
370293 |
452036 |
221382 |
11020 |
42451 |
22340 |
25823 |
|
Anteil weiblich min. [%] |
43,39 |
58,85 |
58,32 |
58,05 |
61,12 |
61,28 |
60,43 |
58,02 |
71,35 |
58,18 |
58,62 |
64,53 |
50,70 |
|
Anteil weiblich max. [%] |
44,01 |
58,82 |
57,98 |
57,80 |
61,10 |
61,27 |
60,42 |
58,02 |
71,32 |
57,78 |
58,47 |
64,38 |
50,80 |
|
OLU vor |
6,91 |
37,80 |
18,23 |
47,16 |
67,89 |
89,51 |
64,80 |
45,25 |
38,64 |
46,34 |
87,02 |
27,32 |
43,41 |
|
OLU nach |
6,91 |
37,80 |
18,23 |
47,16 |
67,89 |
89,51 |
64,80 |
41,18 |
38,64 |
46,34 |
87,02 |
27,32 |
31,70 |
|
Alter <18 Jahre min. [%] |
0,03 |
0,22 |
0,02 |
0,07 |
3,09 |
0,22 |
0,74 |
6,05 |
0,25 |
0,04 |
7,34 |
1,07 |
0,71 |
|
Alter <18 Jahre max. [%] |
0,97 |
0,31 |
0,53 |
2,09 |
3,10 |
0,32 |
0,74 |
6,06 |
0,28 |
1,08 |
7,52 |
1,19 |
0,93 |
|
Zugelassenes Mindestalter [Jahre] |
15 |
16 |
18 |
4 |
0 |
18 |
18 |
5 |
6 |
4 |
4 |
10 |
18 |
|
Orphan Diseases |
Keine |
Keine |
Keine |
Keine |
Keine |
Keine |
|||||||
|
G10 Chorea Huntington |
+ |
+ |
+ |
+ |
+ |
+ |
|||||||
|
G310 Frontotemporale Demenzen |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
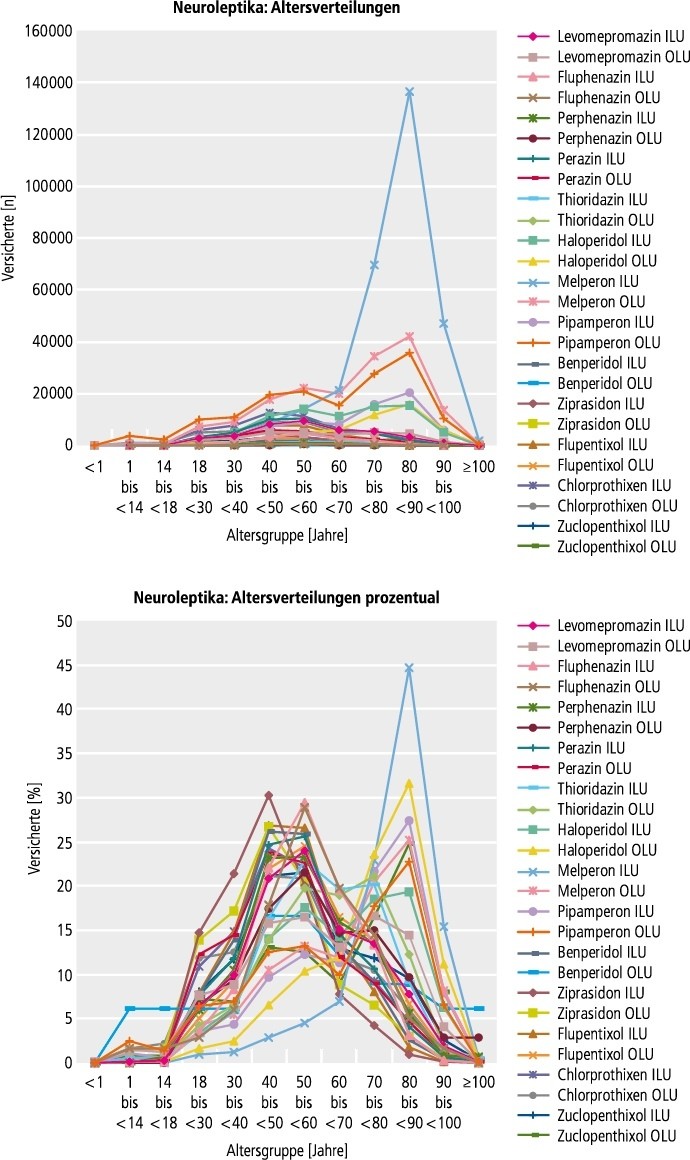
Abb. 1a. Verordnung der Neuroleptika nach Altersgruppen (oben: Anzahl Versicherte, unten Anteil an der Gesamtzahl der jeweiligen Versichertengruppe Wirkstoff-ILU bzw. -OLU) ILU: In-Label-Use; OLU: Off-Label-Use
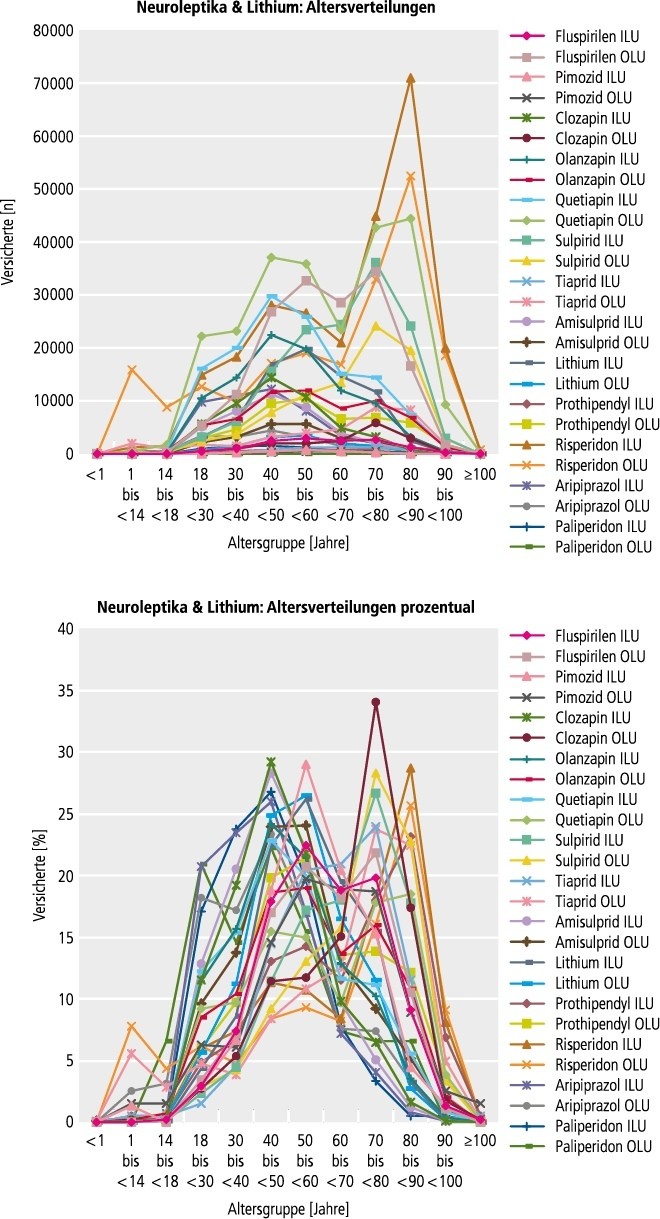
Abb. 1b. Verordnung der Neuroleptika und Lithium nach Altersgruppen (oben: Anzahl Versicherte, unten: Anteil an der Gesamtzahl der jeweiligen Versichertengruppe Wirkstoff-ILU bzw. -OLU) ILU: In-Label-Use; OLU: Off-Label-Use
Das Ausmaß des Off-Label-Use musste zugunsten eines In-Label-Use (Rekonstruktionen) für Haloperidol korrigiert werden, weil die Codes F10.4, F84.-, F95.2 und G10 bei der Operationalisierung irrtümlich (Unterschiede der Anwendungsgebiete der Fertigarzneimittel wurden übersehen) nicht berücksichtigt worden waren (Tab. 2). Entsprechendes galt für Zuclopenthixol und Risperidon, weil die „psychomotorischen Erregungszustände bei geistiger Behinderung“ (Code F7-) durch einen technischen Fehler unberücksichtigt blieben; für Clozapin, weil die Art der Kodierung der „Psychosen im Verlauf eines Morbus Parkinson nach Versagen der Standardtherapie“ nicht zu antizipieren war; schließlich für Lithium, weil der Code F33.- bei der Operationalisierung irrtümlich nicht berücksichtigt worden war. Für Quetiapin war die „Zusatztherapie bei Episoden einer Major Depression ...“ (F32.-, F33.-) erst im Herbst 2010 – also innerhalb des Beobachtungszeitraums 2010 bis 2011 – zugelassen worden, weshalb sie nicht in die Operationalisierung des In-Label-Use einbezogen wurde.
Bei allen Wirkstoffen wurden bei In-Label-Use neben den Codes, die den jeweiligen In-Label-Use operationalisierten, Codes nahezu aus dem gesamten Spektrum psychischer Krankheiten angetroffen (Tab. S3), wobei zwischen den Wirkstoffen die Häufigkeiten deutlich variierten.
Off-Label-Use
Der Off-Label-Use der 25 untersuchten Neuroleptika variierte in den Jahren 2010 und 2011 zwischen 5% (Benperidol) bis über 90% (Fluspirilen); für Lithium lag er bei etwa 8%. Dieser war insbesondere bei schwach-potenten Neuroleptika mit symptomorientierter Formulierung der zugelassenen Anwendungsgebiete, gegebenenfalls auch ohne nosologischen Bezug, häufig (Tab. S4). Zum Beispiel wurden beim Off-Label-Use von Melperon Demenzen kodiert, bei denen „psychomotorische Unruhe und Erregung“ gemäß Anwendungsgebiet zweifellos vorkommen, diese Symptome wurden aber nicht kodiert. Bei Clozapin konnten mindestens 45% des Off-Label-Use dem Einsatz bei „Psychosen im Verlauf eines Morbus Parkinson nach Versagen der Standardtherapie“ zuzuschreiben sein. Dem standen aber nur 12% bis höchstens 41% Nennungen eines Codes aus dem einschlägigen Codebereich F06.- gegenüber (Tab. S4). Auch diese Diskrepanz ließ sich anhand der Daten nicht quantifizierend klären, zumal Clozapin bei Parkinson-Krankheit auch – off Label – gegen resistenten Tremor eingesetzt wird. Der Off-Label-Use von Quetiapin konnte wegen der unterjährigen Indikationserweiterung zwischen etwa 65% (Tab. 2) und 25% gelegen haben.
Grundsätzlich betraf der Off-Label-Use das gesamte Spektrum psychischer Krankheiten, wozu auf Tabelle S4 verwiesen wird. Dabei war aber aus Gründen formaler Logik unentscheidbar, inwieweit es sich um eine Komorbidität oder einen Diagnosewechsel im Beobachtungszeitraum handelte oder die kodierte Krankheit tatsächlich den Off-Label-Use motiviert haben konnte. Hier imponierte die Häufigkeit von Anpassungsstörungen (F43.2) und somatoformen Störungen (F45.-). Folglich musste vielfach offen bleiben, inwieweit der Off-Label-Use quantifizierend aufgeklärt wurde.
Für Amisulprid, Aripiprazol, Flupentixol, Olanzapin, Paliperidon, Pimozid, Risperidon und Ziprasidon sind die Anwendungsgebiete recht spezifisch gemäß nosologischen Entitäten formuliert (Tab. 1), sodass von jeweils bedeutsamem Off-Label-Use insbesondere bei schizoaffektiven Störungen (bei Fluspirilen und Paliperidon zugelassen), Depressionen, Zwangsstörungen und Borderline-Syndrom auszugehen war. Für Lithium gilt dies für den Einsatz bei Schizophrenien und schizoaffektiven Störungen (Tab. S4). Für Fluspirilen bietet das Anwendungsgebiet mit der Formulierung „akut produktive Psychosen“ Interpretationsspielräume („produktiv“ dürfte für sogenannte positive Symptome und hier Wahn und Halluzinationen stehen, die nicht nur Schizophrenien betreffen). Bei Fluspirilen imponierten neben Depressionen (psychotische Symptome wurden hier nur bei 2,3% kodiert) insbesondere Angststörungen und somatoforme Störungen (Tab. S4). Der prominente Off-Label-Use von Tiaprid galt insbesondere Demenzen, Parkinson-Syndromen (hier mutmaßlich Hyperkinesien), Dystonien und Tic-Störungen. Auch Pimozid wurde prominent bei Tic-Störungen eingesetzt. Sulpirid wurde unter anderem bei Schwindel auch unabhängig von einer Ménière-Krankheit sowie bei Tinnitus aurium eingesetzt.
Als seltene Krankheiten, die den Off-Label-Use motiviert haben könnten, wurden bei zahlreichen Neuroleptika Chorea Huntington und frontotemporale Demenzen identifiziert (Tab. 2).
Übriges Morbiditätsspektrum
Zur Morbidität jenseits der zugelassenen Indikationen einerseits und der mutmaßlich den Off-Label-Use motivierenden Codes andererseits waren über 13000 Codes zu sichten. Bei der Interpretation waren die Unterschiede der Altersverteilungen zu berücksichtigen; um dies zu erleichtern, wurden explorativ Korrelationen mit dem Alter berechnet.
Für überzufällig häufige Komorbiditäten (im Sinne der Pharmakovigilanz) wurde der bekannte Zusammenhang zwischen Hypothyreose und Lithium bestätigt (Tab. S5). Ansonsten fanden sich keine eindeutigen Signale (Tab. S5), die nicht überwiegend durch Unterschiede der Altersverteilung hätten erklärt werden können. Auch Hypophysenadenome (Prolaktinome sind nicht spezifisch kodierbar) und Brustkrebs (einige Neuroleptika können in besonderem Maße Hyperprolaktinämie verursachen) zeigten keine Häufungen bei einzelnen Neuroleptika. Insbesondere die Anzahl und Häufigkeit von Neoplasien (Kapitel C der ICD-10-GM) korrelierten (explorativ) (r>0,6) mit dem mittleren Alter, ähnlich die Häufigkeit des Typ-2-Diabetes (r>0,8), des Glaukoms (r>0,8), der arteriellen Hypertonie (r>0,9), der chronischen ischämischen Herzkrankheit (r>0,9), der Lungenembolien (r>0,8), der Herzrhythmusstörungen (jeweils r>0,9), der Niereninsuffizienz (r>0,8) sowie der Schenkelhalsfrakturen und Hüftgelenksendoprothesen, jeweils als Surrogat für ein Sturzrisiko (jeweils r>0,9). Kein Zusammenhang ergab sich zwischen Alter und Adipositas (definiert als BMI>30), wobei sich bei keinem Neuroleptikum eine besondere Häufung abzeichnete.
Behandlungsdauer
Dem Arzneiverordnungsreport (AVR) 2011 und 2012 konnten die zulasten der gesetzlichen Krankenversicherung verordneten sogenannten definierten Tagesdosen (DDD; gemäß der amtlichen ATC-Klassifikation) entnommen werden. Anhand der Zahl der behandelten Versicherten (Tab. 2) konnten damit die mittleren Behandlungsdauern abgeschätzt werden. Gemäß Abbildung 2 variierte die Behandlungsdauer im Wesentlichen zwischen 100 bis 500 Tagen im zweijährigen Beobachtungszeitraum; die apparenten Behandlungsdauern mit Fluphenazin und Benperidol überstiegen die maximal mögliche Zahl von 730 Tagen, was sich am ehesten aus höheren Tagesdosen im Alltag als den von der WHO definierten Tagesdosen (DDD) entsprechend erklären dürfte. Die mittlere Behandlungsdauer war für Fluspirilen und Sulpirid am kürzesten, für Lithium lag sie bei etwa 470 Tagen.
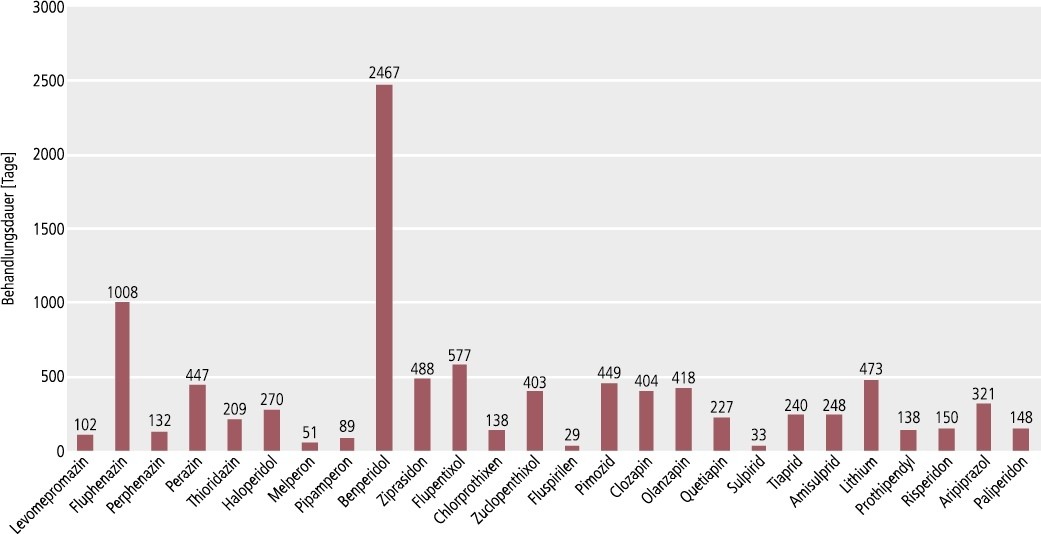
Abb. 2. Neuroleptika und Lithium: „Behandlungstage“ in den Jahren 2010 und 2011. Anhand der Zahl der mit dem Wirkstoff behandelten Versicherten und der im Arzneiverordnungsreport (AVR) 2011 und 2012 ausgewiesenen verordneten Tagesdosen (DDD) ermittelte mittlere Behandlungsdauern (die mit dem Beobachtungszeitraum unvereinbare Behandlungsdauer mit Fluphenazin und Benperidol dürfte sich aus im Alltag höheren Tagesdosen als der WHO-Definition entsprechend erklären)
Diskussion
In diesem Projekt werden erstmals sogenannte Routinedaten der Krankenkassen als Vollerfassung aller gesetzlich Krankenversicherten – anhand der Daten nach §§303aff. SGB V – zur Frage des Off-Label-Use und für Zwecke der Pharmakovigilanz genutzt. Das Beispiel der hier dargestellten Neuroleptika belegt wie schon bei Thrombozytenaggregationshemmern, Psychostimulanzien, Antidementiva und Antidepressiva [8] die Praktikabilität dieses Forschungsansatzes, obwohl diese Routinedaten zu Abrechnungszwecken mit Sekundärnutzung für die Kalkulation des Risikostrukturausgleichs der gesetzlichen Krankenversicherungen erhoben wurden. Bei der Interpretation der Ergebnisse müssen selbstverständlich die daraus resultierenden Schwächen der Daten berücksichtigt werden. Indem eine im zweijährigen Beobachtungszeitraum einmalige Nennung eines der Operationalisierung des In-Label-Use entsprechenden ICD-Codes ausreichte, um einen In-Label-Use anzunehmen, ist die Methodik konservativ zugunsten von In-Label-Use. Die Ergebnisse zu den mutmaßlichen Motiven des Off-Label-Use wurden über alle Altersgruppen hinweg berichtet. Spezifische Analysen für zum Beispiel Kinder und Jugendliche sind grundsätzlich möglich (und wurden angestellt), scheitern aber häufig an geringen Fallzahlen in Verbindung mit der Datenschutzregelung.
Aktualität der Datengrundlage
Inzwischen könnte kritisiert werden, die Datenbasis – Beobachtungszeitraum sind die Jahre 2010 und 2011 – wäre veraltet. Das Projekt wurde Ende 2014 begonnen mit den damals jüngsten der Datenaufbereitungsstelle gemäß § 303d SGB V beim DIMDI (Deutsches Institut für Medizinische Dokumentation und Information) zur Verfügung stehenden Daten; zwischen dem Jahr der Nutzung als Abrechnungsdaten und der Möglichkeit der wissenschaftlichen Nutzung bei der Datenaufbereitungsstelle vergehen also etwa drei Jahre. Innerhalb eines Jahres erlaubten die Kapazitäten der Datenaufbereitungsstelle Auswertungen von nur etwa 100 Wirkstoffen. Innerhalb des Projekts die Beobachtungszeiträume zu ändern, wäre im Gesamtkontext aller etwa 200 auszuwertenden Wirkstoffe methodisch fragwürdig. Ein Umstieg auf jüngere Berichtsjahre hätte zusätzliche Verzögerungen bewirkt.
Es darf vermutet werden, dass der Off-Label-Use sich über die Jahre nur begrenzt ändert, sofern nicht gezielte Sanktionen oder deren Androhung im Rahmen der Wirtschaftlichkeitsprüfung erfolgen. Denn logische Motive für Änderungen können eigentlich nur neu zugelassene Wirkstoffe mit Anwendungsgebieten sein, die bisher durch Off-Label-Use „bedient“ wurden, oder wissenschaftliche Erkenntnisse, durch die sich der Off-Label-Use einerseits verbietet oder andererseits sinnvoll erscheint. Darüber hinaus dürfte sich der Off-Label-Use in den ersten Jahren nach Zulassung eher ausweiten als in späteren Jahren. Für derartige Effekte besteht jedenfalls bei den hier berichteten Neuroleptika und Lithium kein Anhalt. Allerdings wäre es zweifelslos sinnvoll, die hier postulierte Stabilität des Off-Label-Use empirisch durch Vergleich mit jüngeren Daten zu prüfen.
Rekonstruktionen waren für Haloperidol (Unterschiede der Anwendungsgebiete zwischen den Fertigarzneimittel wurden übersehen), Zuclopenthixol, Risperidon und Lithium (technische Fehler) notwendig. Für Clozapin konnte die Art der Kodierung der „Psychosen im Verlauf eines Morbus Parkinson nach Versagen der Standardtherapie“ nicht antizipiert werden, was sich bestätigte. Für Quetiapin war die Zusatztherapie bei Episoden einer Major Depression (F32.-, F33.-) erst im Herbst 2010 zugelassen worden, weshalb sie nicht in die Operationalisierung des In-Label-Use einbezogen wurde.
Unvollständiges Kodieren?
Die Häufigkeit des Off-Label-Use reichte von etwa 5% (Benperidol) bis über 90% (Fluspirilen). Grundsätzlich kann als mögliche Ursache des apparenten Off-Label-Use unvollständiges Kodieren nicht ausgeschlossen werden (zum Beispiel erkennbar an der Dominanz unspezifischer Codes). Wenn dem beobachteten Off-Label-Use aber nur „Fehlerrauschen“ zugrunde läge, dann wäre angesichts der überwiegend großen Zahlen von behandelten Versicherten zu erwarten, dass sich das Ausmaß des Off-Label-Use (Tab. 2) zwischen den Neuroleptika nicht bedeutsam unterschied. Die Unterschiede erscheinen aber beachtlich.
Als Besonderheit zielen die Anwendungsgebiete zahlreicher, insbesondere schwach-potenter, Neuroleptika der ersten Generation auf Syndrome wie „akute psychotische Syndrome“ (Benperidol, Fluphenazin, Perphenazin, Perazin) oder Symptome wie „Unruhe und Erregung“ (Chlorprothixen, Levomepromazin, Thioridazin, Zuclopenthixol) oder „Aggression und psychotische Symptome bei Patienten mit mittelschwerer bis schwerer Alzheimer-Demenz und vaskulärer Demenz“ (Haloperidol; für Risperidon keine vaskuläre Demenz), dies auch ohne nosologische Konkretisierung (Benperidol, Melperon, Perazin, Pipamperon, Prothipendyl).
Solche Syndrome und Symptome lassen sich in der ICD-10-GM abbilden und wurden in die Operationalisierungen aufgenommen. Wenn aber zum Beispiel „Aggressivität“ Voraussetzung für den In-Label-Use ist, so kann die Kodierung allein der Grundkrankheit (z.B. Alzheimer-Demenz) jedenfalls formal keinen In-Label-Use rechtfertigen. Insofern war der Einbezug der Alzheimer-Demenzen (F00.-) in die Operationalisierung des Anwendungsgebiets von Risperidon überinklusiv (ursprünglich war die Suche nach Code-Kombinationen geplant, was sich aber insbesondere wegen datenschutzrechtlicher Bedenken nicht umsetzen ließ), sodass dessen Off-Label-Use formal bei 60% gelegen haben würde.
Die nur beispielhafte nosologische Konkretisierung in der Formulierung des Anwendungsgebiets von zum Beispiel Melperon („insbesondere bei ...“) wurde nicht in die Operationalisierung einbezogen, insbesondere weil anderenfalls die Grundkrankheit auch ohne Vorliegen „psychomotorischer Unruhe und Erregung“ als In-Label-Use gedeutet worden wäre. Analoges gilt für den zugelassenen Einsatz von Clozapin bei „Psychosen im Verlauf eines Morbus Parkinson nach Versagen der Standardtherapie“. Wenn es sich also formal um Off-Label-Use handelte, konnte es sich faktisch um In-Label-Use handeln, ohne dass sich dies anhand der Daten quantifizierend verifizieren ließ. Jedenfalls teilweise war also bei solchen Formulierungen der Anwendungsgebiete der Off-Label-Use auch unvollständigem Kodieren zuzuschreiben, indem – mutmaßlich – nur die Grundkrankheit kodiert wurde.
Neuroleptika bei Demenzen, Depressionen und Angststörungen
Schon beim In-Label-Use, erst recht aber beim Off-Label-Use von Neuroleptika im höheren Lebensalter und den hiermit assoziierten Demenzen ist zu bedenken, dass vor inzwischen über 10 Jahren die Fachinformationen – von entsprechenden Rote-Hand-Briefen begleitet – durch Warnhinweise bezüglich erhöhter Risiken zerebrovaskulärer Ereignisse auch mit Todesfolge angepasst wurden.
Bei zahlreichen Neuroleptika bezog sich der Off-Label-Use auf Depressionen und Zwangsstörungen, mutmaßlich im Sinne einer Augmentation zusätzlich zur Therapie mit Antidepressiva. Die Augmentation antidepressiver Therapie mit Neuroleptika wird in der Literatur diskutiert [1, 17, 18]. Sie kann gemäß Leitlinie unipolare Depression der DGPPN (2015) für „Quetiapin (zugelassen), Aripiprazol, Olanzapin und Risperidon (jeweils off Label) in verhältnismäßig niedrigen Dosierungen erwogen werden, um depressive Symptome zu reduzieren“. Gemäß Leitlinie Zwangserkrankungen der DGPPN (2013) „sollte bei ausbleibendem oder unzureichendem Ansprechen (insbesondere bei Vorliegen von komorbiden Tic-Störungen) auf eine leitliniengerechte Therapie mit Serotonin-Wiederaufnahmehemmern/Clomipramin als Augmentation eine zusätzliche Therapie mit den Antipsychotika Risperidon, Haloperidol oder mit Einschränkung Quetiapin angeboten werden“.
Der Einsatz von Lithium bei Schizophrenien gilt vermutlich seiner stimmungsstabilisierenden Wirkung. Ein Cochrane Review [12] fand nur Evidenz geringer Qualität für diesen Einsatz.
Fortleben historischer Anwendungen
Der breite Einsatz von Fluspirilen bei Angststörungen und somatoformen Störungen dürfte in der Tradition der „Neuroleptanxiolyse“ [14] stehen. Bis zum Ende des Nachzulassungsverfahrens lautete das Anwendungsgebiet einer niedrig-dosierten Darreichungsform von Fluspirilen „Angst- und Spannungszustände; psychosomatische Beschwerden“. Anscheinend leben dementsprechende Anwendungen in der Praxis fort (die Nachzulassung wurde zum 31.12.2005 abgeschlossen). Die Leitlinie „Behandlung von Angststörungen“ der DGPPN (2014) führt dazu aus: „... Selbst wenn einige dieser Medikamente eine ältere Zulassung haben, die den Einsatz bei Angststörungen einräumt (‚Psychoneurosen, wenn Tranquilizer wegen Unverträglichkeit oder Abhängigkeit nicht gegeben werden können‛), werden typische Neuroleptika heute nicht mehr empfohlen, da es geeignete Alternativen gibt. Lediglich für den sehr kurzfristigen Einsatz (d.h. einmalige Gabe bei Bedarf) bei akuten Angstzuständen ist der Einsatz niedrigpotenter Neuroleptika zu rechtfertigen. Neuere Studien zeigten die Wirksamkeit atypischer Antipsychotika bei der generalisierten Angststörung.“
Beim Off-Label-Use von Tiaprid bei Demenzen dürfte die beruhigende Wirkung genutzt worden sein, bei Parkinson-Krankheit die antidopaminerg-antihyperkinetische Wirkung. Beides dürfte einer Tradition entsprechen [11, 16]. Bis zum Ende des Nachzulassungsverfahrens lautete das Anwendungsgebiet von Tiaprid: „Dyskinesien, z.B. dystone Syndrome, Hemiballismus, iatrogene Dyskinesien nach Gabe von L-Dopa-haltigen Antiparkinsonmitteln, dyskinetische Syndrome, Dyskinesien nach Neuroleptikatherapie, Bewegungsanomalien, vor allem Chorea und choreatische Zustände, Chorea Huntington, Tics“. Nur die Anwendungsgebiete Neuroleptika-induzierte Spätdyskinesien und Chorea Huntington (mit Einschränkungen) blieben bestehen. Anscheinend leben aber die traditionellen Anwendungen in der Praxis fort. Die S3-Leitlinie „Idiopathisches Parkinson-Syndrom“ der DGN (2016) erwähnt den Einsatz von Tiaprid nicht. Zum Einsatz bei Tic-Störungen legt die S1-Leitlinie „Extrapyramidalmotorische Störungen – Tics“ der DGN (2012) dar: „Angesichts der unzureichenden Studienlage kann keine Substanz eindeutig als Medikament der ersten Wahl empfohlen werden. In Deutschland sind bei Kindern derzeit Tiaprid, Sulpirid, Aripiprazol und Risperidon am gebräuchlichsten, bei Erwachsenen Sulpirid, Aripiprazol und Risperidon. Alternativ können andere atypische und klassische Antipsychotika (etwa Pimozid), Tetrabenazin, Topiramat oder – in ausgesuchten Einzelfällen – Botulinumtoxin und Cannabis-Medikamente eingesetzt werden.“
Auch der Off-Label-Use von Sulpirid insbesondere bei Schwindel und Taumel (R42) und somatoformen Störungen (F45.-) kann damit zusammenhängen, dass traditionelle Anwendungen in der Praxis fortleben. Bis zum Ende des Nachzulassungsverfahrens lauteten die Anwendungsgebiete der verschiedenen Darreichungsformen: „Psychovegetative Syndrome, depressive Verstimmungszustände, reaktive Depressionen, larvierte Depressionen, psychosomatische Erkrankungen, Psychoneurosen, Phobien; kindliche Verhaltensstörungen, frühkindlicher Autismus, Schwindelsyndrome (besonders Morbus Ménière), akute psychotische Erkrankungen, Ulcus duodeni und ventriculi“. Bezüglich des Einsatzes bei Tinnitus spricht die multidisziplinäre S3-Leitlinie „Chronischer Tinnitus“ (2015) ausdrücklich keine Empfehlung aus.
Auch der Off-Label-Use von Pimozid insbesondere bei Depressionen, Angststörungen und somatoformen Störungen kann damit zusammenhängen, dass traditionelle Anwendungen in der Praxis fortleben. Bis zum Ende des Nachzulassungsverfahrens enthielten die Anwendungsgebiete der verschiedenen Darreichungsformen unter anderem „psychisch bedingte Versagenszustände“.
Orphan Diseases
Als seltene Krankheiten, denen der Off-Label-Use gegolten haben konnte, wurden nur Chorea Huntingston (G10) und frontotemporale Demenzen (G31.0) identifiziert. Bei beiden dürfte er einer rein symptomatischen Therapie gegolten haben.
Von den etwa 8000 seltenen Krankheiten können weniger als 300 in der ICD spezifisch kodiert werden. Die übrigen sind entweder als Inklusiva unspezifischen Codes subsumiert oder über das alphabetische Verzeichnis solchen unspezifischen Codes zugeordnet. Um dem näherungsweise abzuhelfen, ergänzt das DIMDI im Rahmen eines vom BMG (Bundesministerium für Gesundheit) geförderten Projekts des Nationalen Aktionsplans für Menschen mit Seltenen Erkrankungen (NAMSE) die seltenen Krankheiten, denen im Orphanet eine Kennnummer (Orpha-Code) zugeordnet ist, in einer öffentlich zugänglichen Testdatei „Alpha-ID-SE“ [4]. Deren Anwendung ist bisher – im Gegensatz zur ICD-10-GM – freiwillig und in den Daten nach §§303aff. SGB V nicht enthalten.
Komorbiditäten
Die in den Abrechnungsdaten kodierten Komorbiditäten können nicht kausal dem Wirkstoff zugeschrieben werden. Lithium imponierte in Übereinstimmung mit der Literatur [2] durch eine Häufung von Hypothyreosen. Ansonsten kann aus den Analysen nur geschlossen werden, dass diese Datenbasis keine weiteren Signale für besonders gehäufte Komorbiditäten lieferte, sei es als Risikofaktoren für die behandelten Störungen, sei es als Komplikation ihrer Behandlung, insbesondere unter Berücksichtigung der unterschiedlichen Altersverteilungen. Dass sich im Widerspruch zur Literatur [3] keine Häufungen der Adipositas insbesondere unter Olanzapin zeigten, dürfte unter anderem auf unvollständiges Kodieren zurückzuführen sein.
Die hier erstmals berichteten mittleren Behandlungsdauern zum Beispiel im Sinne der Angemessenheit kommentieren zu wollen, wäre spekulativ, da wesentliche Informationen bei den zugrunde liegenden Datenbankabfragen nicht erfasst wurden. Die Behandlungsdauern müssten in Abhängigkeit von der jeweiligen Indikation betrachtet werden. Auch dies wäre aber grundsätzlich anhand der Daten nach §§303aff. SGB V möglich.
Das breite Spektrum der bei In-Label-Use beobachteten psychiatrischen „Komorbiditäten“, bei denen es sich auch um Diagnosewechsel innerhalb des zweijährigen Beobachtungszeitraums gehandelt haben kann, und die Dominanz unspezifischer ICD-Codes sind vereinbar damit, dass psychiatrische Diagnosen unverändert phänomenologisch-deskriptive, historisch gewachsene Konstrukte und Konventionen darstellen. Dies unterstreicht der hier beobachtete Off-Label-Use der Neuroleptika letztlich über das gesamte Spektrum psychischer Krankheiten hinweg. In der Praxis wird die Psychopharmakotherapie – wie bereits insbesondere im Beitrag zu den Antidepressiva [7] illustriert – auch durch Syndrome, Symptome und erwartete Verträglichkeit indiziert, also unabhängig von der in der ICD niedergelegten und hypothetisch nosologischen Klassifikation. Damit dürfte zusammenhängen, dass der Off-Label-Use zahlreichen Diagnosen galt, die bei In-Label-Use als Komorbiditäten imponierten.
Symptom- und syndromorientierte Formulierungen der Anwendungsgebiete?
Psychopharmaka werden – wie alle Arzneimittel – für jene Anwendungsgebiete zugelassen, in denen der Nachweis von Wirksamkeit und Unbedenklichkeit in methodisch angemessenen Studien erbracht wurde. Die Zuordnung zu einer Indikationsgruppe (hier Antipsychotika/Neuroleptika) folgt der diagnostischen Zuordnung der in die Studien einbezogenen Kranken gemäß international anerkannten Klassifikationssystemen (derzeit ICD-10, DSM 5) und der damit zusammenhängend tradierten pharmakologischen Nomenklatur. Auch vor dem Hintergrund des Off-Label-Use von Psychopharmaka wurde eine neue „Neuroscience based Nomenclature“ entwickelt, worüber Möller und Kasper in diesem Journal kürzlich berichteten [13]. Diese hebt insbesondere auf die Wirkungsmechanismen (Pharmakodynamik) ab. Welche Wirkungen diese Nomenklatur bezüglich der Arzneimittel- und sozialrechtlichen Implikationen des Off-Label-Use zeigen wird, bleibt abzuwarten.
Die Unsicherheiten psychiatrischer Nosologie haben zur Einführung einer ergänzenden, optional anwendbaren, dimensionalen Klassifikation im DSM 5 (Diagnostic and Statistical Manual of Mental Disorders) geführt [15]. Das National Institute of Mental Health (NIMH) hat sein „Research Domain Criteria (RDoC) Project“ gestartet, das eine „Neuroscience-based psychiatric classification“ [10] anstrebt. Das Problem ist im Gebiet psychischer Störungen wegen der begrenzten Validität (und Reliabilität) der Diagnosen besonders relevant, aber nicht isoliert: In der Onkologie gilt ein Forschungsschwerpunkt derzeit den „targeted cancer therapies“. Im Mai 2017 hat die FDA mit Pembrolizumab erstmals einen solchen Wirkstoff mit Anwendungsgebiet allein definiert durch Biomarker („target“) und unabhängig von Lokalisation und Histologie der Tumoren (also unabhängig von der „klassischen“ Krankheitsklassifikation) zugelassen. Wäre dies eine Option bei der Zulassung von Psychopharmaka? Die symptom- und syndromorientierten Formulierungen der Anwendungsgebiete insbesondere der schwach-potenten Neuroleptika der ersten Generation können in diesem Sinne als „targeted psychopharmacotherapies“ verstanden werden, wenn auch auf bescheidenem Niveau, und würden als In-Label-Use imponieren, wenn denn vollständig kodiert würde.
Danksagung
Dem Bundesministerium für Gesundheit wird nachdrücklich für die finanzielle Unterstützung des Projekts gedankt. Herrn Prof. Dr. W. Schwerdtfeger, früherer Präsident des BfArM, wird herzlich für die Unterstützung bei der Initiierung dieses Projekts gedankt. Herrn Dr. Jochen Dreß und Herrn Dr. Michael Schopen, Deutsches Institut für Medizinische Dokumentation und Information (DIMDI), gilt besonderer Dank für die Kooperation bei der Entwicklung der Datenbankabfrageskripte und deren Anwendung.
Interessenkonflikterklärung
J.F. hat in den letzten fünf Jahren Honorare für Beratertätigkeit von Amgen, Janssen, Lilly, Lundbeck, Nestlé, Novartis, Pfizer, Roche, St. Jude Medical, 3M, Sanvartis, Teva und dem Verband der privaten Krankenversicherung e.V. erhalten.
Die anderen Autoren geben an, keine Interessenkonflikte zu haben.
Literatur
1. Bloch MH, Landeros-Weisenberger A, Kelmendi B, Coric V, et al. A systematic review: antipsychotic augmentation with treatment refractory obsessive-compulsive disorder. Mol Psychiatry 2006;11:622–32.
2. Bocchetta A, Loviselli A. Lithium treatment and thyroid abnormalities. Clin Pract Epidemiol Ment Health 2006;2:23.
3. Correll ChU, Lencz T, Malhotra AK. Antipsychotic drugs and obesity. Trends Mol Med 2011; 17:97–107.
4. DIMDI 2017. Alpha-ID-SE – Anwendungsbereich „Seltene Erkrankungen“. www.dimdi.de/static/de/klassi/alpha-id/seltene-erkrankungen.htm (Zugriff am 20.08.2017).
5. Fritze J, Riedel C, Escherich A, Beinlich P, et al. Antidementiva: Spektrum der Verordnung und Morbidität. Psychopharmakotherapie 2017;24:107–18.
6. Fritze J, Riedel C, Escherich A, Beinlich P, et al. Antidepressiva: Spektrum der Verordnung und Morbidität. Psychopharmakotherapie 2017;24:211–29.
7. Fritze J, Riedel C, Escherich A, Beinlich P, et al. Psychostimulanzien: Spektrum der Verordnung und Morbidität. Psychopharmakotherapie 2017;24:56–62.
8. Fritze J, Riedel C, Escherich A, Beinlich P, et al. Spektren der Verordnung und Morbidität von Thrombozytenaggregationshemmern, Psychostimulanzien, Antidementiva. Korrektur und methodenkritischer Exkurs zur Aussagefähigkeit von Routinedaten. Psychopharmakotherapie 2017;24:166–8.
9. Fritze J, Riedel C, Escherich A, Beinlich P, et al. Thrombozytenaggregationshemmer: Spektrum der Verordnung und Morbidität. Psychopharmakotherapie 2017;24:8–20.
10. Insel T, Cuthbert B, Garvey M, Heinssen R, et al. Research domain criteria (RDoC): toward a new classification framework for research on mental disorders. Am J Psychiatry 2010;167:748–51.
11. Lees AJ, Lander CM, Stern GM. Tiapride in levodopa-induced involuntary movements. J Neurol Neurosurg Psychiatry 1979;42:380–3.
12. Leucht S, Helfer B, Dold M, Kissling W, et al. Lithium for schizophrenia. Cochrane Database Syst Rev 2015;10:CD003834.
13. Möller HJ, Kasper S. Neuroscience based Nomenclature (NbN) für Psychopharmaka – eine wichtige neue Entwicklung. Psychopharmakotherapie 2017;24:2–6.
14. Pach J, Waniek W. Vergleichende Untersuchung zum Tranquilizer-Effekt von Fluspirilen und Diazepam. Pharmakopsychiatr Neuropsychopharmakol 1976;9:61–6.
15. Regier DA, Kuhl EA, Kupfer DJ. The DSM-5: Classification and criteria changes. World Psychiatry 2013;12:92–8.
16. Robert PH, Allain H. Clinical management of agitation in the elderly with tiapride. Eur Psychiatry 2001;16(Suppl 1):42s–7s.
17. Tundo A, de Filippis R, Proietti L. Pharmacologic approaches to treatment resistant depression: Evidences and personal experience. World J Psychiatry 2015;5:330–41.
18. Veale D, Miles S, Smallcombe N, Ghezai H, et al. Atypical antipsychotic augmentation in SSRI treatment refractory obsessive-compulsive disorder: a systematic review and meta-analysis. BMC Psychiatry 2014;14:317.
Prof. Dr. med. Jürgen Fritze, Asternweg 65, 50259 Pulheim, E-Mail: juergen.fritze@dgn.de
Dr. med. Claudia Riedel, Angelika Escherich, Peggy Beinlich, Prof. Dr. Karl Broich, Priv.-Doz. Dr. Thomas Sudhop, Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn
Neuroleptics: Spectra of prescribing and morbidity
In an ongoing project supported by the Federal Ministry of Health (BMG) off-label-use of pharmaceuticals with high prescription rates is investigated in a database comprising all citizens covered by public sick funds, i.e. some 89% of the German population. The focus is on prevalences and indications as well as on the identification of off-label-use specifically addressing rare diseases in the context of the Action Plan of the National Action League for People with Rare Diseases (NAMSE). In the years 2010 through 2011 the off-label-use of the 25 neuroleptics investigated varied between 5% (Benperidol) up to more than 90% (Fluspirilen) and amounted to 8% for Lithium. Apparent off-label-use could in part have been due to incomplete coding especially for low potency neuroleptics the labels of which tend to be oriented to symptoms rather than nosological entities and addressed a multitude of other psychiatric disorders, where schizophrenia dominated the off-label-use of Lithium. Lithium was associated with hypothyroidism. No further comorbidities potentially signaling specific risks were detected. Huntington’s disease and frontotemporal dementias were the only rare diseases detected putatively being addressed by the off-label-use.
Key words: Antipsychotics, neuroleptics, lithium, off-label-use, National Action League for People with Rare Diseases, NAMSE
Psychopharmakotherapie 2018; 25(02):58-68
