Dr. Alexander Kretzschmar, München
In den Phase-III-Studien OPERA I und OPERA II wurde bei Patienten mit RRMS die jährliche Schubrate (primärer Endpunkt) unter Ocrelizumab (600 mg i.v. alle 6 Monate) gegenüber Interferon beta-1a (44 µg s.c. 3-mal wöchentlich) nach zwei Jahren um 46% bzw. 47% reduziert (jeweils p<0,001) (Abb. 1). Die gepoolten Daten zeigten, dass signifikant weniger Patienten eine Behinderungsprogression, bestätigt nach 12 Wochen, erlitten (Ocrelizumab: 9,8%; Interferon beta-1a: 15,2%; Hazard-Ratio [HR] 0,60; 95%-Konfidenzintervall [KI] 0,45–0,81; p=0,0006) (Abb. 2). Mit 47,6% erreichten signifikant mehr Teilnehmer die NEDA-Kriterien (No evidence of disease activity) unter Ocrelizumab als unter Interferon beta-1a (28,0%; p<0,001) [5]. Der Verlust des Ganzhirnvolumens wurde gegenüber Placebo um 22,8% (OPERA I: p=0,004) bzw. 14,9% (OPERA II: p=0,09) reduziert.
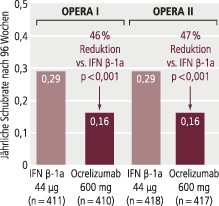
Abb. 1. Schubratenreduktion mit Ocrelizumab bei schubförmiger MS in den Phase-III-Studien OPERA I und OPERA II: (mod. nach [5])
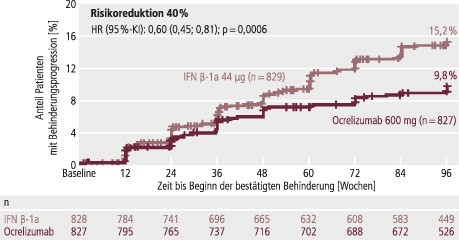
Abb. 2. Ocrelizumab bei schubförmiger MS in den Phase-III-Studien OPERA I und OPERA II: Reduktion des Risikos einer Behinderungsprogression, bestätigt nach 3 Monaten (mod. nach [5])
Inzwischen liegen Daten zur Therapie der RRMS bis zu drei Jahren aus einer offenen Extensionsstudie vor. Im ersten Jahr der Therapie mit Ocrelizumab hatte sich bei Patienten, die in den Basisstudien mit Interferon beta-1a behandelt worden waren, die jährliche Schubrate derjenigen der Patienten angeglichen, die von Anfang an Ocrelizumab erhielten. Auch die im Kernspintomogramm (MRT) nachweisbare Krankheitsaktivität war fast vergleichbar, sowohl in Bezug auf Läsionen im Gadolinium-anreichernden (Gd+) T1-MRT (Interferon beta-1a/Ocrelizumab: 0,01; Ocrelizumab: 0,00) als auch auf neue bzw. vergrößerte Läsionen im T2-MRT (0,37 vs. 0,09) [10].
Wirksam nach 4 bis 8 Wochen
In OPERA I und in OPERA II korrespondierte die Reduktion der jährlichen Schubrate als primärer klinischer Studienendpunkt zeitlich mit der Reduktion der Krankheitsaktivität in den begleitenden MRT-Untersuchungen in den ersten vier bis acht Wochen. Ein rascher Effekt auf die Krankheitsaktivität gemäß MRT wird auch durch die Post-hoc-Analyse einer Phase-II-Studie bestätigt, in der Ocrelizumab mit Interferon beta-1a (30 µg i.m. 1-mal wöchentlich) und Placebo verglichen wurde (Abb. 3) [1, 4].
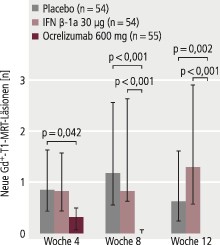
Abb. 3. Wirkungseintritt von Ocrelizumab auf die Krankheitsaktivität gemäß MRT (adjustierte Rate Gadolinium-aufnehmender T1-Läsionen) (mod. nach [1, 4])
Potentere Therapien, verfeinertes Monitoring
Die Entwicklung neuer, potenter Therapieansätze für die MS generiert nicht nur neue Impulse für die Behandlung, sondern auch im Hinblick auf die Entwicklung neuer, sensiblerer Instrumente für die Beurteilung der Krankheitsaktivität. Der EDSS (Expanded disability status score) ist gerade in der Frühphase zu unsensibel für einen Anstieg der Behinderungsprogression und eine Verschlechterung der Lebensqualität [8]. Im klinischen Studienprogram für Natalizumab wurde daher erstmals die Freiheit von Krankheitsaktivität (No evidence of disease acitivity; NEDA) als Endpunkt eingesetzt [6]. In den zulassungsrelevanten Phase-III-Studien mit Ocrelizumab wurde mit NEPAD (No evidence of progression or active disease) jetzt ein neuer, erweiterter kombinierter Endpunkt benutzt. Er enthält die drei NEP-Kriterien (No evidence of progression)
- Keine Behinderungsprogression, bestätigt nach 12 Wochen
- Keine bestätigte Progression einer Verschlechterung ≥20% der Hand/Arm-Funktion im 9-Hole-Peg-Test (9HPT)
- Keine bestätigte Progression einer Verschlechterung ≥20% der Gehfähigkeit im Timed 25-Foot Walk (T25FW) sowie
- Keine Protokoll-definierten Rückfälle
und die MRT-Parameter
- Keine Krankheitsaktivität im MRT einschließlich neue bzw. vergrößerte Läsionen im T2-MRT und keine Läsionen im Gd+-T1-MRT
Gegenüber NEDA kann mit der Einbeziehung spezifischer Tests die Funktion der oberen (9HPT) und unteren Extremitäten (T25FW) differenzierter berücksichtigt werden [7]. Inzwischen liegen mehrere Studien bei chronischen Verläufen vor, nach denen die Funktion der oberen Extremitäten noch therapeutisch adressierbar ist, wenn bereits die Verschlechterung der Gehfähigkeit nicht mehr verringert werden kann [3].
Mit NEPAD lassen sich vor allem Patienten mit chronischen Verläufen besser evaluieren, bei denen die Schubaktivität als primärer Endpunkt nicht anwendbar ist. In der Phase-III-Studie ORATORIO wurde Ocrelizumab bei Patienten mit primär progressiver MS mit Placebo verglichen und erzielte eine signifikante Verbesserung in Bezug auf die nach 12 Wochen bestätigte Behinderungsprogression [9]. Eine exploratorische Analyse der ORATORIO-Studie ergab, dass unter Ocrelizumab nach 120 Wochen mit 29,9% mehr als dreimal so viele Patienten die NEPAD-Kriterien erreichten als unter Placebo (9,4%; Odds-Ratio [OR] 4,08; p<0,001, Intention-to-treat-Auswertung) [11]. Eine weitere exploratorische Analyse ergab, dass das Risiko einer Rollstuhlpflichtigkeit (EDSS ≥7) mit Ocrelizumab vor allem bei Patienten mit einem Baseline-EDSS ≤6,0 gegenüber Placebo signifikant reduziert war. Für Patienten mit einem Baseline-EDSS >6,0 und für die gesamte Studienpopulation ergab sich ein positiver, aber nicht signifikanter Trend [2].
Quelle
69. Jahrestagung der American Academy of Neurology (AAN), Boston (USA), 22. bis 28. April 2017 sowie 3. Jahrestagung der European Academy of Neurology (EAN), Amsterdam, 24. bis 27. Juni 2017.
Literatur
1. Barkhof F, et al. AAN 2017; Abstract S12.008.
2. Giovannoni G, et al. EAN 2017; Abstract PR1087.
3. Giovannoni G, et al. Mult Scler Rel Disord 2017;12:70–8.
4. Hauser SL, et al. AAN 2017; Abstract S31.002.
5. Hauser SL, et al. N Engl J Med 2017;376: 221–34.
6. Havdrova E, et al. EAN 2017; Abstract PR1092.
7. Havdrova E, et al. Lancet Neurol 2009;8: 254–60.
8. Kobelt G, et al. Mult Scler 2017;23:1123–36.
9. Montalban X, et al. N Engl J Med 2017; 376:209–20.
10. Naismith RL, et al. AAN 2017; Abstract S31.004.
11. Wolinsky J, et al. AAN 2017; Abstract P4.384.
Psychopharmakotherapie 2017; 24(05)
