Dr. Alexander Kretzschmar, München
Moderne Antikörpertherapien bilden heute ein wichtiges Standbein der Therapie der RRMS. Bei der PPMS hat sich die klinische Translation erfolgreicher RRMS-Therapien mit den unterschiedlichsten Therapieansätzen dagegen nicht als erfolgreich gezeigt. Letztlich geht es bei beiden Verlaufsformen auch darum, die bereits vor der Diagnose einer MS beginnenden hirnatrophischen Prozesse therapeutisch so weit wie möglich zu verlangsamen [8]. Verstärkt in den Fokus gerückt ist dabei die Bedeutung der B-Lymphozyten als zentralem Teil der Immunantwort, insbesondere im Hinblick auf ihre Interaktion mit anderen Immunzellen wie den T-Lymphozyten.
Im Fokus: CD20-positive B-Zellen
Die auf dem EAN und ECTRIMS vorgestellten Daten zu dem humanisierten, monoklonalen Anti-CD20-Antikörper Ocrelizumab zeigen, dass dieses Konzept auch klinisch tragfähig ist. Für Prof. Stephen Hauser, San Francisco, wäre Ocrelizumab nach erfolgter Zulassung bei der schubförmigen MS (RRMS) eine interessante neue Option im Konzert der unterschiedlichen Wirkansätze und Applikationsformen (Abb. 1) [3, 9]. In den Phase-III-Studien OPERA I und II wurde der primäre Studienendpunkt – die jährliche Schubrate nach 96 Wochen – mit Ocrelizumab im Vergleich zu Interferon beta-1a (IFN-β 1a) um 46% reduziert (p<0,0001). Die bestätigte Behinderungsprogression nach 12 und 24 Wochen verringerte sich im Vergleich zu IFN-β 1a signifikant um jeweils 40% (12 Wochen: p=0,0006; 24 Wochen: p=0,0025) [9]. Unter der Therapie mit Ocrelizumab wurde der Anteil NEDA-positiver Patienten (No evidence of disease activity) im Vergleich zu IFN-β 1a um 75% erhöht [2]. Die Reduktion der klinischen Krankheitsaktivität korrespondierte mit den kernspintomographischen (MRT-) Befunden. Hier reduzierte Ocrelizumab die Zahl Gadolinium-aufnehmender Läsionen im T1-MRT um 94% (OPERA I) bzw. 95% (OPERA II; jeweils p<0,0001) [4]. Der Hirnvolumenverlust war unter Ocrelizumab im Vergleich zu Interferon beta-1a um 23,5% bzw. 23,8% geringer (jeweils p=0,0001).
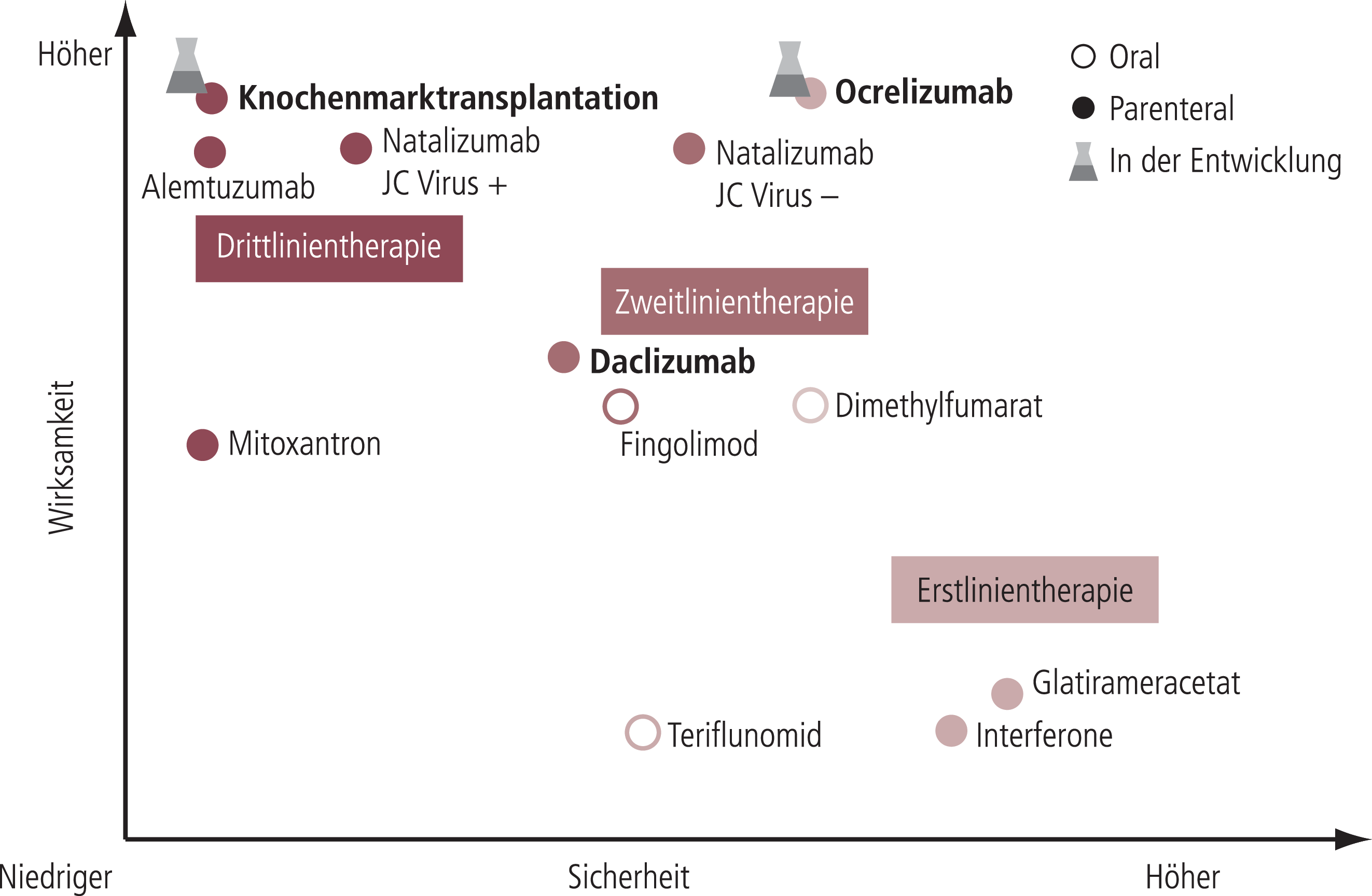
Abb. 1. Wirksamkeit und Sicherheit zugelassener und in der Entwicklung befindlicher Medikamente zur Therapie der schubförmigen MS (RRMS; mod. nach [3])
Bei Patienten mit primär progressiver MS (PPMS) erreichte Ocrelizumab 600 mg in der Phase-III-Studie ORATORIO (n=732) nach 120 Wochen eine signifikante Reduktion des Risikos einer Behinderungsprogression um 24%, bestätigt über 12 Wochen (primärer Endpunkt; p=0,032). Die Anzahl der T2-Läsionen wurde um 91,9% reduziert (p<0,0001) [6]. Der Anteil der Patienten, die nach 120 Wochen unter Ocrelizumab die NEP-Kriterien (No evidence of progression, Freiheit von bestätigter Krankheitsprogression) erfüllten, war signifikant um 47% größer als unter Placebo (42,7% vs. 29,1%; p=0,0006) [7]. NEP ist definiert als Freiheit von bestätigter Krankheitsprogression über eine Dauer von mindestens 12 Wochen sowie eine Verschlechterung der Performance im 9-Hole-Peg-Test sowie im T25-FW (25-Fuss-Gehzeit).
Patienten unter Ocrelizumab gaben in dem Lebensqualitäts-Fragebogen SF-36 eine signifikante Verbesserung der mentalen Komponente an (p=0,0006 vs. Placebo). Zugleich fühlten sie sich signifikant weniger durch eine Fatigue beeinträchtigt, gemessen mit der Fatigue-Skala MFIS (Modified fatigue impact scale) (p=0,0091 vs. Placebo) [1]. Weiter reduzierte Ocrelizumab den Hirnvolumenverlust um 17,5% (p=0,0206 vs. Placebo) [6].
Das Sicherheits- und Verträglichkeitsprofil der Patienten in der Ocrelizumab-Gruppe war insgesamt vergleichbar mit demjenigen unter IFN-β 1a.
Quelle
Prof. Giancarlo Comi, Mailand, Prof. Stephen Hauser, San Francisco, Vorträge im Rahmen der 2. Jahrestagung der European Academy of Neurology (EAN), Kopenhagen, 28. bis 31. Mai 2016 und der 32. Jahrestagung des European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS), London, 14. bis 17. September 2016.
Literatur
1. de Seze J, et al. ECTRIMS 2016; Abstract P1297.
2. Giovannoni G, et al. ECTRIMS 2016; Abstract P1593.
3. Hauser S, et al. Ann Neurol 2013;74:317–27.
4. Hauser SL, et al. ECTRIMS 2015, Abstract 246.
5. Montalban X, et al. ECTRIMS 2015; Abstract 228.
6. Montalban X, et al. ECTRIMS 2015; Abstract 2368.
7. Montalban X, et al. ECTRIMS 2016; Abstract 167.
8. Satellitensymposium „Changing perspectives on the role of the immune system in multiple sclerosis“, ECTRIMS 2016, 14. September 2016.
9. Satellitensymposium „New insights in MS: How are approaches to MS management changing?“, veranstaltet von Roche Pharma AG im Rahmen der 2. Jahrestagung der European Academy of Neurology (EAN), Kopenhagen, 29. Mai 2016.
Psychopharmakotherapie 2016; 23(06)
