Christian Brandt und Christian G. Bien, Bielefeld
Trotz einer Vielzahl „neuer“ Antiepileptika (AED; antiepileptic drugs) – so werden die Substanzen genannt, die seit 1992 eingeführt wurden – kann bei einigen Patienten, vermutlich bei etwa 20 bis 30% [2, 28], bislang kein guter Behandlungserfolg erzielt werden. Die neuen Antiepileptika sind vielfach besser verträglich als die älteren Substanzen und weniger anfällig für Interaktionen, haben aber auch – häufig kognitive oder psychische – Nebenwirkungen. Hier sind beispielweise kognitive Beeinträchtigungen unter Topiramat und Reizbarkeit und Depression unter Levetiracetam (LEV) zu nennen [4, 21]. Insofern besteht weiterhin Bedarf an gut wirksamen und gut verträglichen Antiepileptika. Zwei in den letzten Jahren neu eingeführte Substanzen – Retigabin [18] und Perampanel [15] – sind in Deutschland nicht mehr auf dem Markt, da ihnen in dem gesetzlich vorgeschriebenen Verfahren der frühen Nutzenbewertung kein Zusatznutzen zuerkannt wurde, der eine aus Firmensicht sinnvolle Grundlage für Preisverhandlungen mit den Kostenträgern im Gesundheitswesen ermöglicht hätte.
Aktuell ist in der Europäischen Union Brivaracetam (Briviact®) zur Zusatzbehandlung fokaler Anfälle mit oder ohne sekundäre Generalisierung bei Erwachsenen und Jugendlichen ab 16 Jahren mit Epilepsie zugelassen worden [34]. Es ist verfügbar als Filmtabletten in Dosierungen von 10, 25, 50, 75 und 100 mg, als Lösung zum Einnehmen in einer Konzentration von 10 mg/ml und als Injektions- bzw. Infusionslösung in derselben Konzentration. Als Anfangsdosis werden 50 oder 100 mg Tagesdosis empfohlen, gegebenenfalls mit Aufdosierung bis 200 mg, verteilt auf zwei Tagesdosen. Die Filmtabletten enthalten Lactose. Die unterschiedlichen Darreichungsformen werden identisch dosiert.
Präklinische Daten
Brivaracetam (BRV) ist wie Levetiracetam ein Pyrrolidonderivat (Abb. 1). Brivaracetam ist eine Weiterentwicklung von Levetiracetam. Es weist gegenüber Levetiracetam eine chemische Modifikation auf. Beide Substanzen gehören zu einer neuen Klasse von Antiepileptika. Sie binden an das synaptische Vesikelprotein SV2A. Brivaracetam weist im Tiermodell und bei Studien mit menschlichen Hirnschnitten eine höhere SV2A-Affinität als Levetiracetam auf [10, 19]. Die Wirksamkeit von Brivaracetam erwies sich in Untersuchungen am audiogenen Epilepsie-Modell der Maus, an GAERS-Ratten (Genetic absence epilepsy rats of Strasbourg) sowie in Amygdala- und Cornea-Kindling-Modellen als stärker wirksam im Vergleich zu Levetiracetam [19]. Das Protein SV2A kommt in den Membranen präsynaptischer Vesikel vor, die Neurotransmitter freisetzen. Es liegt also nahe, einen regulierenden Effekt auf die Freisetzung erregender Neurotransmitter als Wirkungsmechanismus anzunehmen. Obwohl die Rolle von SV2A nicht völlig geklärt ist, gibt es Hinweise auf eine Bedeutung des Proteins bei der Entstehung einer Epilepsie: So weisen unter anderem SV2A-defiziente Mäuse eine erhöhte Vulnerabilität gegenüber epileptischen Anfällen auf [12]. Levetiracetam beeinflusst außerdem spannungsabhängige Calcium-Kanäle sowie AMPA- und GABAA-Rezeptoren [23]. Auch Brivaracetam inhibiert an Hirnschnitten spannungsabhängige Calcium-Kanäle, dies dürfte aber klinisch nicht relant sein [23]. In verschiedenen Kindling-Modellen fanden sich Hinweise auf eine mögliche antiepileptogene Wirkung von Brivaracetam [7]. In einem Ratten-Modell posthypoxischer Myoklonien wies Brivaracetam eine höhere Potenz als Levetiracetam auf [33]. In vitro und im Nagermodell drang Brivaracetam schneller ins Hirn ein als Levetiracetam [22], korrespondierend zur höheren Lipophilie [16]. Verschiedene Tiermodelle kognitiver Funktionen gaben keinen Hinweis auf ungünstige Auswirkungen von Brivaracetam auf die Kognition [6].
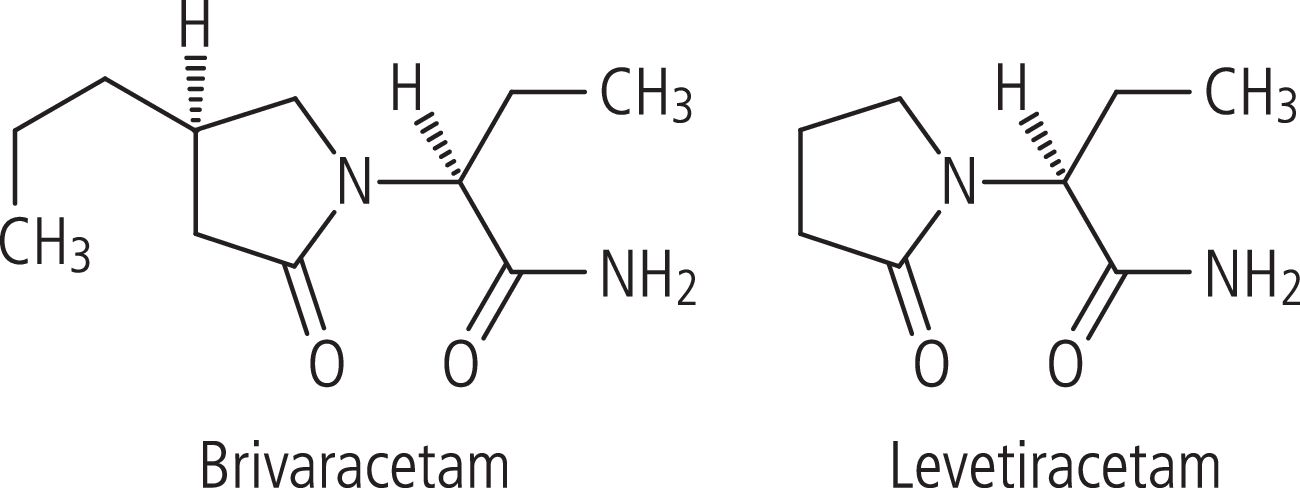
Abb. 1. Brivaracetam und Levetiracetam
Klinische Daten
Pharmakokinetik
Brivaracetam hat ein lineares und vorhersagbares pharmakologisches Profil. Nach oraler Gabe wird es schnell absorbiert. Die Zeit bis zum Erreichen der maximalen Serumkonzentation liegt zwischen ein und zwei Stunden [24]. Die Plasma-Halbwertszeit liegt bei sieben bis neun Stunden, und die Proteinbindung ist niedrig [24, 32]. Das Fließgleichgewicht (Steady State) wird nach zwei Tagen erreicht [14]. Bei Leberinsuffizienz steigt die Halbwertszeit deutlich [30]. Bei Niereninsuffizienz, selbst bei schwerer, steigt die Serumkonzentration von Brivaracetam nicht wesentlich. Eine Dosisanpassung dürfte hier nicht erforderlich sein [27]. Weniger als 10% der Substanz werden unmetabolisiert im Urin ausgeschieden. Die drei wesentlichen Metaboliten sind pharmakologisch inaktiv [34]. Neben der Hydrolyse existiert ein weiterer Stoffwechselweg mittels Hydroxylierung über Cytochrom P450 (hauptsächlich CYP2C19). Bei einer Studie mit japanischen Freiwilligen war die Clearance bei langsamen Metabolisierern 30% geringer als bei extensiven Metabolisierern [32]. Brivaracetam kann bei einer Dosis von 200 mg/Tag die Serumkonzentration von Carbamazepin-Epoxid verdoppeln; andererseits reduzieren Carbamazepin, Phenytoin und Phenobarbital die Brivaracetam-Plasmakonzentration um ein Viertel bis ein Fünftel [29]. Die Herstellerfirma hält Bestimmungen des Brivaracetam-Serumspiegels für nicht erforderlich. Ob diese Einschätzung im klinischen Einsatz Bestand hat oder ob sich nicht vielmehr wie bei anderen Arzneistoffen Indikationen zum therapeutischen Drug-Monitoring ergeben [3, 5], sollte geprüft werden. Die Möglichkeit zur Serumspiegelbestimmung besteht bereits in einzelnen Laboratorien (Antiepileptikalabor der Gesellschaft für Epilepsieforschung e.V., Bielefeld-Bethel, unveröffentlichte Daten).
Besondere Aufmerksamkeit erfahren bei neuen Arzneistoffen mögliche Wechselwirkungen mit oralen hormonellen Kontrazeptiva (OC). Brivaracetam in einer Tagesdosis von 100 mg hatte keine Auswirkungen auf die Plasmakonzentrationen von Ethinylestradiol und Levonorgestrel, die in einem Kombinationspräparat eingenommen wurden, und die Brivaracetam-Konzentration im Serum wurde ihrerseits nicht durch das OC beeinflusst [31].
Wirksamkeit
Bei einer Proof-of-Concept-Studie konnte eine gute Wirksamkeit von Brivaracetam auf die photoparoxysmale Reaktion bei Probanden mit einer photosensiblen Epilepsie gezeigt werden [14]. Bei der Prüfung im Photosensibilitätsparadigma handelt es sich um ein etabliertes Verfahren im Rahmen der Wirksamkeitsprüfung eines potenziellen neuen Antiepileptikums, das schon vielfach eingesetzt wurde, auch bei Arzneistoffen, die für den Einsatz bei fokalen Epilepsien entwickelt werden [13].
Wie bei neuen Antiepileptika üblich, wurden Wirksamkeit und Verträglichkeit von Brivaracetam in mehreren multizentrischen, randomisierten, doppelblinden, Placebo-kontrollierten klinischen Prüfungen (Studien; s. Tab. 1) geprüft. Den Vorgaben der amerikanischen Zulassungsbehörde einerseits und der europäischen andererseits entsprechend, wurden die mittlere Reduktion der Anfallsfrequenz sowie die 50%-Responderrate (also der Anteil der Patienten, die eine Reduktion der Anfallsfrequenz von mindestens 50% erlebten) als wichtigste Zielparameter festgelegt. Den jeweiligen Zielsetzungen der Studien entsprechend wurden unterschiedliche Dosierungen über verschiedene Zeiträume getestet. Signifikante Besserungen wichtiger Zielparameter wurden unter Dosierungen von 100 bis 200 mg [15, 26], bei einer Studie auch unter 50 mg [1] und bei einer weiteren mit einer allerdings kurzen Behandlungsdauer auch unter 5 und 20 mg erreicht [9]. Eine der frühen Brivaracetam-Studien [26] hatte die Besserung der Baseline-adjustierten Anfallsfrequenz gegenüber Placebo als primären Zielparameter. Hier handelte es sich um ein bisher nicht verwendetes Outcome-Kriterium, das zu einer Senkung der für die Studie erforderlichen Patientenzahl führen sollte. Für diesen vordefinierten Zielparameter wurde keine signifikante Überlegenheit von 50 mg/Tag gegenüber Placebo erreicht. Dies gelang allerdings bei 100 mg pro Tag. Bei zwei weiteren nachfolgenden Studien wurden wiederum keine signifikanten Veränderungen des neuartigen primären Zielparameters (Baseline-adjustierte Besserung der mittleren Anfallsfrequenz gegenüber Placebo) erreicht [17, 35]. Letztlich wurde wegen der frühen Studien mit dem neuartigen Zielparameter mehr Patienten in Studien untersucht als sonst im Rahmen von Antiepileptika-Zulassungen. Die klassischen Zielparameter von Antiepileptika-Studien wurden letztlich erreicht. Es liegen jetzt prospektiv-randomisiert gewonnene Erfahrungen bezüglich Wirksamkeit und Verträglichkeit von 2414 Studienpatienten unter Brivaracetam vor (Tab. 1).
Tab. 1. Charakteristika der Placebo-kontrollierten Studien
|
Bezeichnung |
Randomisierte |
Behandlungsdauer |
Wirksamkeit ggü. Placebo |
Wichtige |
Quelle |
|
N01253 |
400 |
12 Wochen |
50 mg (aber nicht 5 und 20 mg) assoziiert mit signifikanter Reduktion der Anfallsfrequenz und Zunahme der 50%-Responder-Rate |
Schläfrigkeit, Schwindel, Müdigkeit, Grippe, Schlaflosigkeit, Nasopharyngitis, Erbrechen, Durchfall, Infektionen der Harnwege und Übelkeit |
[1] |
|
N01193 |
210 |
7 Wochen |
20 und 50 mg assoziiert mit signifikanter Reduktion der Anfallsfrequenz und 5, 20 und 50 mg auch Zunahme der 50%-Responder-Rate |
[9] |
|
|
N01358 |
768 |
12 Wochen |
100 und 200 mg assoziiert mit signifikanter Reduktion der Anfallsfrequenz und Zunahme der 50%-Responder-Rate |
Schläfrigkeit, Schwindel, Müdigkeit |
[15] |
|
N01254* |
480 |
16 Wochen |
Zielparameter nicht signifikant gegenüber Placebo verändert |
Kopfschmerzen, |
[17] |
|
N01252 |
399 |
12 Wochen |
100 mg reduzierten signifikant die Anfallsfrequenz |
Kopfschmerzen, Schläfrigkeit, Schwindel und Müdigkeit |
[26] |
|
N01114 |
157 |
10 Wochen |
Primäre Zielparameter (Besserung über die gesamte Behandlungsdauer) nicht signifikant, aber signifikante Besserungen in der Erhaltungsphase |
Kopfschmerzen, Müdigkeit, Nasopharyngitis, Übelkeit, Schläfrigkeit und Schwindel |
[35] |
* Besonderheiten: Fokale und generalisierte Epilepsien
In die genannten Studien konnten Patienten mit fokalen Epilepsien eingeschlossen werden, bei einer auch solche mit generalisierten Epilepsien [17]. Bei einer Studie zu einer weiteren Indikation, nämlich Aktionsmyoklonien bei Unverricht-Lundborg-Erkrankung, wurde keine signifikante Besserung der Aktionsmyoklonien erreicht [11]. Veröffentlichungen zu den Langzeit-Follow-up-Studien, die sich an die oben genannten klinischen Prüfungen anschlossen, stehen noch aus.
Die zuletzt veröffentlichte der oben genannten Studien bei Patienten mit fokalen Anfällen ist gleichzeitig die größte [15]. Die Erfüllung der Ein- und Ausschlusskriterien wurde in dieser Studie durch eine zentrale Instanz geprüft und nicht nur durch den individuellen Prüfarzt, um die Aussagekraft der Studie zu erhöhen. 768 Patienten wurden randomisiert. Die 50%-Responder-Rate, also der Anteil, der Probanden, die eine Reduktion der Anfallsfrequenz um mindestens 50% gegenüber der Baseline erlebten, betrug 21,6% für Placebo, 38,9% für Brivaracetam 100 mg/Tag und 37,8% für Brivaracetam 200 mg/Tag. Die mediane Reduktion der Frequenz einfach-fokaler Anfälle betrug 14,9%, 25,4% und 31,5% für Placebo, Brivaracetam 100 mg/Tag und Brivaracetam 200 mg/Tag, die mediane Reduktion komplex-fokaler Anfälle 21,4%, 39,3% bzw. 41,5% und die Reduktion sekundär generalisierter tonisch-klonischer Anfälle 24,7%, 62,5% bzw. 82,1%. Unter Brivaracetam 100 mg/Tag waren während der Behandlungsphase 5,2% der Patienten anfallsfrei, unter Brivaracetam 200 mg/Tag 4,0% und unter Placebo 0,8%. Von besonderem Interesse ist die Wirksamkeit in der Gruppe von Patienten, die zuvor bereits Levetiracetam eingenommen hatten. 412 Probanden dieser Studie waren bereits zuvor mit Levetiracetam behandelt worden, das aber – das war ein Kriterium für den Einschluss in die Studie – wieder abgesetzt worden war, und zwar bei knapp zwei Dritteln wegen mangelnder Wirksamkeit und bei knapp einem Fünftel wegen Nebenwirkungen. Ein wichtige Frage ist, ob die Wirksamkeit von Brivaracetam unterschiedlich ist bei Patienten, die bereits Levetiracetam wegen Wirkungslosigkeit abgesetzt hatten, im Vergleich zu denen, die es wegen Nebenwirkungen abgesetzt hatte, und wiederum im Vergleich zu den Patienten, die noch gar nicht mit Levetiracetam behandelt worden waren. Die Wirksamkeit von Brivaracetam wurde für alle Gruppen nachgewiesen, wenn auch deutlicher bei den „Levetiracetam-naiven“ Patienten gegenüber denen, die schon Levetiracetam eingenommen hatten, und unter diesen wiederum deutlicher bei denen, die Levetiracetam wegen Nebenwirkungen abgesetzt hatten, im Vergleich zu denen, die es wegen Wirkungslosigkeit abgesetzt hatten [15].
Sicherheit und Verträglichkeit
Wichtige Nebenwirkungen, die in mehreren der oben genannten Studien gefunden wurden, waren Kopfschmerzen, Müdigkeit und Schwindel [1, 15, 26]. Bei einer Studie mit gesunden Freiwilligen wurde keine Verlängerung der QT-Zeit unter Brivaracetam 75 mg und Brivaracetam 400 mg im Vergleich zu Placebo gefunden [25]. Eine Studie mit akuter Dosierung von zweimal 10 mg Brivaracetam im Vergleich zu moderaten Dosen von Levetiracetam und Lorazepam zeigte im Vergleich zu Placebo keine Verschlechterung in einer Testbatterie aus elektrophysiologischen und neuropsychologischen Messungen. Die Studie dürfte aufgrund der geringen Brivaracetam-Dosierung und auch aufgrund der fehlenden Langzeitdaten kaum Aussagekraft für die Praxis haben [20]. Aufgrund der psychischen Nebenwirkungen, insbesondere Aggressivität und Depressivität, die unter Levetiracetam beschrieben wurden, richtet sich besonderes Augenmerk auf die Häufigkeit derartiger Nebenwirkungen unter Brivaracetam. In der aktuell veröffentlichten Studie erlebten 10,3% der Patienten unter 100 mg Brivaracetam psychiatrische unerwünschte Ereignisse, 11,3% unter Brivaracetam 200 mg und 7,7% unter Placebo [15]. Insbesondere wurden Angst (1,1% unter Placebo, 2,2% unter Brivaracetam insgesamt), Schlafstörungen (1,1% gegenüber 2,0%) und Depression (0,4% gegenüber 0,8%) genannt. In den Placebo-kontrollierten Studien mit Levetiracetam waren unter Verum 13,5% nichtpsychotische Verhaltensstörungen im Vergleich zu 6% unter Placebo registriert worden [8]. Hierunter fielen Agitation, antisoziale Reaktion, Angst, Apathie, Depersonalisation, Depression, emotionale Labilität, Euphorie, Feindseligkeit, Nervosität, Neurosen und Persönlichkeitsstörungen. Beim Vergleich dieser Zahlen ist besonders der Unterschied zwischen Placebo- und Verum-Gruppen zu beachten, der für Levetiracetam deutlich größer ist.
Auch wenn den Verfassern dieser Übersicht nicht bekannt ist, ob die erfassten Störungen denen entsprechen, die in den Brivaracetam-Studien als psychiatrische unerwünschte Wirkungen gezählt worden waren, und obwohl ein direkter Vergleich unterschiedlicher Studien nicht zulässig ist, deutet sich eine bessere psychische Verträglichkeit von Brivaracetam an. Bei einer Studie mit 29 Teilnehmern, die zuvor alle an nichtpsychotischen Verhaltensstörungen unter Levetiracetam gelitten hatten, besserten sich nach Umstellung auf Brivaracetam diese Nebenwirkungen deutlich bei 93% der Probanden, bei 62% waren sie zum Ende der Studie komplett remittiert. Die Aussagekraft der Studie hat einige Einschränkungen, zum Beispiel die kleine Probandenzahl, den offenen, also unverblindeten Charakter und eine wenig differenzierte Begrifflichkeit der nichtpsychotischen Verhaltensstörungen und eine mögliche Rückkehr zum Mittelwert (Regression to the mean) als Erklärung für die Besserung [36]. Zumindest aber handelt es sich unserer Kenntnis nach um die einzige Studie mit einer Umstellung von Levetiracetam auf Brivaracetam.
Zusammenfassung
Mit Brivaracetam (Briviact®) steht ein neues Antiepileptikum zur Behandlung fokaler Epilepsien zur Verfügung. Es stellt eine neue Behandlungsoption dar und berechtigt als „Weiterentwicklung“ des vielfach eingesetzten Levetiracetam zu Hoffnungen, insbesondere im Hinblick auf eine bessere psychische Verträglichkeit. Ein Vorteil ist die Verfügbarkeit in Formulierungen zur oralen Einnahme wie zur intravenösen Verabreichung. Wie bei allen neuen Arzneistoffen muss der Einsatz im praktischen Alltag, insbesondere in der Langzeitbeobachtung zeigen, ob das Medikament die Hoffnungen erfüllt. Multizentrische, randomisierte, doppelblinde Placebo-kontrollierte Studien sind der Goldstandard bei der Zulassung neuer Antiepileptika, aber sie haben auch Nachteile, unter anderem die Kürze der Beobachtungszeit, aber auch das mittels umfangreicher Ein- und Ausschlusskriterien ausgewählte Patientenkollektiv. Insofern ist die klinische Beobachtung von großer Bedeutung und die Ergänzung durch offene Nachbeobachtungen wünschenswert.
Interessenkonflikterklärung
C. Brandt: Honorare für die Beratung oder Teilnahme an einem Expertenbeirat von Desitin und Eisai; Vortrags- und Autorenhonorare von Desitin, Eisai, Otsuka und UCB; Unterstützung für Kongressbesuche von Pfizer; Forschungsbeihilfe von UCB
C. Bien: Honorare für die Beratung oder Teilnahme an einem Expertenbeirat von Eisai und UCB; Vortrags- und Autorenhonorare von Biogen, Desitin, Diamed, Eisai, Fresenius Medical Care und UCB; Unterstützung für Kongressbesuche von Desitin, Eisai, Grifols und UCB; Forschungsbeihilfe von Astellas, Diamed, Fresenius Medical Care und Octapharma
Literatur
1. Biton V, Berkovic SF, Abou-Khalil B, Sperling MR, et al. Brivaracetam as adjunctive treatment for uncontrolled partial epilepsy in adults: a phase III randomized, double-blind, placebo-controlled trial. Epilepsia 2014;55:57–66.
2. Brandt C. Epilepsie in Zahlen. http://dgfe.info/home/showdoc,id,387,aid,217.html (Zugriff am 30.03.2016).
3. Brandt C, Baumann P, Eckermann G, Hiemke C, et al. [Therapeutic drug monitoring in epileptology and psychiatry]. Nervenarzt 2008;79:167–74.
4. Brandt C, Lahr D, May TW. Cognitive adverse events of topiramate in patients with epilepsy and intellectual disability. Epilepsy Behav 2015;45:261–4.
5. Brandt C, May TW. Therapeutic drug monitoring of newer antiepileptic drugs. Laboratoriums Medizin 2011;35:161–9.
6. Detrait ER, Leclercq K, Loscher W, Potschka H, et al. Brivaracetam does not alter spatial learning and memory in both normal and amygdala-kindled rats. Epilepsy Res 2010;91:74–83.
7. Dupuis N, Matagne A, Staelens L, Dournaud P, et al. Anti-ictogenic and antiepileptogenic properties of brivaracetam in mature and immature rats. Epilepsia 2015;56:800–5.
8. French J, Edrich P, Cramer JA. A systematic review of the safety profile of Levetiracetam: a new antiepileptic drug. Epilepsy Res 2001;47:77–90.
9. French JA, Costantini C, Brodsky A, von Rosenstiel P, Group NS. Adjunctive brivaracetam for refractory partial-onset seizures: a randomized, controlled trial. Neurology 2010;75:519–25.
10. Gillard M, Fuks B, Leclercq K, Matagne A. Binding characteristics of brivaracetam, a selective, high affinity SV2A ligand in rat, mouse and human brain: relationship to anti-convulsant properties. Eur J Pharmacol 2011;664:36–44.
11. Kalviainen R, Genton P, Andermann E, Andermann F, et al. Brivaracetam in Unverricht-Lundborg disease (EPM1): Results from two randomized, double-blind, placebo-controlled studies. Epilepsia 2015.
12. Kaminski RM, Gillard M, Klitgaard H. Targeting SV2A for discovery of antiepileptic drugs. In: Noebels JL, Avoli M, Rogawski MA, Olsen RW, Delgado-Escueta AV (Hrsg.). Jasper’s basic mechanisms of the epilepsies. 4th edition. Bethesda (MD), 2012.
13. Kasteleijn-Nolst Trenite D, Brandt C, Mayer T, Rosenow F, et al. Dose-dependent suppression of human photoparoxysmal response with the competitive AMPA/kainate receptor antagonist BGG492: Clear PK/PD relationship. Epilepsia 2015;56:924–32.
14. Kasteleijn-Nolst Trenite DG, Genton P, Parain D, Masnou P, et al. Evaluation of brivaracetam, a novel SV2A ligand, in the photosensitivity model. Neurology 2007;69:1027–34.
15. Klein P, Schiemann J, Sperling MR, Whitesides J, et al. A randomized, double-blind, placebo-controlled, multicenter, parallel-group study to evaluate the efficacy and safety of adjunctive brivaracetam in adult patients with uncontrolled partial-onset seizures. Epilepsia 2015;56:1890–8.
16. Klitgaard H, Matagne A, Nicolas JM, Gillard M, et al. Brivaracetam: Rationale for discovery and preclinical profile of a selective SV2A ligand for epilepsy treatment. Epilepsia 2016;57:538–48.
17. Kwan P, Trinka E, Van Paesschen W, Rektor I, et al. Adjunctive brivaracetam for uncontrolled focal and generalized epilepsies: results of a phase III, double-blind, randomized, placebo-controlled, flexible-dose trial. Epilepsia 2014;55:38–46.
18. Lerche H, Daniluk J, Lotay N, DeRossett S, et al. Efficacy and safety of ezogabine/retigabine as adjunctive therapy to specified single antiepileptic medications in an open-label study of adults with partial-onset seizures. Seizure 2015;30:93–100.
19. Matagne A, Margineanu DG, Kenda B, Michel P, et al. Anti-convulsive and anti-epileptic properties of brivaracetam (ucb 34714), a high-affinity ligand for the synaptic vesicle protein, SV2A. Br J Pharmacol 2008;154:1662–71.
20. Meador KJ, Gevins A, Leese PT, Otoul C, et al. Neurocognitive effects of brivaracetam, Levetiracetam, and lorazepam. Epilepsia 2011;52:264–72.
21. Mula M, Trimble MR, Yuen A, Liu RS, Sander JW. Psychiatric adverse events during Levetiracetam therapy. Neurology 2003;61: 704–6.
22. Nicolas JM, Hannestad J, Holden D, Kervyn S, et al. Brivaracetam, a selective high-affinity synaptic vesicle protein 2A (SV2A) ligand with preclinical evidence of high brain permeability and fast onset of action. Epilepsia 2016;57:201–9 [Epub 2015 Dec 10].
23. Niespodziany I, Andre VM, Leclere N, Hanon E, et al. Brivaracetam differentially affects voltage-gated sodium currents without impairing sustained repetitive firing in neurons. CNS Neurosci Ther 2015;21:241–51.
24. Rolan P, Sargentini-Maier ML, Pigeolet E, Stockis A. The pharmacokinetics, CNS pharmacodynamics and adverse event profile of brivaracetam after multiple increasing oral doses in healthy men. Br J Clin Pharmacol 2008;66:71–5.
25. Rosillon D, Astruc B, Hulhoven R, Meeus MA, et al. Effect of brivaracetam on cardiac repolarisation – a thorough QT study. Curr Med Res Opin 2008;24:2327–37.
26. Ryvlin P, Werhahn KJ, Blaszczyk B, Johnson ME, et al. Adjunctive brivaracetam in adults with uncontrolled focal epilepsy: results from a double-blind, randomized, placebo-controlled trial. Epilepsia 2014;55:47–56.
27. Sargentini-Maier ML, Sokalski A, Boulanger P, Jacobs T, et al. Brivaracetam disposition in renal impairment. J Clin Pharmacol 2012;52:1927–33.
28. Schmidt D, Schachter SC. Drug treatment of epilepsy in adults. BMJ 2014;348:g254.
29. Stockis A, Chanteux H, Rosa M, Rolan P. Brivaracetam and carbamazepine interaction in healthy subjects and in vitro. Epilepsy Res 2015;113:19–27.
30. Stockis A, Sargentini-Maier ML, Horsmans Y. Brivaracetam disposition in mild to severe hepatic impairment. J Clin Pharmacol 2013;53:633–41.
31. Stockis A, Watanabe S, Fauchoux N. Interaction between brivaracetam (100 mg/day) and a combination oral contraceptive: a randomized, double-blind, placebo-controlled study. Epilepsia 2014;55:e27–31.
32. Stockis A, Watanabe S, Rouits E, Matsuguma K, et al. Brivaracetam single and multiple rising oral dose study in healthy Japanese participants: influence of CYP2C19 genotype. Drug Metab Pharmacokinet 2014;29:394–9.
33. Tai KK, Truong DD. Brivaracetam is superior to Levetiracetam in a rat model of post-hypoxic myoclonus. J Neural Transm (Vienna) 2007;114:1547–51.
34. UCB. Fachinformation Briviact Filmtabletten.
35. Van Paesschen W, Hirsch E, Johnson M, Falter U, et al. Efficacy and tolerability of adjunctive brivaracetam in adults with uncontrolled partial-onset seizures: a phase IIb, randomized, controlled trial. Epilepsia 2013;54:89–97.
36. Yates SL, Fakhoury T, Liang W, Eckhardt K, et al. An open-label, prospective, exploratory study of patients with epilepsy switching from Levetiracetam to brivaracetam. Epilepsy Behav 2015;52:165–8.
Dr. med. Christian Brandt, Ltd. Abteilungsarzt der Abt. f. Allgemeine Epileptologie, Epilepsiezentrum Bethel, Krankenhaus Mara gGmbH, v. Bodelschwinghsche Stiftungen Behtel, Maraweg 21, 33617 Bielefeld, E-Mail: christian.brandt@mara.de; Prof. Dr. med. Christian Bien, Chefarzt, Epilepsiezentrum Bethel
Brivaracetam – a new antiepileptic drug
Brivaracetam, a new antiepileptic drug, has been approved for the adjunctive treatment of focal epilepsy in adults and adolescents over 16 years. Brivaracetam binds – like levetiracetam – to the synaptic vesicle protein SV2A. However, brivaracetam has been shown in animal models and in studies using human brain slices to have a higher SV2A affinity. Efficacy and safety have been tested in several multicenter, randomized, double-blind, placebo-controlled trials. The data lead to a recommended initial dose of 50 to 100 mg, divided into two daily doses. Up-titration to 200 mg daily dose is possible. Headache, fatigue and dizziness have been reported in several studies as relevant side effects, psychiatric side effects were – compared to the pivotal studies of levetiracetam – seen less frequently.
Key words: Focal epilepsy, seizures, treatment, SV2A ligands, levetiracetam
Psychopharmakotherapie 2016; 23(03)
