Simone Reisdorf, Erfurt
Brivaracetam (Briviact®) und sein „Vorgänger“ Levetiracetam (Keppra®; beide UCB) unterscheiden sich nur in einer kleinen Substitution voneinander (Abb. 1). Diese verstärkt aber deutlich die Affinität des Wirkstoffs an die SV2A-Bindungsstelle der synaptischen Vesikel: Die Bindung ist bei Brivaracetam etwa 13-mal so stark wie bei Levetiracetam. Es wird angenommen, dass eben diese spezifische Bindung an SV2A die Glutamat-Freisetzung aus den Vesikeln in den synaptischen Spalt reduziert und somit antiepileptisch wirkt.
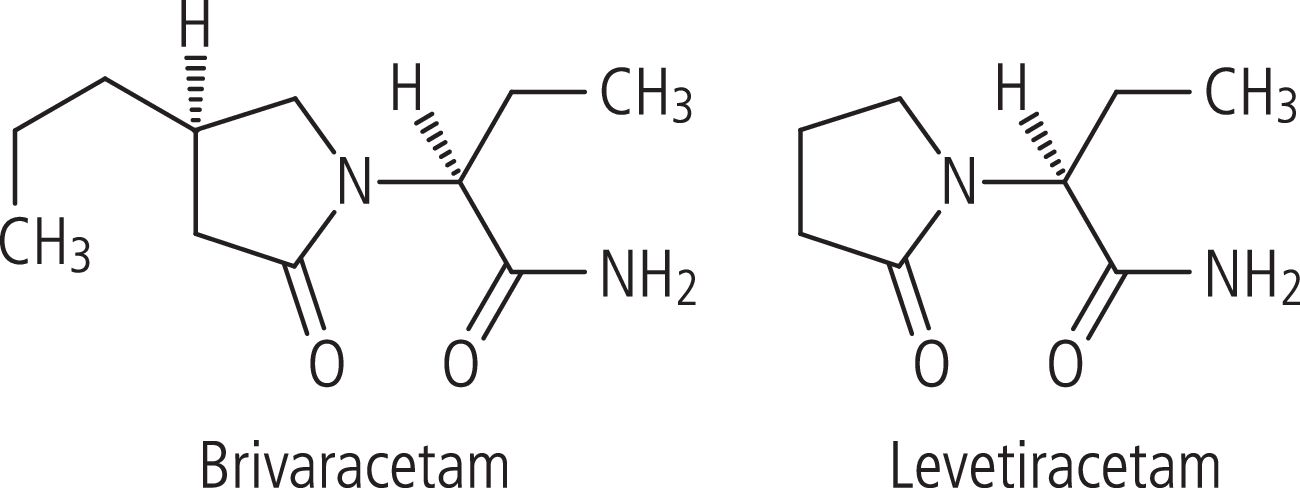
Abb. 1. Brivaracetam und Levetiracetam
Wenig Interaktionspotenzial
Die orale Bioverfügbarkeit von Brivaracetam liegt bei nahezu 100%. Es wird nach oraler Einnahme rasch und vollständig resorbiert, hat eine lineare Pharmakokinetik, eine Plasmaproteinbindung von etwa 20% und eine Eliminations-Halbwertzeit von neun Stunden; nach zwei Tagen wird ein Steady-State-Plasmaspiegel erreicht.
Der Abbau erfolgt zu etwa 60% auf dem Weg der Hydrolyse. Nur zu etwa 30% wird der Wirkstoff über Hydroxylierung via CYP2C19 abgebaut. Es gibt keine pharmakologisch aktiven Metaboliten. Die Ausscheidung erfolgt zu 95% renal.
Das Interaktionspotenzial von Brivaracetam ist relativ gering. So wurden keine Interaktionen mit oralen Kontrazeptiva beobachtet. Rifampicin und andere starke Enzym-Induktoren können den Brivaracetam-Spiegel reduzieren (Rifampicin etwa um ca. 45%; hier kann eine Dosisanpassung erwogen werden). In geringerem Maße können auch Carbamazepin, Phenytoin und Barbiturate den Brivaracetam-Plasmaspiegel senken, dies scheint aber klinisch nicht relevant zu sein.
Überzeugende Ergebnisse dreier Pivotalstudien
Die Zusatztherapie mit Brivaracetam war in drei Phase-III-Pivotalstudien überlegen vs. Zusatztherapie mit Placebo. Insgesamt wurden drei verschiedene Dosen von Brivaracetam untersucht: 200, 100 und 50 mg/Tag; diese wurden jeweils von Beginn an in voller Höhe verabreicht. Zum Studienende nach zwölfwöchiger Behandlung wurde den Patienten die Möglichkeit geboten, die Therapie fortzusetzen; andernfalls wurde das Medikament ausschleichend abgesetzt [1].
Halbierung der Anfallsrate bei mehr als jedem dritten Patienten
Die gepoolten Resultate der drei Studien zeigen eine mindestens 50%ige Reduktion der Anfallshäufigkeit pro 28 Tage bei 37,8%, 39,5% und 34,2% der Patienten unter der Gabe von 200 mg/Tag, 100 mg/Tag bzw. 50 mg/Tag Brivaracetam. Dagegen wurde nur bei 20,3% der Patienten in der Kontrollgruppe unter Placebo die Anfallsrate halbiert.
Völlige Anfallsfreiheit erreichten 4,0% vs. 5,1% vs. 2,0% vs. 0,5% der Studienteilnehmer unter den vier Therapieregimen (in absteigender Dosis). 42,7% vs. 31,0% vs. 24,2% vs. 15,7% der Patienten wurden zumindest frei von sekundär generalisierten tonisch-klonischen Anfällen [1].
Gute Verträglichkeit
Brivaracetam wurde allgemein gut vertragen. Somnolenz, Schwindel, Kopfschmerz und Fatigue waren die häufigsten unerwünschten Wirkungen; sie traten bei 15,2%, 11,2%, 9,6% bzw. 8,7% aller Patienten unter Brivaracetam bzw. Placebo auf. Es wurden keine Einschränkungen der kognitiven Leistungen und kein Einfluss auf das Körpergewicht beobachtet.
Die Abbruchraten waren unter Brivaracetam und Placebo jeweils gering (6,7% vs. 3,9%). 79,8% der Patienten in den offenen Verlängerungsstudien nahmen das neue Medikament auch noch nach zwölf Monaten ein [1].
Eine offene explorative Studie gibt zudem Hinweise darauf, dass unter Brivaracetam seltener psychiatrische Nebenwirkungen wie Aggressivität, Reizbarkeit oder depressive Verstimmungen auftreten könnten als unter Levetiracetam [2].
Zahlreiche Kombinationen möglich
Mit den meisten anderen Antiepileptika kann der neue Wirkstoff kombiniert werden; nicht empfohlen wird die Kombination mit Levetiracetam. Der Einsatz von Brivaracetam ist unter anderem bei denjenigen Patienten besonders aussichtsreich, die Levetiracetam nicht vertragen haben oder bei denen es nicht ausreichend wirkte; hier kann Brivaracetam das ältere Präparat ersetzen.
Eine eventuell notwendige Umstellung zwischen den verschiedenen Darreichungsformen von Brivaracetam (Tabletten, Lösung zum Einnehmen, Injektions-/Infusionslösung) erfolgt im Dosisverhältnis 1:1.
Quelle
Prof. Dr. Christian Bien, Bielefeld, Dr. Stephan Arnold, München, Presse-Round-Table „Brivaracetam: eine neue Therapieoption für Patienten mit unkontrollierten Anfällen bei Epilepsie“, Berlin, 16. Januar 2016, veranstaltet von UCB Pharma.
Literatur
1. Quarate P, et al. Efficacy and safety of adjunctive brivaracetam for partial-onset (focal) seizures: pooled results from three fixed-dose, randomised, double-blind, placebo-controlled phase III studies; Abstract 31st International Epilepsy Congress, September 2015, Istanbul, Türkei.
2. Yates SL, et al. An open-label, prospective, exploratory study of patients with epilepsy switching from levetiracetam to brivaracetam. Epilepsy Behav 2015;52:165–8.
Psychopharmakotherapie 2016; 23(02)
