Priv.-Doz. Dr. Dieter Angersbach, Wolfratshausen
Aripiprazol, ein sogenanntes atypisches Antipsychotikum, ist ein partieller Agonist an dopaminergen D2/D3- und serotonergen 5-HT1A-Rezeptoren sowie ein Antagonist an 5-HT2A-Rezeptoren. Die Substanz ist u.a. für eine bis zu 12 Wochen dauernde Behandlung von mäßigen bis schweren manischen Episoden der Bipolar-I-Störung bei Jugendlichen ab 13 Jahren zugelassen. Der Hersteller empfiehlt zur Behandlung dieser Altersgruppe eine Dosis von 10 mg/Tag und macht darauf aufmerksam, dass für die bessere Wirksamkeit höherer Dosen kein Nachweis besteht und bei einer Dosis von 30 mg/Tag das Risiko für signifikante unerwünschte Wirkungen wie EPMS, Somnolenz und Gewichtszunahme erhöht ist [2].
Ziel der vorliegenden 30-wöchigen Studie war es, die Wirksamkeit und Sicherheit zweier fester Dosen von Aripiprazol (10 und 30 mg/Tag) bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren mit einer manischen oder gemischten Episode einer Bipolar-I-Erkrankung über einen längeren Zeitraum zu untersuchen. Die Untersuchung wurde von März 2005 bis Februar 2007 von 59 Zentren in den USA durchgeführt.
Studiendesign
Die Studie bestand aus einer 4-wöchigen Akutbehandlung und einer 26-wöchigen Verlängerungsphase. Geeignete Patienten wurden randomisiert einer doppelblinden Behandlung über vier Wochen mit einer festen Dosis von Aripiprazol (10 oder 30 mg/Tag) oder mit Plazebo zugeteilt (1:1:1). Alle Patienten, die diese Akutphase abgeschlossen hatten, wurden in die ebenfalls doppelblinde Verlängerungsphase aufgenommen. In die Studie eingeschlossen wurden ambulante, stationäre und teilstationäre Patienten mit der Diagnose einer Bipolar-I-Störung (DSM-IV) und einer akuten manischen oder gemischten Episode mit oder ohne psychotische Merkmale sowie einem YMRS-Gesamtscore von ≥20.
Die Aripiprazol-Dosis lag zu Beginn bei 2 mg/Tag. Sie wurde schrittweise auf 5 mg (Tag 3) und 10 mg/Tag (Tag 5) gesteigert. In der 30-mg/Tag-Gruppe wurde sie weiter jeden 3. Tag um 5 mg/Tag bis zum Erreichen der 30-mg-Tagesdosis erhöht. Alle Patienten, die die Akutphase beendet hatten, wurden mit derselben Dosis in der Verlängerungsphase weiterbehandelt. Die Beurteilung der Wirksamkeit und Verträglichkeit wurde in der Akutphase wöchentlich, in der Verlängerungsphase in den Wochen 6, 8, 10, 12, 16, 20, 24 und 30 vorgenommen. Primärer Messparameter war die Änderung des YMRS-Scores ab dem Einschluss. Sekundäre Parameter waren unter anderen Children’s Global Assessment Scale (CGAS), Clinical Global Impressions-Bipolar (CGI-BP) Severity of Mania, Anteil der Responder (Response=Reduktion des YMRS-Scores um ≥50%) und die Zeit bis zum Behandlungsabbruch.
Die Sicherheitsbeurteilung beruhte u.a. auf Berichten unerwünschter Ereignisse, EKG-Registrierung, Gewichtsbestimmung, Laborbestimmungen und Beurteilung der EPMS. Die statistische Analyse wurde nach der LOCF-Methode und – post hoc – anhand der Daten der in der Studie verbliebenen Fälle (observed cases; OC) vorgenommen.
Ergebnisse
Von den 296 in die Akutphase eingeschlossenen Patienten wurden 210 in die 26-wöchige Verlängerungsphase aufgenommen (Aripiprazol 10 mg: n=75; Aripiprazol 30 mg: n=71; Plazebo: n=64). Die Studie beendeten 32,4% der Patienten (Aripiprazol 10 mg: 45,3%; Aripiprazol 30 mg: 31,0%; Plazebo: 18,8%). Hauptursache der Abbrüche war eine fehlende Wirksamkeit; 22,7% Patienten der 10-mg-Gruppe, 14,1% der 30-mg-Gruppe von Aripiprazol sowie 48,4% der Plazebo-Gruppe brachen aus diesem Grund die Behandlung vorzeitig ab. Die mediane Zeit bis zum Abbruch war bei Patienten unter Aripiprazol signifikant länger (10 mg: 15,6 Wochen, 30 mg: 9,5 Wochen) als bei denen unter Plazebo (5,3 Wochen; p<0,001 bzw. p<0,05).
Aus den Daten aller eingeschlossenen Patienten (n=296) zeigt die Analyse des YMRS-Scores vom Einschluss bis Woche 30 unter beiden Aripiprazol-Dosen einen signifikant größeren Abfall als unter Plazebo (Aripiprazol 10 mg und 30 mg jeweils p<0,001; Abb. 1).
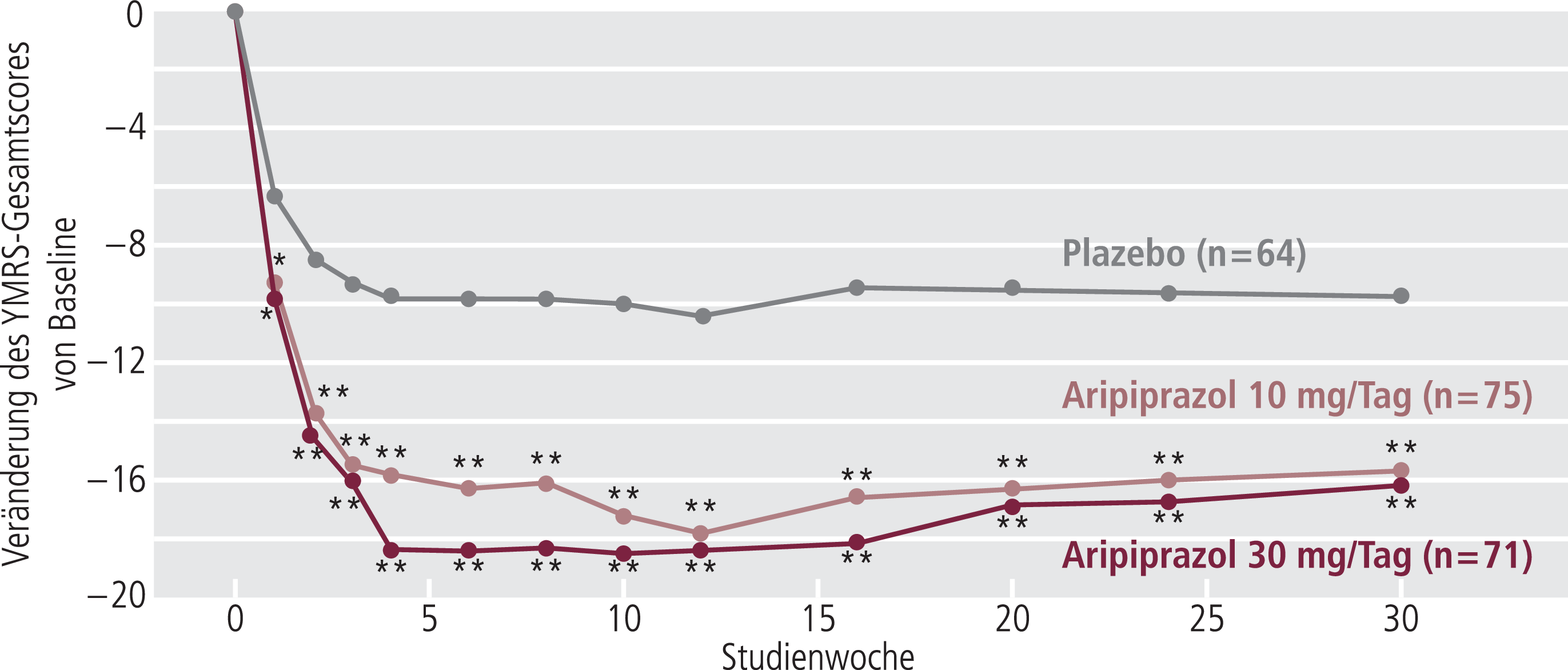
Abb. 1. Mittlere Änderung des Young Mania Rating Scale (YMRS) Scores unter Aripiprazol (10 und 30 mg/Tag) und Plazebo vom Einschluss bis zum Endpunkt (LOCF-Analyse); * p<0,05; **p<0,001, vs. Plazebo [nach 1].
Die OC-Analyse zeigte nur einen Trend zur besseren Wirksamkeit von Aripiprazol (10 mg: p=0,052; 30 mg: p=0,059).
Die Aripiprazol-Behandlung führte zu durchgehend signifikant höheren Response-Raten ab Woche 1 bis zum Endpunkt (10 mg: 58,7%; 30 mg: 64,8%; Plazebo: 29,7%; p<0,01). Auch der CGAS- und der CGI-BP-Score wiesen unter beiden Aripiprazol-Dosen im Vergleich zu Plazebo signifikante Verbesserungen auf (jeweils p<0,001).
Nebenwirkungen mit einer Häufigkeit von mehr als 10% unter einer der beiden Aripiprazol-Dosen (10 und 30 mg/Tag) waren: Somnolenz (28/28,2%), Kopfschmerz (24/26,8%), extrapyramidale Störungen (13,3/25,4%), Müdigkeit (20/12,7%), Übelkeit (16,0/14,1%), Akathisie (9,3/16,9%), Erbrechen (13,3/8,5%), vermehrter Appetit (10,7/1,3%), verschwommenes Sehen (9,3/11,3%), des Weiteren Bauchschmerz (12,0/5,6%) und Atemwegsinfektion (10,7/8,5%). Es traten bei 1,3% der Teilnehmer der 10-mg-Gruppe und bei 7% der 30-mg-Gruppe ernsthafte unerwünschte Ereignisse auf: Verschlechterung der bipolaren Erkrankung (n=5) und vermehrte Libido (n=1). Es gab keine Suizidversuche oder Todesfälle. Die Gewichtszunahme war unter Aripiprazol signifikant höher als unter Plazebo. Die Patienten, die über die gesamte Zeit von 30 Wochen in der Studie waren, nahmen unter Aripiprazol im Mittel 6,5 bzw. 6,6 kg (10 mg bzw. 30 mg) und unter Plazebo 3,0 kg zu (jeweils p<0,05).
Nach Auffassung der Autoren sprechen die Ergebnisse dafür, dass die Behandlung mit Aripiprazol ein Teil des Behandlungsprogramms (neben psychologischen, sozialen und erzieherischen Maßnahmen) bei manischen/gemischten Episoden der pädiatrischen Bipolar-I-Störung sein kann.
Kommentar
Auffallend bei dieser Studie ist die hohe Abbruchrate, die dazu geführt hat, dass beispielsweise nur 12 der ursprünglich eingeschlossenen 99 Plazebo-Patienten die Studie nach 30 Wochen abgeschlossen haben. So waren dann die Gruppenstärken der Completer zu schwach, um in der OC-Analyse in der Woche 30 signifikante Unterschiede zu finden. Die vielen Abbrüche könnten mehrere Gründe haben. Möglicherweise ist die Einsicht in die Notwendigkeit einer Behandlung bei einer Manie geringer ausgeprägt als bei einer Depression. Das könnte sich auf die Compliance ausgewirkt haben. Weiterhin ist im Allgemeinen in doppelblinden Plazebo-kontrollierten Antipsychotika-Studien die Dropout-Rate deutlich höher als in Verum-kontrollierten Studien [3]. Bei unzureichendem Behandlungserfolg nehmen offenbar die Studienärzte die Patienten möglichst bald aus der Studie. Des Weiteren hätten ein langsameres Aufdosieren und niedrigere Tagesdosen möglicherweise zu einer niedrigeren Abbruchrate geführt. Die unerwünschten Wirkungen traten nämlich überwiegend in der Anfangsphase auf. Hier kam es deswegen bereits zu einer großen Zahl von Abbrüchen.
Quellen
1. Findling RL, et al. Aripiprazole for the treatment of pediatric bipolar I disorder: a 30-week, randomized, placebo-controlled study. Bipolar Disord 2013;15:138–49.
2. Fachinformation Abilify® Tabletten, Juli 2013.
3. Kemmler G, et al. Dropout rates in placebo-controlled and active-control clinical trials of antipsychotic drugs: a meta-analysis. Arch Gen Psychiatry 2005;62:1305–12.
Psychopharmakotherapie 2014; 21(02)
