Thorsten Schultheiß, Raimar Kempcke und Tjalf Ziemssen, Dresden
Ein chinesisches Sprichwort besagt: „Fürchte Dich nicht vor dem langsamen Vorwärtsgehen, fürchte Dich nur vor dem Stehenbleiben.“ Die Beeinträchtigung der Gehfähigkeit stellt eine der gravierendsten Folgen der multiplen Sklerose (MS) dar. Insgesamt berichten etwa zwei Drittel aller Patienten im Verlauf ihrer Erkrankung über Gehschwierigkeiten bis hin zur Gehunfähigkeit [13, 14]. Die Mobilität von Patienten kann dabei durch vielfältige Beschwerden wie muskuläre Schwäche, Spastik, Ataxie sowie Tremor beeinträchtigt sein. Einer Datenbank US-amerikanischer Patienten (NARCOMS) zufolge geben 70% der MS-Patienten mit Gehbehinderung an, dass dies der belastendste Aspekt ihrer Erkrankung sei [13]. Ähnliche Ergebnisse konnten an 436 MS-Patienten in Europa und Kanada bestätigt werden [39]. Eine Befragung an 166 deutschen, sowohl kürzlich (<5 Jahre) als auch länger (>15 Jahre) erkrankten Patienten erbrachte ebenfalls die Gehfähigkeit als den wichtigsten Bestandteil der selbst wahrgenommenen Körperfunktionen [16].
Insgesamt ist für MS-Patienten die Einschränkung der Mobilität ein entscheidender Einschnitt für Alltagsaktivitäten wie Einkaufen, Hygiene, Kinderbetreuung usw. Sie hat darüber hinaus einen negativen Einfluss auf die Lebensqualität vor allem im Hinblick auf Lebensfreude und Beziehungen [20]. Über die Hälfte der MS-Patienten berichten, dass sie schon wichtige private Ereignisse auf Grund ihrer Mobilitätseinschränkung verpasst haben [14]. In Deutschland haben diese Probleme einen signifikanten Einfluss auf das Berufsleben bei 74% und bedeuten bei immerhin 72% der befragten MS-Patienten Einbußen im Gehalt [27]. Diese Daten ließen sich anhand des NARCOMS-Registers bei mehr als 8000 befragten MS-Patienten bestätigen und wiesen bereits bei geringen Mobilitätsstörungen eine Korrelation mit Erwerbslosigkeit nach [29]. Hierbei nahm der Anteil der erwerbstätigen Patienten mit steigendem Mobilitätsscore bei beiden Geschlechtern signifikant ab.
Zusammenfassend lässt sich festhalten, dass Mobilität zu den wichtigsten Bedürfnissen des Menschen gehört und hinsichtlich der Lebensqualität eine entscheidende Rolle spielt. Ein Großteil der MS-Patienten leidet bereits früh im Krankheitsverlauf an Mobilitätseinschränkungen einhergehend mit einem nachteiligen Einfluss auf das Alltags- und Berufsleben.
Bisher standen neben rehabilitativen Maßnahmen nur Therapien für einzelne Symptome der Gehbehinderung zur Verfügung und zielten dabei vorwiegend auf die Behandlung der Spastik. Seit vielen Jahren gibt es sowohl tierexperimentell als auch klinisch Hinweise, dass der Kaliumkanalblocker 4-Aminopyridin (4-AP; INN: Fampridin [seit 1995]) die axonale Erregungsleitung und somit unterschiedliche neurologische Funktionen bei demyelinisierenden Erkrankungen verbessert. Mit der Retardformulierung von Fampridin, Fampridin PR (prolonged release), steht seit Sommer 2011 erstmals eine Therapieoption zur Verfügung, die zielgerichtet die Gehfähigkeit von MS-Patienten verbessern kann.
Pharmakologie
Der Pyridinabkömmling 4-Aminopyridin (Abb. 1) wurde 1963 entwickelt. Das kleine Molekül (Molekülmasse 94 Da) ist wasser- und fettlöslich (Octanol/Wasser-Verteilungskoeffizient ca. 2) und eignet sich daher zur oralen Applikation. Bei physiologischem pH-Wert liegt 4-AP mehr in ionisierter als in nicht ionisierter Form vor (pKa=9,17). In nicht ionisierter Form ist es lipophil und kann aufgrund dieser Eigenschaft die Blut-Hirn-Schranke überwinden.
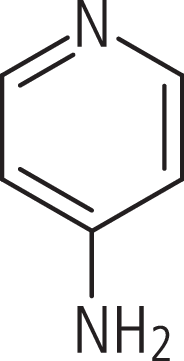
Abb. 1. Fampridin (4-Aminopyridin)
Als selektiver Inhibitor spannungsabhängiger neuronaler Kaliumkanäle (Kv-Kanäle) verbessert Fampridin die Leitfähigkeit demyelinisierter Axone. Spannungsabhängige Kaliumkanäle besitzen im Gegensatz zu den einwärts gleichrichtenden Kaliumkanälen eine intrinsische Spannungsabhängigkeit, die über einen Spannungssensor des Kanalproteins vermittelt wird. Diese auswärts gleichrichtenden Kaliumkanäle lassen sich entsprechend ihrer Inaktivierungsgeschwindigkeit in zwei Unterformen unterscheiden: den schnell inaktivierenden A-Typ und die langsam oder nicht inaktivierenden Kanäle (delayed rectifier). Derzeit sind mindestens sechs verschiedene Subfamilien der Kv-Kanäle bekannt, die sich durch eine unterschiedliche, dosisabhängige Sensitivität gegenüber der Blockade durch Fampridin auszeichnen [15]. Exemplarisch soll die etwa 150-mal höhere Sensitivität der Kv3.1-Kanäle im Vergleich zur Kv2.1-Subfamilie genannt werden.
Die Markscheide dient der Isolation von Nervenfasern, so dass die Erregungsüberleitung saltatorisch von einem Ranvier’schen Schnürring zum nächsten erfolgt. Die infolge der Demyelinisierung fehlende Isolation der internodalen Abschnitte bedingt eine vermehrte Exposition der auswärts gleichrichtenden Kaliumkanäle. Dies begünstigt über einen vermehrten Kaliumausstrom in den Extrazellulärraum eine Repolarisation des Axons und beeinträchtigt somit die axonale Erregungsweiterleitung mit Abflachung des Aktionspotenzials (Abb. 2 oben).
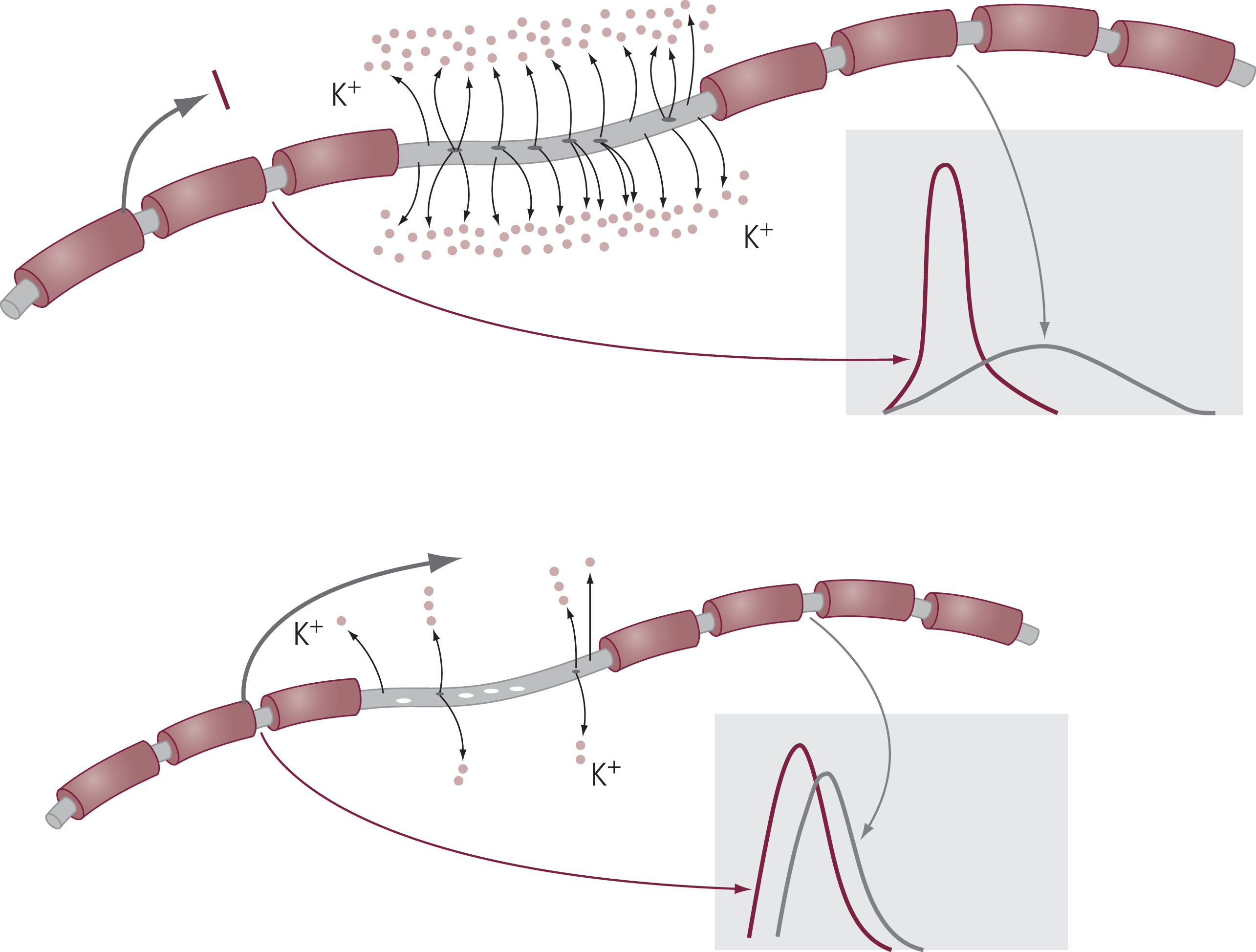
Abb. 2. Ausfall der Weiterleitung von Aktionspotenzialen bei Demyelinisierung ohne (oben) und mit (unten) Fampridin
Bereits in den 1980er-Jahren konnten Bostock et al. eine durch 4-Aminopyridin vermittelte Veränderung der elektrophysiologischen Eigenschaften von entmarkten Nervenfasern nachweisen [3, 33]. Durch die Blockade der axonalen Kv-Kanäle kam es zu einer verlängerten Dauer des Aktionspotenzials einhergehend mit einer entsprechenden Amplitudenerhöhung und als Folge dessen zu einer verbesserten Erregungsweiterleitung in demyelinisierten Nervenfasern (Abb. 2 unten).
Im Gegensatz dazu stellte sich bei Axonen mit intakter Myelinschicht kein relevanter Einfluss dar. Weiterhin ist bekannt, dass Fampridin über eine gesteigerte Freisetzung von Acetylcholin die neuromuskuläre Übertragung fördern kann und im Tierexperiment immunsuppressive Eigenschaften aufweist [7, 24, 44].
Pharmakokinetik
Oral angewendetes Fampridin wird schnell und vollständig aus dem Magen-Darm-Trakt resorbiert. Bei Einnahme der Retardtablette ist die Resorption verlangsamt und es wird ein niedrigerer Spitzenplasmaspiegel (Cmax) erreicht, der Umfang der Resorption ist aber nahezu unverändert: Die relative Bioverfügbarkeit im Vergleich mit der oralen Gabe einer wässrigen Lösung beträgt 95% (Abb. 3). Bei gleichzeitiger Einnahme des Präparats zusammen mit Nahrungsmitteln verringert sich die Fläche unter der Plasma-Konzentrations-Zeitkurve um etwa 2 bis 7%; Cmax steigt um 15 bis 23% (Abb. 3). Wegen der engen therapeutischen Breite der Substanz sollte ein unerwünscht hoher Anstieg der Cmax vermieden werden. Es wird daher empfohlen, Fampridin auf nüchternen Magen einzunehmen. Bei einer Halbwertszeit von etwa sechs Stunden [43] liegt die empfohlene Dosis bei zweimal täglich einer 10-mg-Retardtablette im Abstand von 12 Stunden.
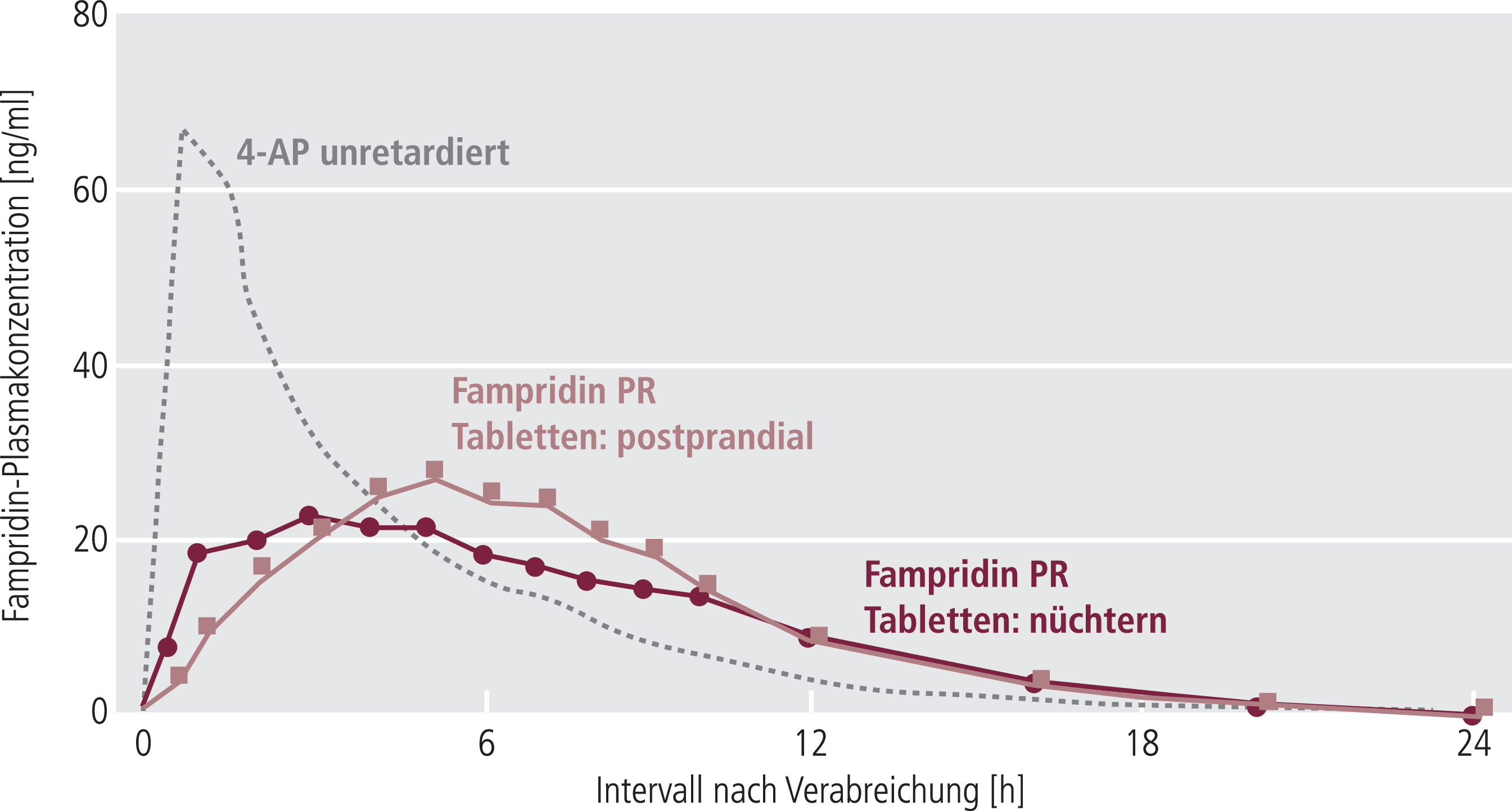
Abb. 3. Effekt der Retardierung (PR, prolonged release) auf den Plasmakonzentrationsverlauf von Fampridin und Effekt von Nahrungsaufnahme auf die Resorption von Fampridin PR [Biogen Idec, Data on file]
Fampridin hat eine vernachlässigbare Proteinbindung (3 bis 7%). Der Hauptweg der Elimination von Fampridin ist die Ausscheidung über die Nieren, wobei etwa 90% der Dosis innerhalb von 24 Stunden als unveränderter Wirkstoff im Urin gefunden werden. Bei Patienten mit normaler Nierenfunktion gibt es keine Hinweise auf eine klinisch relevante Akkumulation von Fampridin bei Einnahme in der empfohlenen Dosis. Es wird jedoch davon ausgegangen, dass die Konzentrationen von Fampridin bei Patienten mit leichter Nierenfunktionsstörung etwa 1,7- bis 1,9-mal höher sind als bei Patienten mit normaler Nierenfunktion, so dass formal eine Kontraindikation für alle Stadien der Niereninsuffizienz vorliegt.
Studienüberblick
Erste Untersuchungen mit 4-Aminopyridin erfolgten bereits in den 1980er-Jahren. Seitdem wurden bis 2008 zehn verschiedene Studien publiziert, die eine klinische Wirksamkeit zur Behandlung der multiplen Sklerose zwar nahelegten, jedoch aufgrund einer Vielzahl von Faktoren (u. a. unterschiedliches Studiendesign, geringe Fallzahlen, verschiedene Dosierungen) letztlich keine einheitliche Empfehlung vorgaben (Tab. 1).
Tab. 1. Klinische Studien zur Wirksamkeit von Fampridin (4-Aminopyridin [4-AP]) bei Patienten mit multipler Sklerose (angelehnt an [14])
|
Studie |
Publikationsjahr |
Studiendesign, Dosierung |
Patienten [n] |
|
[21] |
1983 |
Nicht randomisierte, Plazebo-kontrollierte Studie, bis zu 60 mg 4-AP p. o./Tag |
10 |
|
[35] |
1987 |
Nicht randomisierte, Plazebo-kontrollierte Studie, 7–35 mg 4-AP i. v. in Einzeldosen von 1–5 mg |
12 |
|
[6] |
1990 |
Nicht randomisierte, Plazebo-kontrollierte Studie, 10–25 mg mit 4-AP p. o. |
20 |
|
[36] |
1991 |
5-tägige nicht randomisierte, Plazebo-kontrollierte Studie, 7,5–52,5 mg nichtretardiertes 4-AP p. o. |
17 |
|
[40, 41] |
1992/93 |
Doppelblinde, Plazebo-kontrollierte, randomisierte Cross-over-Studie mit 4-AP, Maximaldosis < 0,5 mg/kg KG |
70 |
|
[34] |
1994 |
Randomisierte, doppelblinde, Plazebo-kontrollierte Cross-over-Studie, 10–40 mg 4-AP p. o./Tag |
20 |
|
[2] |
1994 |
Randomisierte, Plazebo-kontrollierte, doppelblinde Cross-over-Studie (Plazebo, hohe und niedrige 4-AP-Serumkonzentration) |
8 |
|
[30] |
1997 |
Einwöchige doppelblinde, Plazebo-kontrollierte Cross-over-Studie, retardiertes 4-AP p. o. |
10 |
|
[28] |
2001 |
6-monatige doppelblinde, Plazebo-kontrollierte, randomisierte Cross-over-Studie, max. 32 mg unretardiertes 4-AP p. o. |
54 |
Der Einsatz von Fampridin war off Label zwar möglich, die zum Teil hohen Kosten jedoch vom Patienten selbst zu tragen. Aufgrund rasch erreichter Spitzenspiegel nach oraler Einnahme von nichtretardiertem Fampridin (s. Abb. 3) traten als relevanteste Nebenwirkungen epileptische Anfälle sowie Bewusstseinsveränderungen ein. Bever et al. konnten nachweisen, dass bei Serumkonzentrationen von >100 ng/ml Fampridin alle Patienten Nebenwirkungen aufwiesen [2]. Eine dosisabhängige Assoziation mit dem Auftreten von epileptischen Anfällen hatte sich ab einem Plasmaspiegel von >40 ng/ml gezeigt. Vor diesem Hintergrund wurde die retardierte Form Fampridin PR („prolonged release“) entwickelt.
Mit Fampridin PR wurden vier Studien durchgeführt (Tab. 2). Die zwei Phase-II-Studien, MS-F201 und MS-F202, wurden 2007 und 2008 von Goodman et al. [9, 10] publiziert. Die 7-wöchige randomisierte, doppelblinde und Plazebo-kontrollierte MS-F201 wurde an 36 Patienten durchgeführt und diente der Dosiseskalation (10 bis 40 mg 2-mal täglich). In der MS-F202 erfolgte über einen Zeitraum von 12 Wochen der Dosisvergleich von 10, 15, 20 mg 2-mal täglich an 206 Patienten. Beide Studien erbrachten eine signifikante Verbesserung der Gehfähigkeit und der Kraft der unteren Extremitäten.
Tab. 2. Klinische Studien zur Wirksamkeit von retardiertem Fampridin (PR [prolonged release]) bei Patienten mit multipler Sklerose
|
Studie |
Studiendesign, Dosierung |
Patienten [n] |
Phase |
|
MS-F201 [9] |
Randomisierte, Plazebo-kontrollierte Studie, bis zu 40 mg Fampridin PR p. o. 2-mal täglich |
36 |
II |
|
MS-F202 [10] |
Randomisierte, Plazebo-kontrollierte Studie, Fampridin PR 10, 15, 20 mg 2-mal täglich |
206 |
II |
|
MS-F203 [11] |
Randomisierte, Plazebo-kontrollierte Studie, 10 mg Fampridin PR p. o. 2-mal täglich |
301 |
III |
|
MS-F204 [12] |
Randomisierte, Plazebo-kontrollierte Studie, 10 mg Fampridin PR p. o. 2-mal täglich |
239 |
III |
In den zwei nachfolgenden Phase-III-Studien, MS-F203 und MS-F204, wurden Wirksamkeit und Sicherheit von Fampridin PR zur Therapie von an multipler Sklerose erkrankten Patienten in der Dosierung von 2-mal 10 mg pro Tag untersucht [35, 36]. Das Design der beiden Phase-III-Studien sowie primäre und sekundäre Endpunkte, in denen insgesamt 540 Patienten randomisiert wurden, sind in Abbildung 4 illustriert.
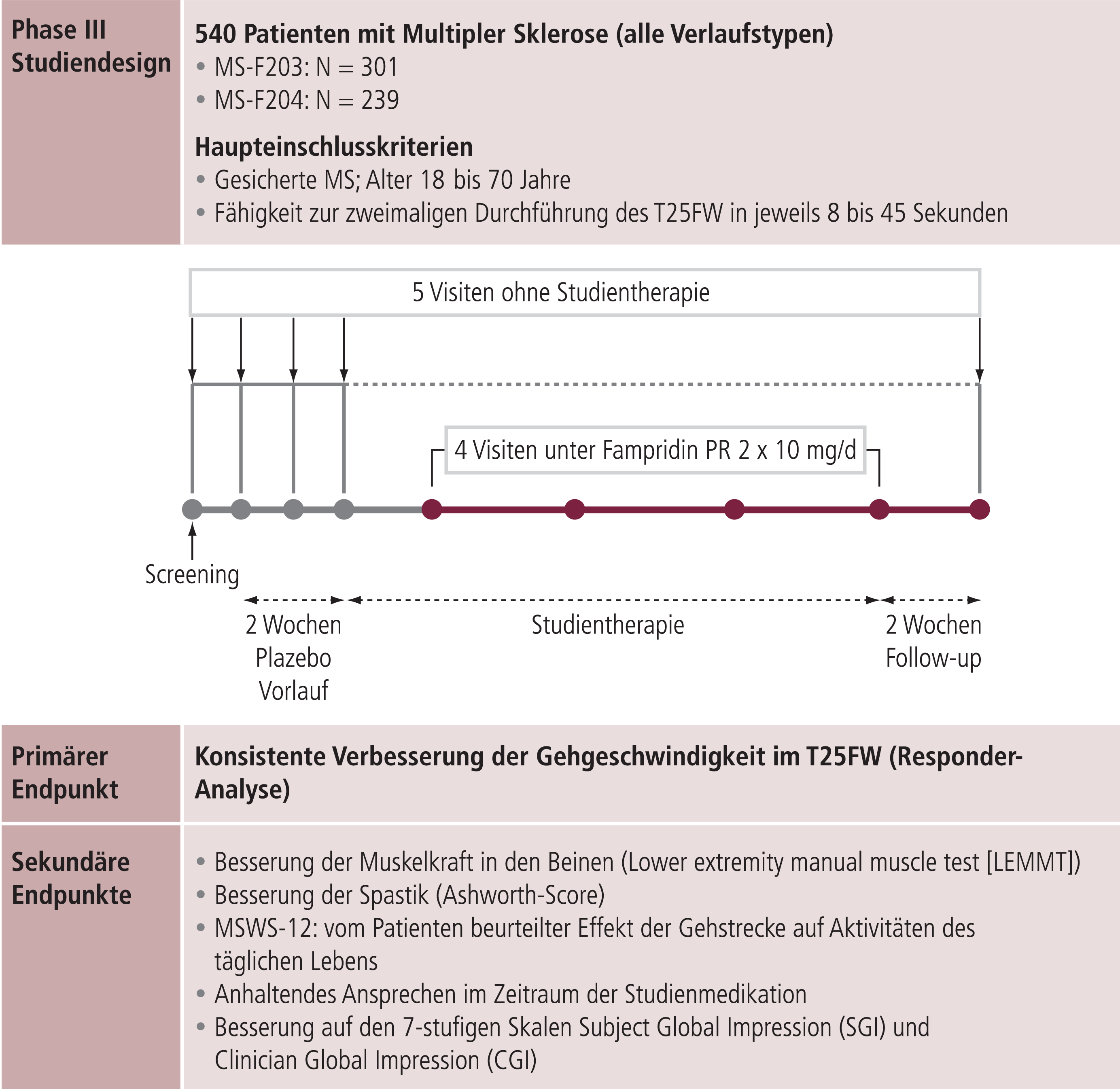
Abb. 4. Design der Phase-III-Studien MS-F203 und MS-F204; die Studientherapie wurde für 14 Wochen (MS-F203) bzw. 9 Wochen (MS-F204) verabreicht (adaptiert nach [36])
Primärer Endpunkt war der Nachweis einer signifikant höheren Gehgeschwindigkeit. Unter Berücksichtigung der hohen Intra- und Interraterreliabilität diente der Timed-25-foot-Walk (T25FW) als Bestandteil des MSFC (Multiple sclerosis functional composite) als Standardtest zur Bewertung des Schweregrads der MS-assoziierten Behinderung im Hinblick auf die Gehfunktion [4]. Um die klinische Relevanz dieses Kriteriums zu validieren, wurden eine primäre Variable (MSWS-12) sowie zwei sekundäre Variablen (SGI, CGI) ergänzt. Die Twelve-Item-MS-Walking-Scale (MSWS-12) dient der Beschreibung des Einflusses der MS auf die Gehfähigkeit und ist ein Fragebogen zur Selbsteinschätzung mit hoher Reliabilität [17]. Höhere Werte stehen für größeren negativen Einfluss der multiplen Sklerose auf das Gehen. Die SGI(Subjective global impression)-Scale ist eine 7-stufige Skala (1=fürchterlich bis 7=erfreut), auf der die Patienten ihre Einschätzung der Effekte der Studienmedikation auf ihr körperliches Wohlbefinden in der vorangegangenen Woche bewerten. Der CGI (Clinician global impression), auf dem die behandelnden Ärzte ihre globale Einschätzung des neurologischen Status und des allgemeinen Gesundheitszustands der Patienten nach versus vor Studientherapie vermerken, ist ebenfalls 7-stufig (1=sehr viel schlechter bis 7=sehr viel besser).
Als sekundäre Endpunkte wurden der Ashworth Score for Spasticity und der Lower Extremity Manual Muscle Test (LEMMT) untersucht. Der Ashworth-Score wird mit einer 4-stufigen Skala (0=keine Zunahme des Muskeltonus bis 4=Rigidität der Extremität bei Beugung oder Streckung) zur Bewertung der Spastizität von je drei Muskelgruppen beider unterer Extremitäten ermittelt. Der LEMMT verwendet eine Skala mit 8 Dimensionen und 5 Stufen (0=Fehlen von Willkürkontraktionen bis 5=normale Muskelkraft) und bewertet die Muskelkraft für jeweils vier Muskelgruppen beider Beine.
Das Patientenkollektiv der beiden Phase-III-Studien bestand aus Patienten mit klinisch sicherer multipler Sklerose aller Verlaufsformen, denen es möglich war, zweimal in Folge den T25FW, also das Abschreiten einer definierten Gehstrecke, innerhalb einer Zeit von 8 bis 45 Sekunden durchzuführen. Als Responder wurde ein Patient definiert, dessen Gehgeschwindigkeit bei mindestens 3 der 4 Visiten unter Studientherapie höher war als die höchste Geschwindigkeit bei den 5 Visiten ohne Studientherapie (s. Abb. 4). Ausschlusskriterien waren unter anderem ein Schub innerhalb von 60 Tagen vor Beginn des Screenings, eine Behandlung mit Prednisolon binnen 30 Tagen vor Screening und epileptische Anfälle in der Vorgeschichte. Nach Screening und einer 2-wöchigen Run-in-Phase erfolgte die 9- bzw. 14-wöchige Therapiephase mit nachfolgendem Wash-out.
Die gepoolte Analyse beider Phase-III-Studien ergab im Hinblick auf demographische sowie Baseline-Charakteristika keine signifikanten Unterschiede. Das mittlere Alter der Patienten betrug 51 Jahre. Bei der Mehrzahl lag eine sekundär chronisch progrediente MS (51%) vor. 30% litten an einer schubförmig-remittierenden multiplen Sklerose und 19% an der primär chronisch progredienten Verlaufsform. Der mediane EDSS(Expanded disability status scale)-Score lag bei 6,0 (1,5–7,0).
In beiden Studien gab es in der Intention-to-treat-Analyse deutlich mehr Responder in der Fampridin-PR- als in der Plazebo-Gruppe (p<0,0001; Abb. 5a und b):
- MS-F203: 34,8% in der Fampridin-PR-Gruppe vs. 8,3% in der Plazebo-Gruppe
- MS-F204: 42,9% in der Fampridin-PR-Gruppe vs. 9,3% in der Plazebo-Gruppe
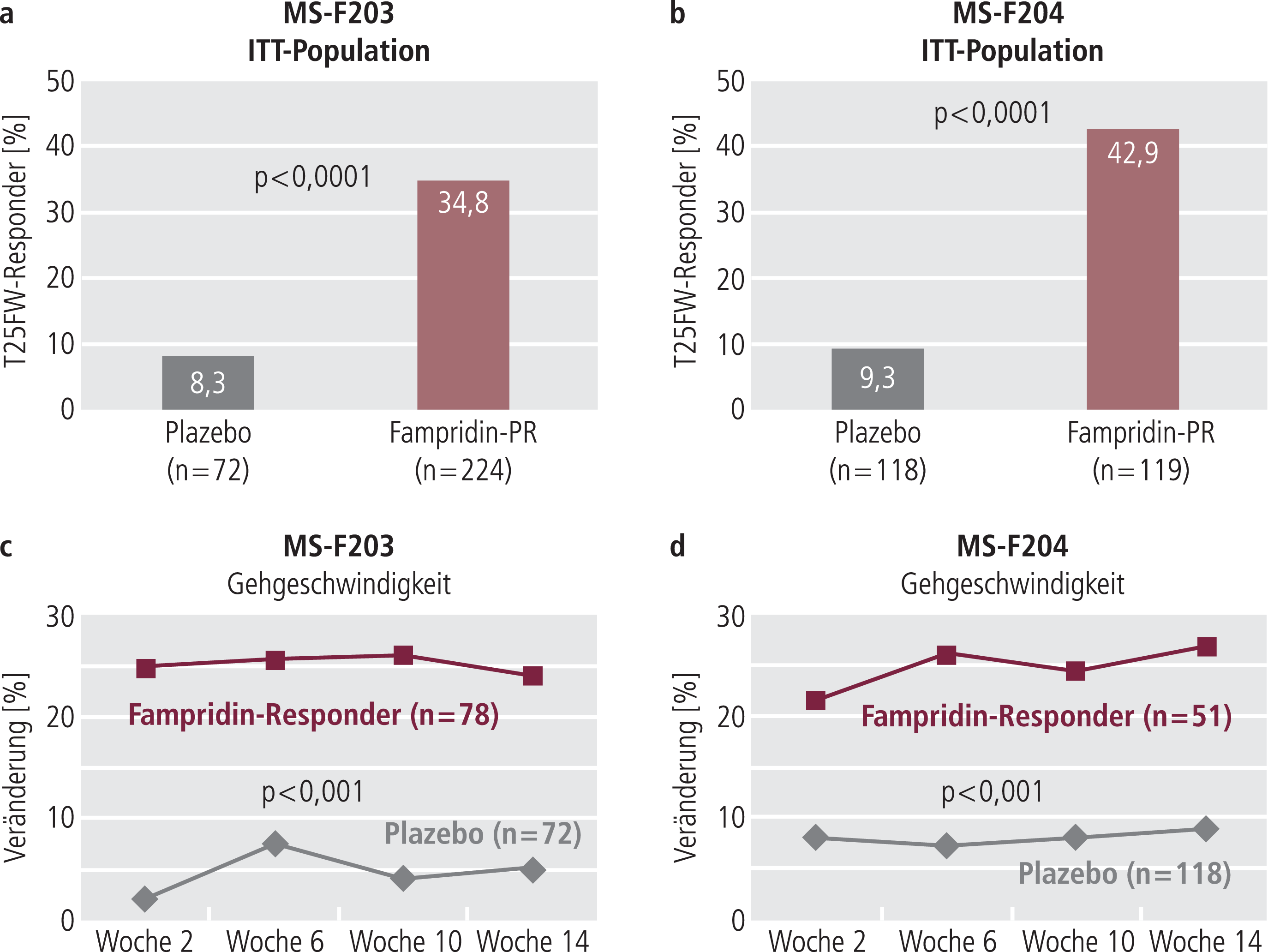
Abb. 5. Anteil der T25FW-Responder in der ITT-Population von MS-F203 und MS-F204 (a, b); Entwicklung der Gehgeschwindigkeit über die Behandlungsdauer (c, d) (adaptiert nach [35, 36]); T25FW: Timed-25-foot-Walk
Insgesamt zeigten in der gepoolten Analyse beider Phase-III-Studien etwa 38% der Patienten in den Fampridin-PR-Gruppen eine konsistente Verbesserung der Gehgeschwindigkeit (T25FW-Responder).
Durchschnittlich erhöhte sich die Gehgeschwindigkeit der Responder unter Fampridin PR um 26,3% vs. 5,3% unter Plazebo (p<0,001) (MS-F203) und um 25,3% vs. 7,8% (p<0,001) (MS-F204) (Abb. 5c, d). Eine Veränderung der Gehgeschwindigkeit um 20% ist in fünf unabhängigen Studien als klinisch relevant definiert worden [18, 22, 23, 32].
In der zur Validierung des primären Endpunkts erhobenen Variablen, dem MSWS-12, konnte bei den Respondern im Vergleich mit Nonrespondern eine signifikant niedrigere durchschnittliche Punktzahl, entsprechend einer reduzierten Gehbehinderung in der Selbstwahrnehmung des Patienten, nachgewiesen werden (Abb. 6). In der MS-F203 betrug die mittlere Änderung des MSWS-12-Scores (p=0,0002) bei Respondern −6,48 (95%-Konfidenzintervall −9,65 bis −4,02), bei Nonrespondern +0,05 (−1,48 bis 1,57) und in der MS-F204 –6,04 (–9,57 bis –2,52) bei den Respondern verglichen mit 0,85 (–0,72 bis 2,43) bei den Nonrespondern (p<0,001). Ergänzend wiesen die Ergebnisse der SGI und CGI auf die Validität des Responderstatus der Patienten hin.
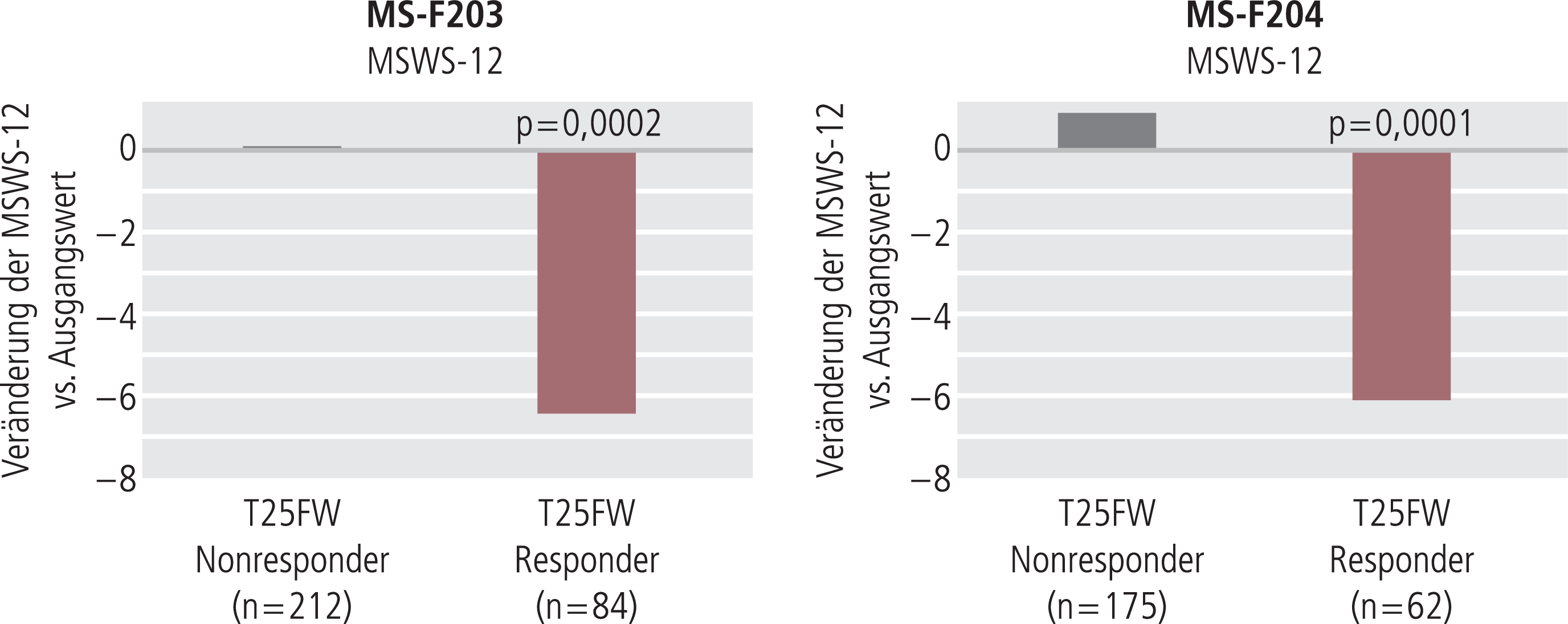
Abb. 6. Reduktion der Gehbehinderung in der MSWS-12 bei T25FW-Respondern vs. Nonrespondern (adaptiert nach [35, 36]); MSWS-12: Twelve-Item-MS-Walking-Scale
Eine Verbesserung der Gehgeschwindigkeit trat rasch innerhalb der ersten zwei Wochen nach Beginn der Behandlung mit Fampridin ein. Dieser Effekt ist nach Absetzen vollständig reversibel, denn bereits in der ersten Follow-up-Visite zwei Wochen nach Beendigung der Behandlungsperiode sank die Gehgeschwindigkeit in der Gruppe der mit Fampridin behandelten Responder wieder auf das Ausgangsniveau (Abb. 7).
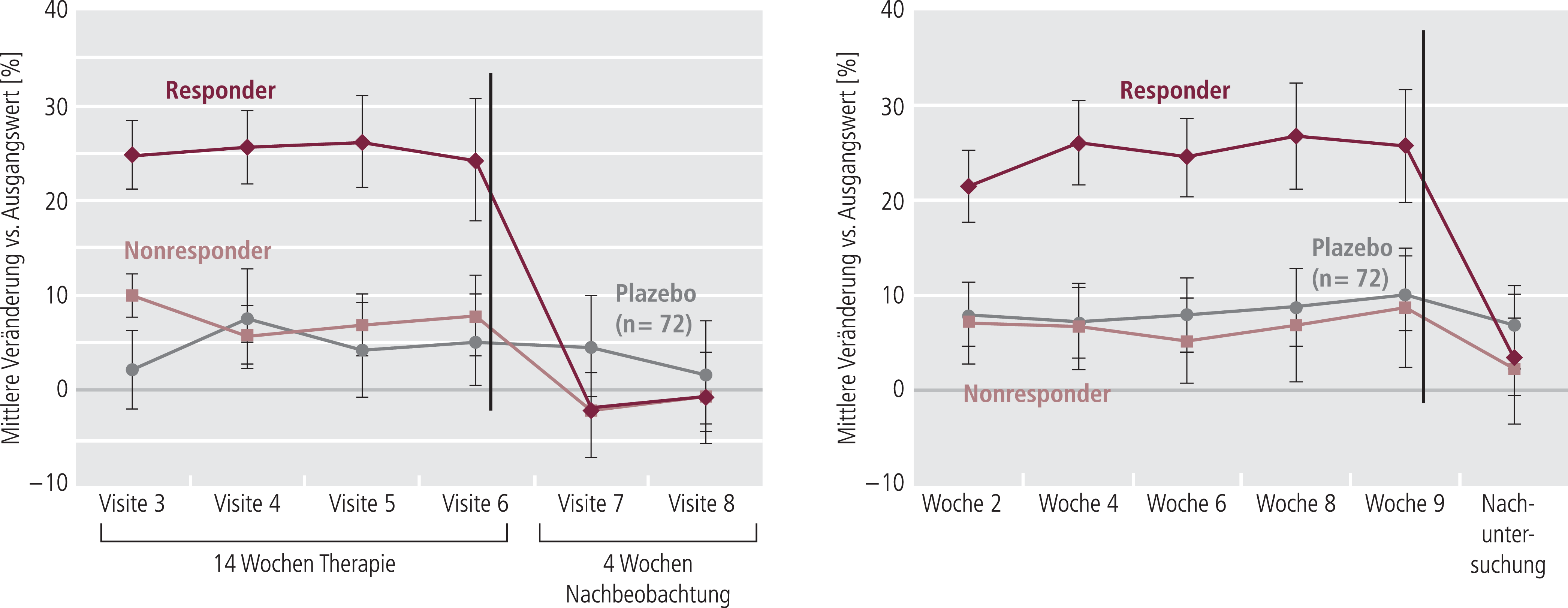
Abb. 7. Wirkung von Fampridin PR auf die Gehfähigkeit und Verlauf nach Absetzen (adaptiert nach [35, 36])
Die konsistenten Effekte unter Fampridin waren darüber hinaus unabhängig vom Verlaufstyp der multiplen Sklerose, das heißt, dass sowohl Patienten mit schubförmiger MS als auch die progredienten Formen profitierten. Eine verlaufsmodifizierende Therapie (disease-modifying treatment) hatten 63% der Patienten beider Phase-III-Studien. Im Hinblick auf den T25FW fand sich ein Ansprechen unabhängig von der immunmodulatorischen Behandlung.
Bezogen auf die sekundären Endpunkte beider Studien konnte mittels des LEMMT sowohl in der Gruppe der Responder als auch in der Gruppe der Nonresponder im Vergleich zur Plazebo-Gruppe eine signifikante Zunahme der muskulären Kraft der unteren Extremitäten während des Behandlungszeitraums nachgewiesen werden (Abb. 8). Mit einer durchschnittlichen Zunahme des Punktwerts um 0,18 (Plazebo-Gruppe 0,04; p=0,0002) war der Effekt unter den Respondern deutlicher nachweisbar als in der Gruppe der Nonresponder (Zunahme des Punktwerts um 0,11 [p=0,046 im Vergleich zur Plazebo-Gruppe]).
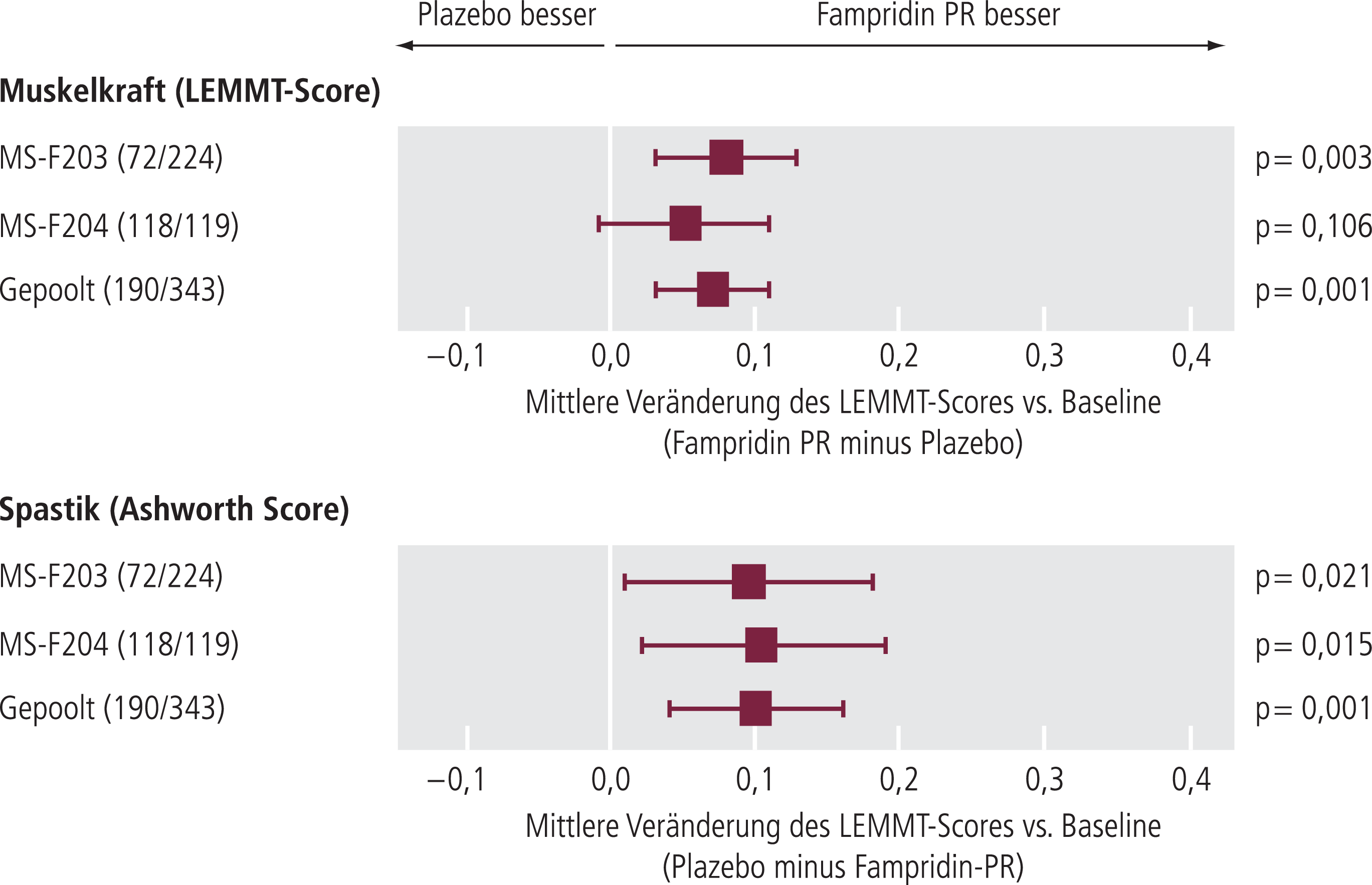
Abb. 8. Relative Änderung vordefinierter Messgrößen für Muskelkraft (LEEMT) und Spastik (Ashworth-Score) der gepoolten Phase-III-Studien [Biogen Idec, Data on file]
Basierend auf gepoolten Daten dreier Studien (MS-F202, MS-F203 und MS-F204) ergab sich im Ashworth Score for Spasticity kein signifikanter Unterschied zwischen der Plazebo-Gruppe, der Fampridin-Responder-Gruppe und der Fampridin-Nonresponder-Gruppe [19]. Demgegenüber zeigten die gepoolten Daten der beiden Phase-III-Studien auch für den Ashworth-Score ein signifikantes Ergebnis in der Gruppe der behandelten Patienten.
Sicherheit und Verträglichkeit
Aufgrund der unter Fampridin dosisabhängigen Blockade von Kv-Kanälen sind unerwünschte Arzneimittelwirkungen zu erwarten, wobei sich ein Zusammenhang zwischen dem Auftreten von schweren Nebenwirkungen und hoher Serumdosis nachweisen ließ [2, 41]. Die in der Vergangenheit durchgeführten Studien mit nichtretardiertem Fampridin gingen mit einem breiten Spektrum an Nebenwirkungen einher und sind an anderer Stelle ausführlich dargestellt [19].
Unter den unerwünschte Arzneimittelwirkungen, die in den Plazebo-kontrollierten Phase-III-Studien an Patienten mit multipler Sklerose, die Fampridin PR in der empfohlenen Dosis erhielten, berichtet wurden, hatten Harnwegsinfekte die höchste Inzidenz (Tab. 3). Da Fampridin keine immunsuppressiven Eigenschaften aufweist, ist das vermehrte Auftreten von Harnwegsinfekten eventuell nur ein scheinbarer Effekt, zumal in der nachfolgenden Urindiagnostik ein Erregernachweis nur selten gelang. Insofern erscheint als alternative Hypothese ein erhöhtes Perzeptionsvermögen der Blasenfüllung und -entleerung bedingt durch die verbesserten elektrophysiologischen Eigenschaften von Nervenfasern, die zur Miktion beitragen, möglich.
Tab. 3. Übersicht über die häufigsten unerwünschten Arzneimittelwirkungen [%] aus den Phase-III-Studien MS-F203 und MS-F203 (adaptiert nach [35, 36])
|
Unerwünschte Arzneimittelwirkungen |
Plazebo (n = 191) |
Fampridin PR (n = 348) |
|
Harnwegsinfektion |
10,5 |
14,9 |
|
Sturz |
16,2 |
14,4 |
|
Schlaflosigkeit |
2,6 |
8,9 |
|
Benommenheit |
2,6 |
8,3 |
|
Kopfschmerzen |
2,6 |
6,9 |
|
Übelkeit |
2,1 |
6,9 |
|
Asthenie |
4,7 |
6,6 |
|
Infektion der oberen Atemwege |
7,9 |
6,0 |
|
Rückenschmerzen |
1,6 |
5,7 |
|
Gleichgewichtsstörungen |
2,1 |
5,7 |
|
Fatigue |
3,1 |
5,2 |
Unter Berücksichtigung der pharmakologischen Wirkung von Fampridin sind darüber hinaus neurologische (Krampfanfälle, Schlaflosigkeit, Angst, Gleichgewichtsstörungen, Schwindel, Parästhesien, Tremor, Kopfschmerzen und Asthenie) sowie vegetative (kardiale Arrhythmien, arterielle Hypertonie) Nebenwirkungen beobachtet worden. Unter Kenntnis der bei höherer Dosierung von nichtretardiertem Fampridin bestehenden prokonvulsiven Wirkung waren Patienten mit epileptischem Anfall in der Vorgeschichte konsequent von der Behandlung ausgeschlossen. Darunter ergab sich in den Studien MS-F203 und MS-F204 keine erhöhte Inzidenz von epileptischen Anfällen. Sowohl unter Plazebo (n=234) als auch unter 2-mal 10 mg Fampridin PR (n=400) trat jeweils ein epileptischer Anfall auf [11, 12]. Aktuell bestehen keine Hinweise auf eine Zunahme des Risikos mit der Therapiedauer.
Zusammengefasst war Fampridin PR in den klinischen Studien generell gut verträglich. Es fand sich eine geringe Rate an Abbrüchen wegen unerwünschter Arzneimittelwirkungen (UAW) in den Studien mit Fampridin PR 10 mg (2,8%) vs. Plazebo (2,1%). Die Mehrzahl der UAW war gering bis moderat ausgeprägt und führte nicht zum Therapieabbruch. Die Therapie mit Fampridin PR stellt jedoch hohe Anforderungen an die Compliance des Patienten [19], und das Risiko einer akzidentellen Intoxikation ist prinzipiell gegeben. Selbstständig vom Patienten durchgeführte Dosismodifikationen sind abzulehnen.
Zusammenfassung und Ausblick
Mit der Entwicklung der retardierten Form des Kaliumkanablockers Fampridin ergibt sich ein relevanter Fortschritt in der symptomatischen Behandlung der multiplen Sklerose. Eine Verbesserung der Gehfähigkeit lässt sich durch Fampridin mitunter auch bei paroxysmal, d.h. plötzlich während des Gehens auftretender Schwäche erzielen. Ein entscheidender Vorteil gegenüber nicht retardiertem Fampridin besteht (im historischen Vergleich) in der deutlich besseren Verträglichkeit. In den mit Fampridin PR durchgeführten Studien hatten die Patienten der Behandlungsgruppen gegenüber Plazebo signifikant bessere Therapieergebnisse. Responder im T25FW zeigten eine Verbesserung der Gehgeschwindigkeit um durchschnittlich 25% sowie eine signifikante Reduktion wahrgenommener Gehbehinderung (> 6 Punkte im MSWS-12). Der T25FW weist eine Vielzahl methodischer Vorteile auf und gilt als eines der sensitivsten und am besten reproduzierbaren Instrumente zur Messung der Gehfähigkeit [4]. Darüber hinaus konnten Korrelationen des T25FW mit der maximalen Gehstrecke [5], der Ausdauer im 6-Minuten-Gehtest [1, 8, 31], der muskulären Kraft [37, 38] sowie der subjektiven Beurteilung der Gehfähigkeit durch MS-Patienten [26] nachgewiesen werden.
Der Nutzen von Fampridin PR war unabhängig vom Verlaufstyp der multiplen Sklerose, dem Behinderungsgrad und der begleitenden immunmodulatorischen Therapie. Unklar bleiben bisher – basierend auf den vorliegenden Daten – eventuelle prädisponierende Faktoren auf ein Ansprechen. So wurden unter Berücksichtigung individueller Besonderheiten in der Pathophysiologie der entzündlichen Läsionen [25] mögliche Zusammenhänge mit dem Ausmaß der axonalen Schädigung erwogen [19].
Fampridin ist zur Verbesserung der Gehfähigkeit von erwachsenen Patienten mit multipler Sklerose (MS) mit Gehbehinderung indiziert (EDSS 4–7). Die empfohlene Dosis beträgt je eine 10-mg-Retardtablette zweimal täglich, im Abstand von 12 Stunden. Eine Kontraindikation liegt für alle Stadien der Niereninsuffizienz vor. Fampridin PR wurde von der europäischen Zulassungsbehörde unter „besonderen Bedingungen“ zugelassen. Weitere Nachweise für den Nutzen, der über die Wirkungen auf die Gehgeschwindigkeit hinausgeht, und in Bezug auf die frühe Erkennung von Respondern werden erwartet. Aktuell ist die Erstverordnung auf zwei Wochen begrenzt. Danach sollte zur Beurteilung von Verbesserungen ein Gehtest mit Messung der Gehgeschwindigkeit durchgeführt werden. Wenn hier kein Ansprechen erkennbar ist, sollte Fampridin abgesetzt werden.
Inwiefern weitere MS-Symptome, wie Fatigue, Nystagmus oder Blasenentleerungsstörungen, auf die Therapie mit retardiertem Fampridin ansprechen, lässt sich gegenwärtig nicht sicher beurteilen. Zukünftige Studien, die diesen Fragen nachgehen, sind in Planung.
Interessenkonflikterklärung
Der korrespondierende Autor gibt an, dass kein Interessenkonflikt besteht. Raimar Kempcke hat ebenfalls keinen Interessenkonflikt. Tjalf Ziemssen erhielt Projektunterstützung und Vortragshonorare von Bayer, Biogen Idec, Genzyme, GSK, Merck Serono, Novartis, Roland Ernst Stiftung, Hertie Stiftung, Sanofi, Synthon und Teva.
Literatur
1. Albrecht H, Wötzel C, Erasmus LP, Kleinpeter M, et al. Day-to-day variability of maximum walking distance in MS patients can mislead to relevant changes in the Expanded Disability Status Scale (EDSS): average walking speed is a more constant parameter. Mult Scler 2001;7:105–9.
2. Bever CT Jr, Young D, Anderson PA, et al. The effects of 4-aminopyridine in multiple sclerosis patients: results of a randomized, placebo-controlled, double-blind, concentration-controlled, crossover trial. Neurology 1994;44:1054–9.
3. Bostock H, Sears TA, Sherratt RM. The effects of 4-aminopyridine and tetraethylammonium ions on normal and demyelinated mammalian nerve fibres. J Physiol 1981;313:301–15.
4. Cohen JA, Fischer JS, Bolibrush DM, Jak AJ, et al. Intrarater and interrater reliability of the MS functional composite outcome measure. Neurology 2000;54:802–6.
5. Créange A, Serre I, Levasseur M, Audry D, et al. Walking capacities in multiple sclerosis measured by global positioning system odometer. Mult Scler 2007;13:220–3.
6. Davis FA, Stefoski D, Rush J. Orally administered 4-aminopyridine improves clinical signs in multiple sclerosis. Ann Neurol 1990;28:589.
7. Devaux J, Beeton C, Béraud E, Crest M. Ion channels and demyelination: basis of a treatment of experimental autoimmune encephalomyelitis (EAE) by potassium channel blockers. Rev Neurol 2004;160:16–27.
8. Goldman MD, Marrie RA, Cohen JA. Evaluation of the six-minute walk in multiple sclerosis subjects and healthy controls. Mult Scler 2008;14:383–90.
9. Goodman AD, Cohen JA, Cross A, et al. Fampridine-SR in multiple sclerosis: a randomized, double-blind, placebo-controlled, dose-ranging study. Mult Scler 2007;13:357–68.
10. Goodman AD, Brown TR, Cohen JA, et al. Dose comparison trial of sustained-release fampridine in multiple sclerosis. Neurology 2008;71:1130–1.
11. Goodman AD, Brown TR, Krupp LB, et al., Fampridine MS-F203 investigators. Sustained-release oral fampridine in multiple sclerosis: a randomised, double-blind, controlled trial. Lancet 2009;373:732–8.
12. Goodman AD, Brown TR, Edwards KR, Krupp LB, et al., MSF204 investigators. A phase 3 trial of extended release oral dalfampridine in multiple sclerosis. Ann Neurol 2010;68:494–502.
13. Halper J, Ross AP. NARCOMS database. Challenges in the treatment of mobility loss and walking impairment in multiple sclerosis. Int J MS Care 2010;12:13–6.
14. Harris Interactive. Experiences with multiple sclerosis (MS): Perspectives of people with MS and MS care partners [poll]. March 25, 2008.
15. Hayes KC. The use of 4-aminopyridine (fampridine) in demyelinating disorders. CNS Drug Rev 2004;10:295–316.
16. Heesen C, Böhm J, Reich C, Kasper J, et al. Patient perception of bodily functions in multiple sclerosis: gait and visual function are the most valuable. Mult Scler 2008;14:988–91.
17. Hobart JC, Riazi A, Lamping DL, Fitzpatrick R, et al. Measuring the impact of MS on walking ability: the 12-Item MS Walking Scale (MSWS-12). Neurology 2003;60:31–6.
18. Hoogervorst EL, Kalkers NF, Cutter GR, Uitdehaag BM, et al. The patient’s perception of a (reliable) change in the multiple sclerosis functional composite. Mult Scler 2004;10:55–60.
19. Husseini L, Leussink VI, Kieseier BC, Hartung HP. 4-Aminopyridin (Fampridin). Nervenarzt 2010;81:203–11.
20. Jones CA, Pohar SL, Warren S, Turpin KV, et al. The burden of multiple sclerosis: a community health survey. Health Qual Life Outcomes 2008;6:1.
21. Jones RE, Heron JR, Foster DH, et al. Effects of 4-aminopyridine in patients with multiple sclerosis. J Neurol Sci 1983;60:353–62.
22. Kaufman M, Moyer D, Norton J. The significant change for the timed 25-foot walk in the multiple sclerosis functional composite. Mult Scler 2000;6:286–90.
23. Kragt JJ, van der Linden FA, Nielsen JM, Uitdehaag BM, et al. Clinical impact of 20% worsening on timed 25-foot walk and 9-hole peg test in multiple sclerosis. Mult Scler 2006;12:594–8.
24. Madsen LS, Christophersen P, Olesen PS. Blockade of Ca2+-activated K+-channels in T-cells: an option for the treatment of multiple sclerosis? Eur J Immunol 2005;35:1023–6.
25. Mahad DJ, Trapp BD, Ransohoff RM. Tissue pathology of multiple sclerosis. In: Antel J, Birnbaum G, Hartung HP, Vincent A (eds.). Clinical Neuroimmunology. 2nd edition. New York: Oxford Univ, 2005:173–83.
26. McGuigan C, Hutchinson M. Confirming the validity and responsiveness of the Multiple Sclerosis Walking Scale-12 (MSWS-12). Neurology. 2004;62:2103–5.
27. Mobility in MS Research: Patient Perspectives. Data on File. Biogen Idec, 2010.
28. Rossini PM, Pasqualetti P, Pozzilli C, et al. Fatigue in progressive multiple sclerosis: results of a randomized, double-blind, placebo-controlled, crossover trial of oral 4-aminopyridine. Mult Scler 2001;7:354–8.
29. Salter A, et al. Impact of loss of mobility on instrumental activities of daily living and socioeconomic status in patients with MS. Curr Med Res Opin 2010;26:493–500.
30. Schwid SR, Petrie MD, McDermott MP, et al. Quantitative assessment of sustained-release 4-aminopyridine for symptomatic treatment of multiple sclerosis. Neurology 1197;48:817–21.
31. Schwid SR, Goodman AD, Mattson DH, Mihai C, et al. The measurement of ambulatory impairment in multiple sclerosis. Neurology 1997;49:1419–24.
32. Schwid SR, Goodman AD, McDermott MP, Bever CF, et al. Quantitative functional measures in MS: what is a reliable change? Neurology 2002;58:1294–6.
33. Sherratt RM, Bostock H, Sears TA. Effects of 4-aminopyridine on normal and demyelinated mammalian nerve fibres. Nature 1980;283:570–2.
34. Smits RC, Emmen HH, Bertelsmann FW, et al. The effects of 4-aminopyridine on cognitive function in patients with multiple sclerosis: a pilot study. Neurology 1994;44:1701–5.
35. Stefoski D, Davis FA, Faut M, Schauf CL. 4-Aminopyridine improves clinical signs in multiple sclerosis. Ann Neurol 1987;21:71–7.
36. Stefoski D, Davis FA, Fitzsimmons WE, et al. 4-Aminopyridine in multiple sclerosis: prolonged administration. Neurology 1991;41:1344–8.
37. Thoumie P, Mevellec E. Relation between walking speed and muscle strength is affected by somatosensory loss in multiple sclerosis. J Neurol Neurosurg Psychiatry 2002;73:313–5.
38. Thoumie P, Lamotte D, Cantalloube S, Faucher M, et al. Motor determinants of gait in 100 ambulatory patients with multiple sclerosis. Mult Scler 2005;11:485–91.
39. van Asch P. Impact of mobility impairment in multiple sclerosis 2 – Patients’ perspectives. Eur Neurol Rev 2011;6:115–20.
40. van Diemen HA, Polman CH, van Dongen TM, van Loenen AC, et al. The effect of 4-aminopyridine on clinical signs in multiple sclerosis: a randomized, placebo-controlled, double-blind, cross-over study. Ann Neurol 1992;32:123–30.
41. van Diemen HA, Polman CH, Koetsier JC, Van Loenen AC, et al. 4-Aminopyridine in patients with multiple sclerosis: dosage and serum level related to efficacy and safety. Clin Neuropharmacol 1993;16:195–204.
42. van Winsen LM, Kragt JJ, Hoogervorst EL, Polman CH, et al. Outcome measurement in multiple sclerosis: detection of clinically relevant improvement. Mult Scler 2010;16:604–10.
43. Vollmer T, Henney HR 3rd. Pharmacokinetics and tolerability of single escalating doses of fampridine sustained-release tablets in patients with multiple sclerosis: a phase I-II, open-label trial. Clin Ther 2009;31:2206–14.
44. Wu ZZ, Li DP, Chen SR, Pan HL. Aminopyridines potentiate synaptic and neuromuscular transmission by targeting the voltage-activated calcium channel beta subunit. J Biol Chem 2009;284:36453–61.
Dr. med. Thorsten Schultheiß, Raimar Kempcke, Prof. Dr. med. Tjalf Ziemssen, Universitätsklinik Carl Gustav Carus, Klinik und Poliklinik für Neurologie, Fetscherstraße 74, 01307 Dresden, E-Mail: Thorsten.Schultheiss@uniklinikum-dresden.de
Die Psychopharmakotherapie im Internet:
Für Abonnenten mit Volltextzugriff!
Fampridine improves walking ability in multiple sclerosis
Fampridine (4-aminopyridine) is a voltage-dependent potassium channel blocker that has been approved in Europe for symptomatic treatment of patients suffering from walking impairment due to multiple sclerosis (MS). The application of fampridine is restricted to MS patients with ambulatory impairment covering an EDSS (expanded disability status scale) range from 4–7. It can be used in relapsing-remitting and progressive disease types, respectively. The extended-release formulation of fampridine has been shown in two phase-III clinical trials to improve walking speed in approximately one third of MS patients with ambulatory impairment. As primary endpoint, an average 25% increase in walking speed in these patients who received the drug and met the prescribed criteria for consistent responders has been found. Efficacy can usually be seen within the first two weeks of treatment and is demanded by health insurances.
Key words: Multiple Sclerosis, walking disability, mobility, fampridine
Psychopharmakotherapie 2012; 19(02)
