Frank Häßler, Alexander Dück, Olaf Reis und Johannes Buchmann, Rostock
ADHS ist eine der häufigsten neurobiologisch begründeten Verhaltensstörungen im Kindes- und Jugendalter, wobei bei 35 bis 50% aller Betroffenen mehr oder weniger Symptome in das Erwachsenenalter fortdauern [57].
Abhängig von den zugrunde gelegten Klassifikationssystemen ergibt sich in der Altersgruppe der 4- bis 17-Jährigen nach DSM-IV eine Prävalenz von 2 bis 7% und nach den strengeren ICD-10-Kriterien eine Prävalenz von 1 bis 2% [64]. In Deutschland liegt nach neuesten Erhebungen für Kinder und Jugendliche bis zum 17. Lebensjahr eine mittlere Prävalenz von 3,9% vor [39].
Aufgrund einer Dysregulation des dopaminergen und noradrenergen Neurotransmittersystems in verschiedensten Hirnstrukturen kommt einer entsprechenden medikamentösen Therapie der ADHS eine fundamentale Bedeutung zu. Die weltweit am häufigsten eingesetzten Psychopharmaka sind Stimulanzien, die sowohl die vesikuläre Dopamin-Freisetzung als auch die durch den Dopamin-Transporter (DAT) gesteuerte Dopamin-Aufnahme und die enzymatische Inaktivierung beeinflussen, und der selektive noradrenerge Wiederaufnahmehemmer Atomoxetin [69]. Sowohl in aktuellen US-amerikanischen als auch deutschen Publikationen finden neben Stimulanzien und Atomoxetin nur noch Antidepressiva und Alpha-Agonisten Berücksichtigung. Da rund 30% aller ADHS-Betroffenen von den etablierten medikamentösen Therapiestrategien nicht ausreichend profitieren [23], Stimulanzien und Atomoxetin im Einzelfall die Akzeptanz limitierende Nebenwirkungen aufweisen und im versorgungsrelevanten Praxisalltag eine Vielzahl alternativer Substanzen zum Einsatz kommt, soll auf diese „Alternativen“ wie Antidepressiva, Neuroleptika, Alpha-Agonisten, Betablocker, Buspiron, Zinksalze, Magnesiumsalze, Fettsäurensubstitution, Levodopa und Homöopathie im Folgenden näher eingegangen werden.
Antidepressiva
Trizyklische Antidepressiva (TZA)
Trizyklische Antidepressiva zählen zwar nicht zu den Mitteln der ersten Wahl bei ADHS, haben aber in zahlreichen doppelblinden, Plazebo-kontrollierten Studien in Bezug auf die Wirkung bei hyperaktiv-impulsivem Verhalten sowohl bei Kindern als auch Erwachsenen ihre Gleichwertigkeit gegenüber Stimulanzien bewiesen und gehörten fast 40 Jahre zur Standardtherapie [53]. Während die tertiären Amine (Imipramin und Amitriptylin) eher selektiv auf den Serotonin-(5-HT-)Transporter als auf den Noradrenalin-Transporter wirken, ist es bei den sekundären Aminen (Desipramin und Nortriptylin) genau umgekehrt. Darüber hinaus sprechen trizyklische Antidepressiva vor allem histaminerge und cholinerge Rezeptoren an. Wegen kardiotoxischer Wirkungen bis hin zum plötzlichen Herztod (insbesondere unter Desipramin) ist eine engmaschige Kontrolle von EKG, Blutdruck und Pulsfrequenz erforderlich. Um das Nebenwirkungsrisiko zu minimieren, ist eine individuelle Dosisfindung unterhalb der Maximaläquivalentdosis von Imipramin (5 mg/kg KG pro Tag) über zwei Wochen angezeigt.
Trizyklische Antidepressiva stellen eine Option bei komorbiden Störungen mit Symptomen wie Angst, Depression und Dysphorie dar, darüber hinaus Imipramin bei einer komorbiden Enuresis und Desipramin bei komorbiden Tics. Ihre Wirkung auf die vorrangig expansiven Symptome von ADHS ist unabhängig von ihrer antidepressiven Wirkung.
An Nebenwirkungen stehen Tachykardie, QRS- und QTc-Verlängerung, Blutdrucksenkung oder auch Blutdruckerhöhung, Müdigkeit, Mundtrockenheit, Senkung der Krampfschwelle, Gewichtszunahme, Kopfschmerzen, gastrointestinale Phänomene, Schlafstörungen und sexuelle Dysfunktion im Vordergrund. Da es keine gesicherte Korrelation zwischen Blutspiegeln und Wirksamkeit gibt, ist ein routinemäßiges therapeutisches Drug-Monitoring nicht erforderlich.
MAO-Hemmer
Seit Einführung des reversiblen selektiven Monoaminoxidasehemmers Moclobemid, der gut verträglich und ohne diätetische Einschränkungen anwendbar ist, gibt es trotz guter Effekte auf die Hyperaktivität und Frustrationsintoleranz bei geringem Nebenwirkungsrisiko nur wenige Studien, in denen MAO-Hemmer bei ADHS zum Einsatz kamen [5, 62]. Besonders bei Behandlungsbeginn können MAO-Inhibitoren Unruhe, Übelkeit und Schlaflosigkeit provozieren. Das Absetzen sollte wegen der Gefahr eines Entzugssymptoms immer ausschleichend erfolgen.
Venlafaxin
Aufgrund der noradrenergen Modulation gab es Mitte der 90er Jahre Fallberichte und offene Studien zur Wirksamkeit des Serotonin- und Noradrenalin-Wiederaufnahmehemmers Venlafaxin in der Behandlung von Erwachsenen mit ADHS. Während Findling et al. [25] bei sieben von neun Patienten eine signifikante Symptomreduktion nachweisen konnte, lagen die Ansprechraten in anderen Studien deutlich unter 50% [1, 36]. 25 bis 40% wiesen schwer zu tolerierende Nebenwirkungen wie Blutdrucksteigerung, Müdigkeit, Agitiertheit und Übelkeit auf. Venlafaxin hat keine Zulassung für Kinder und Jugendliche und sollte in diesem Altersspektrum für diese Indikation auch nicht off Label eingesetzt werden.
Bupropion
Bupropion fungiert als atypisches Antidepressivum, ist ein indirekter Dopamin- und Noradrenalin-Agonist und erhöht die noradrenerge Bioverfügbarkeit [69]. Es hat sowohl einen antidepressiven als auch antimanischen Effekt. Bupropion steht als „Immediate release“(IR)-, „Sustained release“(SR)- und „Extended release“(XL)-Formulierung zur Verfügung. In offenen und kontrollierten Studien zeigte es konsistent schlechtere Wirkungen auf die ADHS-Symptomatik bei Kindern und Erwachsenen als Methylphenidat [8, 14, 17, 67]. Aufgrund seiner antidepressiven Wirkung könnte Bupropion bei der Kombination von ADHS und bipolaren Störungen eine viel versprechende Alternative im Erwachsenenalter sein. Eine erste Studie legt eine solche Annahme nahe. Wilens et al. [68] untersuchten 36 erwachsene Patienten mit ADHS und bipolaren Störungen vom Typ I und II (Ø Alter 34 Jahre) über sechs Wochen (Dosis bis 2-mal 100 mg/d). Es konnte eine Reduktion auf der ADHS-Symptom-Checkliste um bis zu 55% (p<0,001) und auf der CGI-S-ADHD um bis zu 40% (p<0,001) erreicht werden. An Nebenwirkungen standen Kopfschmerzen (36%), Schlafstörungen (31%), Mundtrockenheit (25%), Schwindel (14%), Muskelschmerzen (14%) und Appetitverlust (11%) im Vordergrund. Auch bei der Doppeldiagnose ADHS und Substanzmissbrauch hat sich Bupropion als effizient und nebenwirkungsarm erwiesen [58].
Da Bupropion über Cytochrom P450 (CYP) verstoffwechselt wird, besteht die Gefahr, dass Inhibitoren von CYP2B6 und CYP2D6 wie selektive Serotonin-Wiederaufnahmehemmer (SSRI), Phenothiazine, Valproinsäure, Venlafaxin, Acetylsalicylsäure und Phenytoin zu einer Überdosierung mit der Gefahr prolongierter Krampfanfälle, Tachykardie, Herzstillstand, Schwindel und Erbrechen führen können.
Kontraindikationen für den Einsatz von Bupropion sind Epilepsie, Ticstörung und Lebererkrankungen [38]. Die Auftretenswahrscheinlichkeit von Nebenwirkungen ist unter einer SR-Formulierung geringer. Die maximale Tagesdosis sollte 400 mg nicht überschreiten.
Buspiron
Das Anxiolytikum Buspiron ist ein kompletter Agonist präsynaptischer 5-HT1A-Rezeptoren und ein partieller Agonist an postsynaptischen 5-HT1A-Rezeptoren. Darüber hinaus blockiert Buspiron präsynaptische Dopamin-Rezeptoren und fungiert als partieller Agonist alpha-adrenerger Rezeptoren [15]. Neben dem Einsatz bei Angststörungen und oppositionell auffälligem Verhalten bei Kindern und Jugendlichen erwies sich Buspiron in einigen offenen Studien als sehr wirksam bei reiner ADHS, ADHS mit einer Störung des Sozialverhaltens und ADHS mit zusätzlicher emotionaler Störung. Bei Tagesdosen zwischen 15 und 60 mg lagen die Ansprechraten zwischen 70 und 90% [32, 45]. Wenn überhaupt, dann werden geringe Nebenwirkungen wie Schwindel, Kopfschmerzen, Müdigkeit und Gewichtszunahme beschrieben.
Alpha2-Agonisten (Clonidin und Guanfacin)
Die zwei Alpha2-Agonisten Clonidin und Guanfacin zählen neben Stimulanzien und Atomoxetin zu den am häufigsten eingesetzten Substanzen bei ADHS. In einer groß angelegten Studie wurden 24874 Patienten mit ADHS unter 18 Jahren erfasst, von denen 9,6% irgendwann einmal und 4,3% in den letzten zwei Monaten Clonidin erhalten hatten. Die auf Clonidin eingestellten Patienten waren im Durchschnitt jünger, männlich, dem hyperaktiv-impulsiven Subtyp zuzuordnen und wiesen mehr komorbide Störungen wie Tics, oppositionell deviantes Verhalten und Schlafstörungen auf [42].
Clonidin ist ein präsynaptischer alpha2-adrenerger Agonist und vermindert die Noradrenalin-Ausschüttung aus dem Nucleus coeruleus. In einer Metaanalyse von elf Studien der Jahre 1980 bis 1999 betrug die mittlere Effektstärke von Clonidin 0,6 bezüglich einer ADHS-Symptomatik [19]. Clonidin wird häufig in Kombination mit Methylphenidat eingesetzt [35]. So fanden Hazell et al. [34] bei 19% der untersuchten Population eine solche Kombination, obwohl es gerade darunter zu Todesfällen kommen kann, wie Cantwell et al. [13] und Popper [52] beschrieben. Die empfohlene Dosierung liegt für Kinder bei 3 bis 5 μg/kg pro Tag in zwei Einzeldosen und für Erwachsene bei 5 bis 8 μg/kg pro Tag (0,05–0,3 mg/d), verteilt auf 4 bis 6 Einzeldosen, was die Praktikabilität erheblich einschränkt.
In allen Studien stand Müdigkeit als Nebenwirkung an erster Stelle, gefolgt von Unruhe, Blutdruckabfall, Schlafstörungen (nächtliches Erwachen), Mundtrockenheit, Schwindel und depressiven Verstimmungen. Beim Einsatz des Transdermalpflasters klagten 50% aller Patienten über Hautreaktionen. Trotz bekannter EKG-Veränderungen (Bradykardie, PR-Intervall-Verlängerung) wurden in nur drei Studien EKG-Kontrollen durchgeführt.
Guanfacin wirkt ebenso wie Clonidin eher auf hyperaktiv-impulsives sowie aggressives Verhalten und weniger auf Aufmerksamkeitsdefizite. Die empfohlene Dosierung schwankt zwischen 0,5 und 4,0 mg/d [30], verteilt auf ein bis zwei Einzeldosen [53].
Die zu erwartenden Nebenwirkungen sind ähnlich wie unter Clonidin, wobei Guanfacin weniger sediert und weniger Kreislaufprobleme verursacht. Dafür treten häufiger Agitiertheit und Kopfschmerzen auf.
Bei Patienten, die auf Alpha2-Agonisten eingestellt werden sollen, bedarf es einer sorgfältigen Familienanamnese hinsichtlich Herz-Kreislauf-Erkrankungen. Kardiale Arrhythmie und Major Depression sind absolute Kontraindikationen. Nierenfunktionsstörungen stellen eine relative Kontraindikation dar. Um Rebound-Phänomene zu vermeiden, dürfen weder Clonidin noch Guanfacin abrupt abgesetzt werden. Blutdruckkrisen können bis zu zwei Wochen nach dem Absetzen auftreten [38].
Betablocker (Pindolol, Propranolol)
Pindolol ist ein lipophiler, nicht selektiver, zentral aktiver Betablocker. Es beeinflusst sowohl das adrenerge System als auch die Dopamin-Freisetzung im limbischen System. Nicht nur in präklinischen Studien bei Ratten bewirkte Pindolol eine Abnahme der Hyperaktivität und des aggressiven Verhaltens bei gleichzeitig verstärkendem Effekt auf die Bereitschaft zur sozialen Interaktion, sondern auch bei Menschen mit geistiger Behinderung, organischen Psychosyndromen und tiefgreifenden Entwicklungsstörungen [18]. Trotz vergleichbarer Wirksamkeit von Pindolol (20 mg/d) und Methylphenidat (10 mg/d) auf die ADHS-Symptomatik bei 7 bis 13 Jahre alten Kindern musste die Behandlung mit Pindolol wegen des Auftretens gravierender Nebenwirkungen wie Parästhesien, Alpträumen und Halluzinationen bei 60% der behandelten Patienten abgebrochen werden [11]. Aufgrund dieser vorliegenden Erfahrungen ist von einem generellen Einsatz bei der Behandlung hyperkinetischer Störungen im Kindes- und Jugendalter abzuraten.
Bei Erwachsenen mit ADHS kam es unter einer relativ hohen Dosis von über 500 mg/d Propranolol zu einer Reduktion von Wutausbrüchen [48]. Über gravierende Nebenwirkungen liegen aus dieser Studie keine Berichte vor. Relative Kontraindikationen für den Einsatz von Betablockern sind Depression, Asthma bronchiale, Diabetes mellitus und Herz-Kreislauf-Erkrankungen.
Levodopa
Der hypodopaminergen Hypothese folgend, wäre ein therapeutischer Effekt beim Einsatz von Levodopa oder Dopaminagonisten zu erwarten. Doch weder der Dopaminagonist Amantadin [47], noch Carbidopa/Levodopa [44] bewirkten eine signifikante Verbesserung der Hypermotorik, des Aufmerksamkeitsverhaltens oder der Impulsivität. In einer neueren doppelblinden randomisierten Studie konnten Overtoon et al. [51] keinerlei Effekt von Levodopa auf die Aufmerksamkeit, das Inhibitionsverhalten oder die Prozesse der Informationsverarbeitung bei 16 Kindern mit ADHS zeigen.
Neuroleptika
Konventionelle Neuroleptika
Im Vergleich zu den Stimulanzien spielen Neuroleptika in der Therapie des ADHS eine untergeordnete Rolle, was einerseits mit der Gefahr extrapyramidal-motorischer Nebenwirkungen und der gefürchteten tardiven Dyskinesie unter Neuroleptika zusammenhängen dürfte und andererseits mit dem Paradigmenwechsel in der Wichtung der Symptome des ADHS, das heißt der zunehmenden Priorisierung der Aufmerksamkeitsstörung. Neuroleptika besitzen in tranquilisierenden Dosen einen antriebsdämpfenden, affektiv ausgleichenden und antiaggressiven Effekt, wirken sich aber häufig negativ auf kognitive Funktionen aus [31]. Kontrollierte Studien mit Haloperidol, Chlorpromazin und Thioridazin liegen über 30 Jahre zurück und dürften aus heutiger Sicht aufgrund der damaligen Methodik und Klassifikation des Störungsbildes in ihrer Aussagekraft eingeschränkt sein [28, 29, 66].
Atypische Neuroleptika
Zu den atypischen Neuroleptika zählt Risperidon, ein Benzisoxazolderivat, bei dem es sich um einen weitgehend selektiven D2-/5-HT2-Antagonisten handelt. Über eine kortikale 5-HT2-Blockade kommt es einerseits zu einer höheren Dopamin-Freisetzung und darunter zu einer Normalisierung der Funktion absteigender GABAerger und glutamaterger Neuronen und andererseits zu einer limbischen D2-Rezeptor-Blockade, was die dopaminerge Transmission in den Basalganglien – teils antagonisiert durch die 5-HT2-Blockade – reduziert. Risperidon stellte seine Wirksamkeit auf hyperkinetisches und impulsives Verhalten, insbesondere bei Menschen mit geistiger Behinderung, in mehreren Studien unter Beweis [4, 21]. Es ist als einziges atypisches Neuroleptikum für die Indikation expansive Verhaltensstörung bei Menschen mit geistiger Behinderung ab einem Alter von fünf Jahren zugelassen. Die empfohlene Dosierung liegt zwischen 0,25 und maximal 4 mg/d. Unter den Nebenwirkungen des Atypikums Risperidon dominieren in der Titrationsphase Müdigkeit oder Schlaflosigkeit, Kopfschmerzen und Prolactinanstieg sowie im weiteren Behandlungsverlauf eine nicht selten limitierende Gewichtszunahme. Risperidon zeigte sich in der Kombination mit Methylphenidat als wirksam und nebenwirkungsarm, wobei sich der Einfluss von Methylphenidat auf die Aufmerksamkeitsprobleme und das Gewicht als sehr günstig erwies [20, 33]. Die Einzeldosierung kann in der Kombinationstherapie für Methylphenidat weit unter 1,0 mg/kg KG und für Risperidon unter 0,1 mg/kg KG gehalten werden, was das Nebenwirkungsrisiko deutlich minimiert.
Magnesiumsalze
Sowohl in einer kontrollierten als auch in einer offenen Studie (n=127, Alter 0–15 Jahre) konnte eine positive Wirkung von Magnesiumsalzen allein oder zusätzlich zu einer Standardtherapie auf das hyperkinetische Verhalten im Eltern- und Lehrerurteil (Ansprechrate 30–100%) nachgewiesen werden [50, 59]. Vor Beginn der Augmentation hatten 58% der ADHS-Kinder bei normalem Serumspiegel einen zu geringen Magnesiumspiegel in den Erythrozyten gehabt, der sich ebenfalls unter Magnesiumgabe (6 mg/kg KG pro Tag) normalisierte.
Zinksalze
Der Zinkspiegel im Serum, in Erythrozyten, im Haar und Urin wurde wiederholt signifikant niedriger bei ADHS-Kindern als bei Gesunden beschrieben [9, 65]. Arnold et al. [6] fanden einen Zusammenhang zwischen niedrigem Zinkspiegel und Unaufmerksamkeit auf der von Eltern und Lehrern ausgefüllten Conners Rating Scale Revised Long-Form. Eine Korrelation von Zinkmangel zu hyperaktiv-impulsivem Verhalten konnten sie dagegen nicht nachweisen. Aus dieser Zinkmangelhypothese heraus resultieren Ansätze zur therapeutischen Zinksubstitution. Tabelle 1 gibt einen Überblick über zwei neuere Studien, in denen Zinksulfat allein oder in Kombination mit Methylphenidat eingesetzt wurde.
Tab. 1. Studien zur Wirksamkeit von Zinksulfat bei ADHS
|
Autor |
Studiendesign |
Demographische Daten |
Dauer der Therapie/ |
Wirksamkeit |
|
Bilici et al. [10] |
Doppelblind, Plazebo-kontrolliert |
N=400 |
12 Wochen, |
Response (ADHDS, CTQ) |
|
Akhondzadeh et al. [2] |
Doppelblind |
N=44 |
6 Wochen, |
Response (ADHD PRS) |
MPH: Methylphenidat, ADHDS: Attention Deficit Hyperactivity Disorder Scale, CTQ: Conners Teacher Questionnaire, ADHD PRS: Attention Deficit Hyperactivity Disorder Parent Rating Scale
Als Hauptnebenwirkung wurde der metallische Geschmack des Zinksalzes angegeben (52,6%). Der genaue Wirkungsmechanismus von Zinkionen ist nach wie vor nicht bekannt. Diskutiert werden eine serotonerge Verstärkerfunktion, eine Modulation von Melatonin, eine Regulation von Cyclooxygenase und damit ein Effekt auf die Prostaglandinsynthese sowie ein Zusammenhang zu den mehrfach ungesättigten Fettsäuren beziehungsweise zu einem antioxidativen Effekt bei einer zu hohen Nahrungszufuhr von n-3-Fettsäuren [10].
Fettsäuren
Essenzielle Fettsäuren wie Linolsäure und Alpha-Linolensäure können nicht selbst synthetisiert werden, sondern müssen über die Nahrung aufgenommen werden. Abbildung 1 zeigt den Stoffwechselweg bis hin zu den mehrfach ungesättigten Fettsäuren. Engelberg [24] sah einen Zusammenhang zwischen einem niedrigen Plasmacholesterolspiegel und einer reduzierten Konzentration des Serotonin-Metaboliten 5-Hydroxyindolessigsäure (5-HIAA) im Liquor, wobei letzterer Befund mit einer Impulskontrollstörung korreliert [46]. Ergebnisse zur Fettsäurezusammensetzung einiger Lipide sind vielversprechender als die Analyse der Lipide selbst [40]. Eigene Ergebnisse, die mit denen aus der Literatur korrespondieren (Tab. 2), sprechen insgesamt für eine Erhöhung gesättigter und eine gleichzeitige Reduktion vielfach ungesättigter Fettsäuren bei hyperkinetischen Kindern.
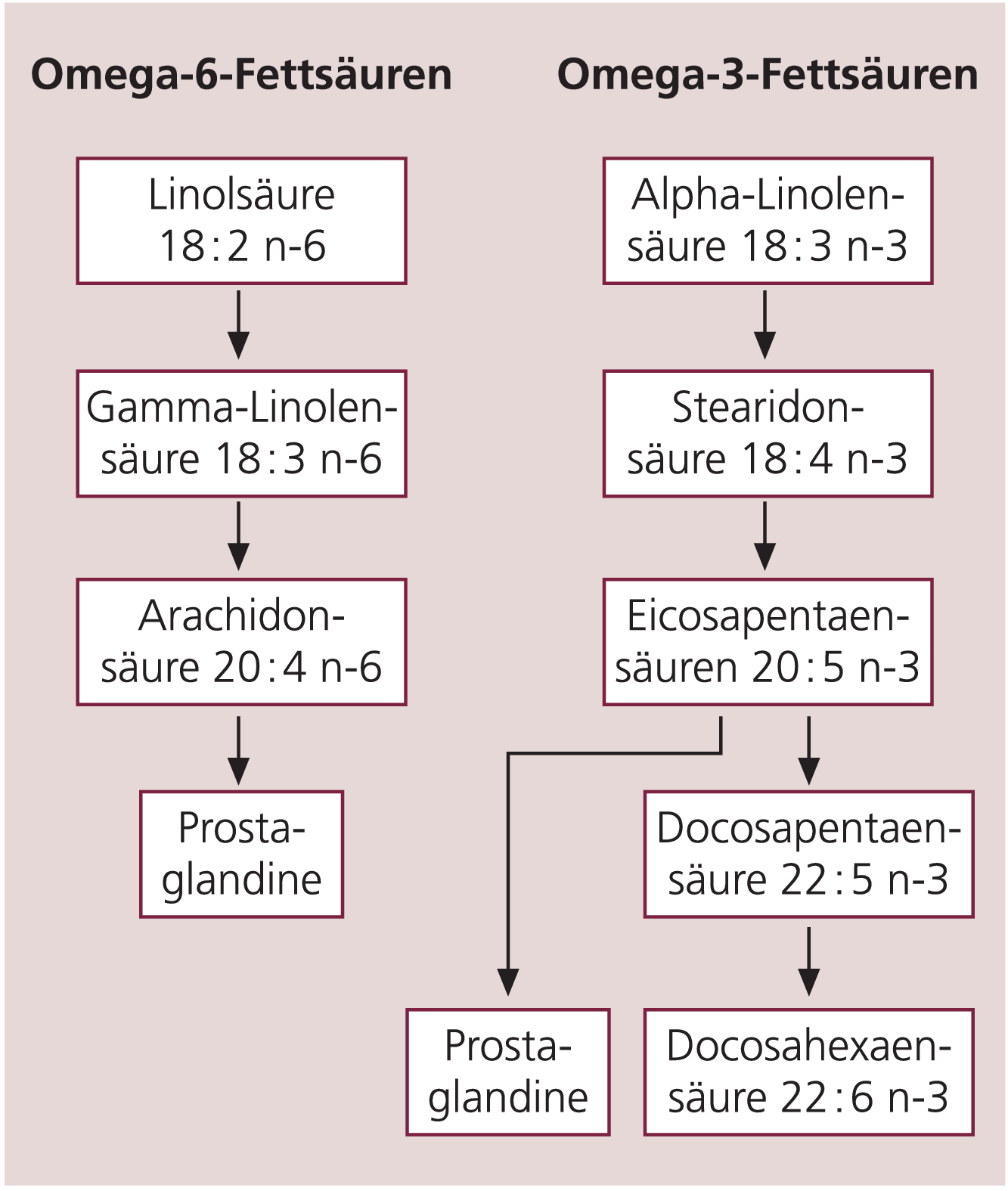
Abb. 1. Synthese der mehrfach ungesättigten Fettsäuren
Tab. 2. Ungesättigte Fettsäuren im Blut (Plasma, Serum), signifikante Befunde bei ADHS im Vergleich zu Kontrollen
|
Autor |
Gruppengrößen, |
|
Mitchell et al. |
ADHS (n=48)/Kontrolle (n=49) |
|
Irmisch et al. ‚ |
ADHS (n=30)/Kontrolle (n=30) |
|
Stevens et al. |
ADHS (n=53)/Kontrolle (n=43) |
|
Burgess et al. |
ADHS (n=53)/Kontrolle (n=43) |
|
Chen et al. |
ADHS (n=58)/Kontrolle (n=52) |
|
Young et al. |
ADHS (n=37)/Kontrolle (n=35) Erhöht: 22:5n-3 |
Hibbeln et al. [37] postulierten eine Abhängigkeit zwischen der Konzentration mehrfach ungesättigter Fettsäuren im Plasma und dem 5-HIAA-Spiegel im Liquor. Ein Mangel an Omega-3-(n-3-)Fettsäuren führt zu einem Anstieg der 5-HT2A-Rezeptor-Dichte im frontalen Kortex. Darüber hinaus bedingt ein Defizit an mehrfach ungesättigten Omega-3-Fettsäuren impulsives Verhalten, wie es hyperkinetische Kinder aufweisen [60]. Neben dem hohen Anteil von mehrfach ungesättigten Fettsäuren im Gehirn (20% des Trockengewichts), entscheidet das Verhältnis von gesättigten zu mehrfach ungesättigten Fettsäuren in der Zellmembran über deren Fluidität und damit letztendlich über die Signaltransmission. Andererseits besitzt speziell die Homo-Gamma-Linolensäure eine Funktion bei der Synthese des Prostaglandins PGE1, welches wiederum indirekt über die T-Lymphozyten auf das Immunsystem wirkt. Als Ausgangspunkt für die Mittlersubstanzen Leukotrien und Prostaglandin fungiert die mehrfach ungesättigte Fettsäure Arachidonsäure, die eine Komponente der Zellmembranlipide darstellt und durch Phospholipasen freigesetzt wird.
Fettsäuren als primäre Therapie
Zwei Studien, in denen einerseits Efamol, ein Fertigpräparat mit einem hohen Anteil mehrfach ungesättigter Fettsäuren sowie Linol- und Gamma-Linolensäure (eine Quelle für Omega-6-Fettsäuren) und andererseits eine Kombination aus verschiedenen Omega-3- und Omega-6-Fettsäuren mit Vitamin C eingesetzt wurde, stehen exemplarisch für die uneinheitlichen Resultate und damit die schwankende Effizienz, die eher als minimal einzustufen ist [3, 54]. Die Studie von Richardson und Puri [54] beendeten von insgesamt 41 eingeschlossenen Patienten 15 in der Interventionsgruppe und 14 in der Plazebo-Gruppe. Nach 12 Wochen zeigten sich Therapieeffekte in 7 von 14 Erfolgskriterien (darunter waren die von den Eltern beurteilte Unaufmerksamkeit, der globale ADHS-Index nach Conners und psychosomatische Symptome signifikant). Die Effektstärke lag bei etwa 50% derjenigen von Methylphenidat. In einer jüngst publizierten Studie zeigten Joshi et al. [43] nach einer 3-monatigen Supplementierung mit täglich 400 mg Alpha-Linolensäure und 50 mg Vitamin C signifikante Verbesserungen im Elternurteil hinsichtlich Hyperaktivität, Impulsivität und Unaufmerksamkeit in der Verum-Gruppe (n=30) gegenüber der Kontrollgruppe (n=30).
Fettsäuren als ergänzende Therapie
Während in einer älteren Studie von Voigt et al. [63], die die Effekte der Supplementierung mit Docosahexaensäure über vier Monate untersuchten, keine signifikanten Unterschiede zwischen den Gruppen gefunden wurden, konnten Stevens et al. [61] in der Verum-Gruppe unter Efamol im Vergleich zur Plazebo-Gruppe, die Olivenöl erhielt, signifikante Effekte im Lehrerurteil bezüglich aggressivem Verhalten und Unaufmerksamkeit nachweisen. In der Oxford-Durham-Studie von Richardson und Montgomery [55] wurden über drei Monate in der Verum-Gruppe 60 Kinder mit Koordinationsstörungen aus Schulen, darunter 55 mit Lese-Rechtschreib-Störungen (LRS) und 50 mit ADHS und in der Kontrollgruppe 57 Kinder mit LRS, darunter 52 mit ADHS untersucht. Die Behandlung bestand aus täglich 6 Kapseln, die jeweils 558 mg Eicosapentaensäure, 174 mg Docosapentaensäure, 60 mg Gamma-Linolensäure und 9,6 mg Vitamin E enthielten. Nach drei Monaten erfolgte ein einfaches Cross-over. Die Cross-over-Gruppe verbesserte sich hinsichtlich LRS und Verhaltensauffälligkeiten ebenfalls in den nachfolgenden drei bis sechs Monaten. Die erreichten Effektstärken lagen bei rund 50% der von Methylphenidat. Im Lehrerurteil – ein Elternurteil floss in die Beurteilung nicht ein – wurden sowohl bei der LRS- als auch der ADHS-Symptomatik Effekte nachgewiesen. Zum Behandlungsende nach drei Monaten waren nur noch 23% der ADHS-Kinder klinisch auffällig.
Sowohl bei Omega-3- als auch Omega-6-Fettsäuren zeichnen sich bei optimistischer Interpretation der vorliegenden Studien-Ergebnisse positive Effekte auf Symptome, wie sie auch bei ADHS auftreten, ab, ohne in der Effizienz an Methylphenidat heranzureichen [71]. Kritisch muss hinzugefügt werden, dass die Qualität der Methodik der vorliegenden Untersuchungen im Vergleich zu neueren Arbeiten zur Wirksamkeit und Sicherheit verschiedener Methylphenidat-Formulierungen zu wünschen übrig lässt.
Homöopathie
In einer offenen prospektiven zweiarmigen Kohortenstudie wurden über drei Monate 206 Kinder mit dem Komplex-Homöopathikum Zappelin und 149 mit Ritalin® (Methylphenidat) behandelt. 47,1% der mit Zappelin und 77,9% der mit Ritalin Behandelten wurden nach ärztlicher Beurteilung des klinischen Gesamteindrucks als verbessert eingeschätzt. Neben der eingeschränkten Aussagekraft aufgrund des offenen Designs mangelt es der Studie am Lehrer-/ Elternurteil [22].
In zwei doppelblinden, Plazebo-kontrollierten, randomisierten Studien wurden nur sehr schwache Effekte der eingesetzten individuellen homöopathischen Präparate nachgewiesen. Die besten Effekte traten in der von Frei et al. [26] durchgeführten Studie (n=83) in den offenen Phasen (58%) auf, während in der Plazebo-kontrollierten Phase nur eine Verbesserung des Ausgangswerts um 9% erreicht werden konnte. Am Ende der Cross-over-Untersuchung berichteten sowohl die Eltern als auch die Lehrer über Verbesserungen der ADHS-Symptomatik sowie komorbider Probleme. Die Autoren plädieren aufgrund einer durchgeführten Reanalyse für eine mindestens 12-monatige Untersuchungsdauer, um die Effizienz individueller homöopathischer Medikation mit höherer Signifikanz untermauern zu können [27]. Jacobs et al. [41] fanden dagegen bei 43 Kindern keine deutlichen Verbesserungen unter Homöopathie. Eine ausführliche Analyse der Studien und ihrer Ergebnisse nahm Döpfner [22] vor.
Zusammenfassung
Da es auf die etablierten Psychopharmaka bei ADHS wie Stimulanzien und Atomoxetin bis zu 30% Nonresponder gibt, diese in Einzelfällen limitierende Nebenwirkungen aufweisen und unter vielen Ärzten nicht nur Skepsis gegenüber Leitlinien-orientierten, Evidenz-basierten Psychopharmakotherapien herrscht, sondern auch eine gewisse Experimentierfreudigkeit besteht, bedarf es im Interesse einer patientenzentrierten störungsspezifischen Therapie sorgfältiger Risiko-Nutzen-Abwägungen zu alternativen Substanzen. Tabelle 3 gibt einen umfassenden Überblick zu alternativen Substanzen, deren Status als Off- vs. On-Label-Medikation, Dosierungen im Kindes-, Jugend- und Erwachsenenalter, Risiken sowie dem Evidenz-basierten Empfehlungsgrad. Keine der aufgeführten Substanzen ist in Bezug auf Effektstärke und Nebenwirkungsspektrum den über 50 Jahre etablierten Stimulanzien in der Therapie des ADHS ebenbürtig. Dennoch können einige der aufgeführten Substanzen bei nicht ausreichendem Ansprechen auf Methylphenidat-Präparate oder Atomoxetin sowie dem Auftreten nicht tolerierbarer Nebenwirkungen entweder in Monotherapie oder als Ergänzung bei kritischer Würdigung im Einzelfall empfohlen werden.
Tab. 3. Alternativen in der Behandlung von ADHS bei Kindern, Jugendlichen und Erwachsenen [7, 56]
|
Substanz |
Kinder/Jugendliche |
Erwachsene |
Kommentar/Empfehlung |
|
Imipramin |
Zugelassen für Kinder ab 6 Jahre |
25–300 mg/d |
Wirksam beim impulsiv-hyperaktiven Typ, keine Erfahrungen im Erwachsenenbereich ADHS (+), |
|
Amitriptylin |
Strenge Indikation unter 18 Jahren, |
75–150 mg/d |
ADHS (–) |
|
Nortriptylin |
Keine Zulassung, |
20–225 mg/d |
Suizidalität! |
|
Desipramin |
Keine Zulassung, |
50–250 mg/d |
Plötzlicher Herztod! |
|
MAO-Hemmer Moclobemid |
Keine Zulassung, |
450–600 mg/d |
Gefahr der Überdosis, Arzneimittelwechselwirkungen! ADHS (+) |
|
Venlafaxin |
Keine Zulassung, |
25–225 mg/d |
ADHS – |
|
Bupropion |
Keine Zulassung, |
Max. 300 mg/d |
Epilepsie und Tics! |
|
Buspiron |
Keine Zulassung, |
15–30 mg/d |
ADHS (+), |
|
Clonidin |
3–5 μg/kg/d |
5–8 μg/kg pro d |
Ähnliche Effektstärken wie Methylphenidat bei hyperaktiv-impulsivem Verhalten, viele NW |
|
Guanfacin |
In Deutschland nicht verfügbar |
||
|
Levodopa |
Keine Zulassung, |
Max. 4 g/d |
ADHS – |
|
Betablocker |
|
|
ADHS –, |
|
Klassische Neuroleptika |
|
|
EPMS! |
|
Atypische Neuroleptika |
|
|
Gewichtszunahme, Prolactinanstieg! |
|
Zinksalze |
<6 Jahren bis 50 mg/d |
Bis 150 mg/d |
ADHS (–) |
|
Magnesiumsalze |
6 mg/kg KG/d |
Bis 300 mg/d |
ADHS (+) bei nachgewiesenem Mangel |
|
Mehrfach ungesättigte Fettsäuren (Mix aus Omega-3-und -6-Fettsäuren) |
ADHS (+) |
||
|
Homöopathie |
|
|
|
+ empfehlenswert, (+) eingeschränkt empfehlenswert, (–) weniger empfehlenswert, – nicht empfehlenswert
Literatur
1. Adler LA, Resnick S, Kunz M, Devinsky O. Open-label trial of venlafaxine in adults with attention deficit disorder. Psychopharmacol Bull 1995;31:785–8.
2. Akhondzadeh S, Mohammadi MR, Khademi M. Zinc sulfate as adjunct to methylphenidate for the treatment of attention deficit hyperactivity disorder in children: A double-blind and randomized trial. BMC Psychiatry 2004;4:9–14.
3. Aman MG, Mitchell EA, Turbott SH. The effects of essential fatty acid supplementation by efamol in hyperactive children. J Abnorm Child Psychol 1987;15:75–90.
4. Aman MG, De Smedt G, Derivan A, Lyons B, et al.. Risperidone disruptive behavior study group. Double-blind, placebo-controlled study of risperidone for the treatment of disruptive behaviours in children with subaverage intelligence. Am J Psychiatry 2002;159:1337–46.
5. Antkowiak R, Rajewski A. Administration of moclobemide++ in children with attention deficit hyperactivity disorder. Psychiatr Pol 1998;32:751–7.
6. Arnold LE, Bozzolo H, Hollway J, Cook A, et al. Serum zinc correlates with parents- and teacher-rated inattention in children with attention-deficit/hyperactivity disorder. J Child Adolesc Psychopharmacology 2005;15:628–36.
7. Bandelow B, Heise CA, Banaschewski T, Rothenberger A (Hrsg.). Handbuch Psychopharmaka für das Kindes- und Jugendalter. Göttingen: Hogrefe, 2006.
8. Barrickman L, Perry P, Allen A, Kuperman S, et al. Bupropion versus methylphenidate in the treatment of attention-deficit hyperactivity disorder. J Am Acad Child Adolesc Psychiatry 1995;34:649–57.
9. Bekaroglu M, Yakup A, Yusof G, Orhan D, et al. Relationship between serum-free fatty acids and zinc and ADHD. J Child Psychol Psychiatry 1996;37:225–7.
10. Bilici M, Yildirim F, Kandil S, Bekaroglu M, et al. Double-blind, placebo-controlled study of zinc sulfate in the treatment of attention deficit hyperactivity disorder. Prog Neuropsychopharmacol Biol Psychiatry 2004;28:181–90.
11. Buitelaar JK, Van der Gaag RJ, Swaab-Barneveld H, Kuiper M. Pindolol and methylphenidate in children with attention deficit hyperactivity disorder. Clinical efficacy and side-effects. J Child Psychol Psychiat 1996;37:587–95.
12. Burgess JR, Stevens LJ, Zhang W, Peck L. Long-chain polyunsaturated fatty acids in children with attention deficit hyperactivity disorder. Am J Clin Nutr 2000;71:327–30.
13. Cantwell DP, Swanson J, Connor DF. Case study: adverse response to clonidine. J Am Acad Child Adolesc Psychiatry 1997;36:539–44.
14. Casat CD, Pleasants DZ, Fleet JVW. A double-blind trial of bupropion in children with attention deficit disorder. Psychopharmacol Bull 1987;23:120–2.
15. Castillo C, Ibarra M, Marquez JA. Pharmacological evidence for interaction between 5-HT1A-receptor agonists and subtypes of alpha-1-adrenoreceptors on rabbit aorta. Eur J Pharmacol 1993;24:141–8.
16. Chen JR, Hsu SF, Hsu CD, Hwang LH, et al. Dietary patterns and blood fatty acid composition in children with attention deficit hyperactivity disorder in Taiwan. J Nutr Biochem 2004;15:467–72.
17. Conners CK, Casat CD, Gualtieri CT, Weller E, et al. Bupropion hydrochloride in attention deficit disorder with hyperactivity. J Am Acad Child Adolesc Psychiatry 1996;35:1314–21.
18. Connor DF. Beta blockers for aggression: A review of the pediatric experience. J Child Adolesc Psychopharmacol 1993;2:99–114.
19. Connor DF, Fletcher KE, Swanson JM. A meta-analysis of clonidine for symptoms of attention deficit hyperactivity disorder. J Am Acad Child Adolesc Psychiatry 1999;38: 1551–9.
20. Cosgrove PVF. Risperidone added to methylphenidate in attention deficit hyperactivity disorder. Eur Neuropsychopharmacol 1996;6(Suppl 3):11–2.
21. Croonenberghs J, Fegert JM, Findling RL, De Smedt G, et al.. Risperidone in children with disruptive behavior disorders and subaverage intelligence: 1-year, open-label study of 504 patients. J Am Acad Child Adolesc Psychiatry 2005;44:64–72.
22. Döpfner M. Alternative Therapien. ADHS-Report 2006;23:1–4.
23. Elia J, Ambrosini PJ, Rapoport JL. Treatment of attention deficit hyperactivity disorder. N Engl J Med 1999;340:780–8.
24. Engelberg H. Low serum cholesterol and suicide. Lancet 1992;339:727–9.
25. Findling RL, Schwartz MA, Flannery DJ, Manos MJ. Venlafaxine in adults with attention deficit hyperactivity disorder: an open clinical trial. J Clin Psychiatry 1996;57: 184–9.
26. Frei H, Everts R, von Ammon K, Kaufmann F, et al. Homeopathic treatment of children with attention deficit hyperactivity disorder: a randomised double-blind, placebo controlled cross-over trial. Eur J Pediatrics 2005;164:758–67.
27. Frei H, Everts R, von Ammon K, Kaufmann F, et al. Randomised controlled trials of homeopathy in hyperactive children: treatment procedure leads to an unconventional study design. Experience with open-label homeopathic treatment preceding the Swiss ADHD placebo controlled, randomised, double-blind, cross-over trial. Homeopathy 2007;96:35–41.
28. Gittelman-Klein R, Klein DF, Katz S. Comparative effects of methylphenidate and thioridazine in hyperactive children: I. Clinical results. Arch Gen Psychiatry 1976;33: 1217–31.
29. Greenberg LM, Deem MA, McMahon S. Effects of dextroamphetamine, chlorpromazine, and hydroxyzine on behavior and performance in hyperactive children. Am J Psychiatry 1972;129:532–9.
30. Greydanus D. Pharmacological treatment of attention deficit hyperactivity disorder. Indian J Pediatr 2005;72:953–60.
31. Häßler F, Buchmann J, Göhre C, Fegert JM. Hyperkinetische Störungen – Pharmakotherapeutische Alternativen zu Stimulanzien. Psychopharmakotherapie 2001;8:63–70.
32. Häßler F, Göhre C, Irmisch G. Buspiron – eine Alternative zu Stimulanzien in der Therapie hyperkinetischer Störungen. In: Lehmkuhl U (Hrsg.). Psychotherapie und Psychopharmakotherapie im Kindes- und Jugendalter. Göttingen: Vandenhoeck & Ruprecht, 2003: 100–7.
33. Häßler F, Buchmann J, Reis O. Psychopharmaka und Polypharmazie. Nervenheilkunde 2005;24:811–8.
34. Hazell PL, McDowell M, Walton J. Management of children prescribed psychostimulant medication for attention deficit hyperactivity disorder in the Hunter region of New South Wales. Med J Aust 1996;165:477–80.
35. Hazell PL, Stuart JE. A randomized controlled trial of clonidine added to psychostimulant medication for hyperactive and aggressive children. J Am Acad Child Adolesc Psychiatry 2003;42:886–94.
36. Hedges D, Reimherr FW, Rogers A, Strong R, et al. An open trial of venlafaxin in adult patients with attention hyperactivity disorder. Psychopharmacol Bull 1995;31:779–83.
37. Hibbeln JR, Linnoila M, Umhau JC, Rawlings R, et al. Essential fatty acids predict metabolites of serotonin and dopamine in cerebrospinal fluid among healthy control subjects, and early- and late-onset alcoholics. Biol Psychiatry 1998;44:235–42.
38. Himpel S, Banaschewski T, Heise CA, Rothenberger A. The safety of non-stimulant agents for the treatment of attention deficit hyperactivity disorder. Expert Opin Drug Saf 2005;4:311–21.
39. Huss M. Vorbereitung der Erhebung und Auswertung zur Prävalenz des Aufmerksamkeits-Defizit-Hyperaktivitäts-Syndrom (ADHS) in Deutschland im Rahmen des Kinder- und Jugend-Surveys des Robert-Koch-Instituts. Abschlussbericht an das Bundesministerium für Gesundheit und Soziale Sicherung (BMGS). Bonn: BMGS 2004.
40. Irmisch G, Wiechert P, Häßler F, Langemann I. Fatty acid patterns of serum lipids and the hypermotoric syndrome. Neurosciences 1992;18:77–80.
41. Jacobs J, Williams AL, Girard C, Njike VY, et al. Homeopathy for attention deficit hyperactivity disorder: a pilot randomized controlled trial. J Altern Complement Med 2005;11:799–806.
42. Johnston JA, Ye W, Van Brunt DL, Pohl G, et al. Decreased use of clonidine following treatment with atomoxetine in children with ADHD. J Clin Psychopharmacol 2006;26:389–95.
43. Joshi K, Lad S, Kale M, Patwardhan B, et al. Supplementation with flax oil and vitamin C improves the outcome of attention deficit hyperactivity disorder (ADHD). Prostaglandins Leukot Essent Fatty Acids 2006;74:17–21.
44. Langer DH, Rapoport JL, Brown GL, Ebert MH, et al. Behavioral aspects of carbidopa/levodopa in hyperactive boys. J Am Acad Child Adolesc Psychiatry 1982;21:10–8.
45. Malhotra S, Santosh PJ. An open clinical trial of buspirone in children with attention deficit hyperactivity disorder. J Am Acad Child Adolesc Psychiatry 1998;37:364–71.
46. Mann JJ. Violence and aggression. In: Bloom FE, Kupfer DJ (eds.). Psychopharmacology: The fourth generation of progress. New York: Raven, 1995:1919–28.
47. Mattes JA, Gittelman R. A pilot trial of amantadine in hyperactive children. Paper presented at the NCDEU meeting, KEY Biscayne, Florida, 1979.
48. Mattes JA. Propranolol for adults with temper outbursts and residual attention deficit disorder. J Clin Psychopharmacol 1986;6:299–302.
49. Mitchell EA, Aman MG, Turbott SH, Manku M. Clinical characteristics and serum essential fatty acids levels in hyperactive children. Clin Pediatr 1987;26:406–11.
50. Mousin-Bosc M, Roche M, Rapin J, Bali JP. Magnesium VitB6 intake reduces central nervous system hyperexcitability in children. J Am Coll Nutr 2004;23:545–8.
51. Overtoon CC, Verbaten MN, Kemner C, Kenemans JL, et al. Effects of methylphenidate, desipramine, and L-dopa on attention and inhibition in children with attention deficit hyperactivity disorder. Behav Brain Res 2003;145:7–15.
52. Popper CW. Combining methylphenidate and clonidine: pharmacological questions and news reports about sudden death. J Child Adolesc Psychopharm 1995;5:157–66.
53. Popper CW. Pharmacologic alternatives to psychostimulants for the treatment of attention deficit hyperactivity disorder. Child Adolesc Psychiatric Clin North Am 2000;9:605–46.
54. Richardson AJ, Puri BK. A randomized double-blind, placebo-controlled study of the effects of supplementation with highly unsaturated fatty acids on ADHD-related symptoms in children with specific learning difficulties. Prog Neuropsychopharmacol Biol Psychiatry 2002;26:233–9.
55. Richardson AJ, Montgomery P. The Oxford-Durham study: a randomized, controlled trial of dietary supplementation with fatty acids in children with developmental coordination disorder. Pediatrics 2005;115:1360–6.
56. Rote Liste. Frankfurt/Main: Rote Liste Service GmbH, 2006.
57. Sobanski E, Alm B. Aufmerksamkeitsdefizit-/ Hyperaktivitätsstörung (ADHS) im Erwachsenenalter. Nervenarzt 2004;75:697–716.
58. Solhkhah R, Wilens TE, Daly J, Prince JB, et al. For the treatment of substance-abusing outpatient adolescents with attention deficit hyperactivity disorder and mood disorders. J Child Adolesc Psychopharmacol 2005;15:777–86.
59. Starobrat-Hermelin B, Kozielec T. The effects of magnesium physiological supplementation on hyperactivity in children with attention deficit hyperactivity disorder (ADHD). Positive response to magnesium oral loading test. Mag Res 1997;10:149–56.
60. Stevens LJ, Zentall SS, Deck JL, Abate ML, et al. Essential fatty acid metabolism in boys with attention deficit hyperactivity disorder. Am J Clin Nutr 1995;62:761–8.
61. Stevens L, Zhang W, Peck L, Kuczek T, et al.. EFA supplementation in children with attention, hyperactivity, and other disruptive behaviours. Lipids 2003;38:1007–21.
62. Trott GE, Menzel M, Friese HJ, Nissen G. Wirksamkeit und Verträglichkeit des selektiven MAO-A-Inhibitors Moclobemid bei Kindern mit hyperkinetischem Syndrom. Z Kinder Jugendpsychiatr Psychother 1991;19:248–53.
63. Voigt RG, Llorente AM, Jensen CL, Fraley JK, et al. A randomized, double-blind, placebo-controlled trial of docosahexaenoic acid supplementation in children with attention deficit hyperactivity disorder. J Pediatr 2001;139:189–96.
64. Vorstand der Bundesärztekammer. Stellungnahme zur „Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS)“. Dtsch Ärztebl 2005;102:2562–8.
65. Ward NI. Assessment of chemical factors in relation to child hyperactivity. J Nutr Environ Med (Abington) 1997;7:333–42.
66. Werry J, Aman M, Lampen E. Haloperidol and methylphenidate in hyperactive children. Acta Paedopsychiatr 1976;42:26–40.
67. Wilens TE, Spencer TJ, Biederman J, Girard K, et al. A controlled clinical trial of bupropion for attention deficit hyperactivity disorder in adults. Am J Psychiatry 2001;158:282–8.
68. Wilens TE, Prince JB, Spencer T, Van Patten SL, et al. An open trial of bupropion for the treatment of adults with attention deficit hyperactivity disorder and bipolar disorder. Biol Psychiatry 2003;54:9–16.
69. Wilens T. Mechanism of action of agents used in attention deficit hyperactivity disorder. J Clin Psychiatry 2006;67(Suppl 8):32–7.
70. Young GS, Maharaj NJ, Conquer JA. Blood phospholipids fatty acid analysis of adults with and without attention deficit hyperactivity disorder. Lipids 2004;39:117–23.
71. Young G, Conquer J. Omega-3-fatty acids and neuropsychiatric disorders. Reprod Nutr Dev 2005;45:1–28.
Prof. Dr. med. Frank Häßler, Alexander Dück, Dr. med. Olaf Reis und Dr. med. Johannes Buchmann, Klinik für Psychiatrie, Neurologie, Psychosomatik und Psychotherapie im Kindes- und Jugendalter des Universitätsklinikums Rostock, Gehlsheimer Str. 20, 18147 Rostock, E-Mail: frank.haessler@med.uni-rostock.de
Alternative agents used in ADHD
Attention-deficit/hyperactivity disorder (ADHD) is with a prevalence of 2% to 7% the most common neurobehavioral disorder affecting children and adolescents, with persistence into adulthood. Comorbidity and psychosocial circumstances enter into the choice of intervention strategies. Several agents have been demonstrated effective in treating individuals with ADHD. Either direct or indirect attenuation of dopamine and norepinephrine neurotransmission appears related to both the stimulant and nonstimulant medications efficacious in ADHD. However, important differences concerning efficacy and side effects exist both between and with the specific classes of agents like antidepressants, neuroleptics, alpha agonists, beta blockers, levodopa, zinc, magnesium, polyunsaturated fatty acids, and homeopathy. Elucidating the various mechanisms of action of ADHD medications may lead to better choices in matching potential response to the characteristics of individuals. We review the purported mechanism of action and available evidence for selected complementary and alternative medicine therapies for ADHD.
Keywords: ADHD, alternative drugs and substances
Psychopharmakotherapie 2007; 14(06)
