Gerd Laux, Wasserburg, und Sven Ulrich, Osterweddingen
Der irreversible und nichtselektive Monoaminoxidase(MAO)-Hemmer Tranylcypromin nimmt unter den Antidepressiva eine Sonderstellung durch seine Pharmakologie ein (Abb. 1). Auch aufgrund der damit verbundenen therapeutischen Vorzüge und Grenzen wird so eine eigenständige Gruppe von Antidepressiva definiert.
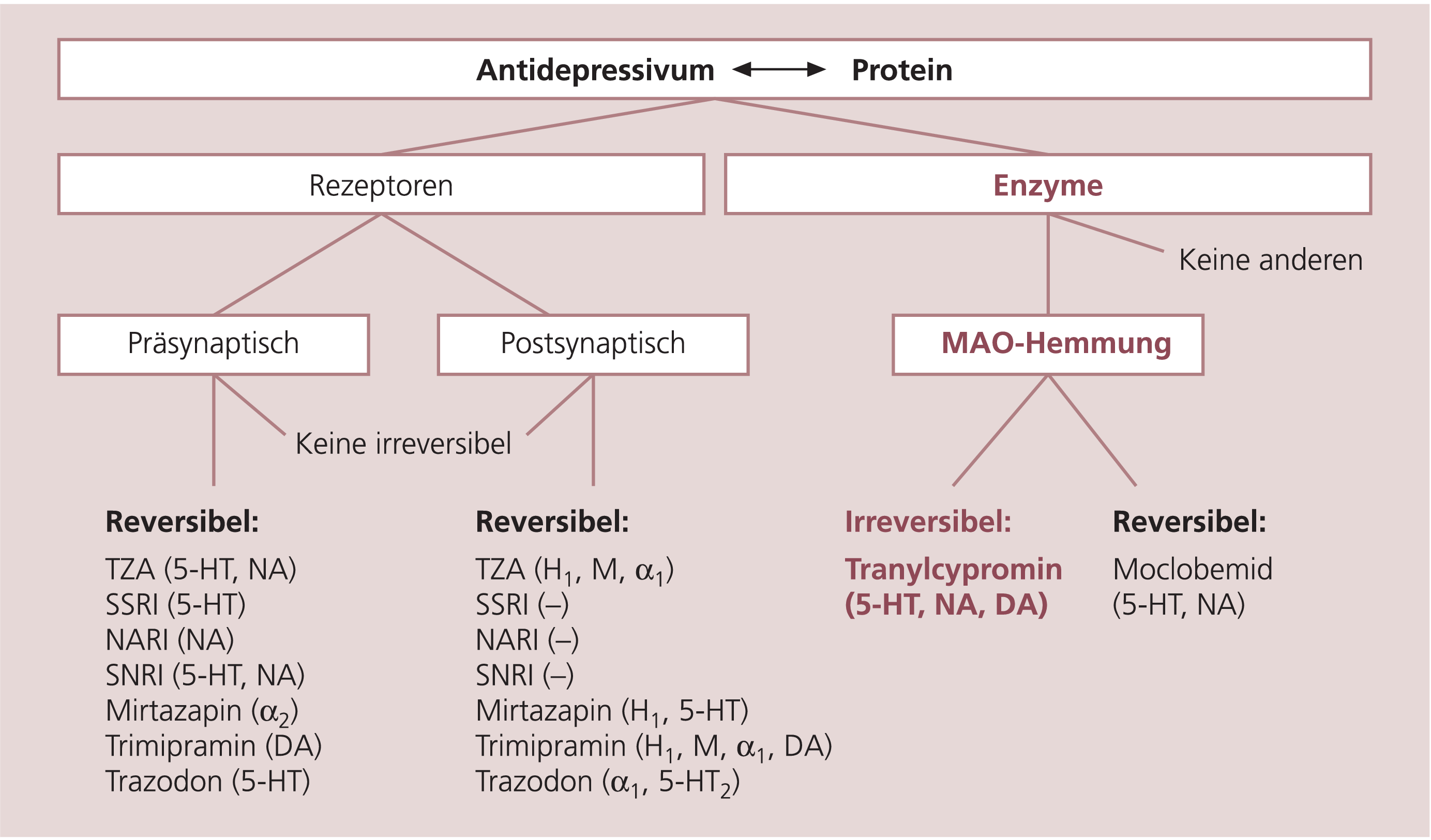
Abb. 1. Einteilung von Antidepressiva entsprechend ihrem akuten Wirkungsmechanismus (MAO: Monoaminoxidase, TZA: tri-/tetrazyklische Antidepressiva, SSRI: selektive Serotonin-, NARI: Noradrenalin-, SNRI: Serotonin-Noradrenalin-Wiederaufnahmehemmer, 5-HT: serotonerg, NA: noradrenerg, DA: dopaminerg, H: histaminerg, M: muskarinisch-anticholinerg)
1952 hat man bei Tuberkulosepatienten, die mit Iproniazid behandelt wurden, positive Veränderungen der Stimmung festgestellt. Da neben der tuberkulostatischen Wirkung des Iproniazidmetaboliten Isonicotinsäure die MAO-Hemmung von Iproniazid selbst bekannt war und die Rolle von biogenen Aminen im ZNS immer besser geklärt werden konnte, wurde schnell das Potenzial des pharmakologischen Prinzips der MAO-Hemmung in der Psychiatrie erkannt. MAO-Hemmer wie Iproniazid (Marsilid®) wurden daraufhin zu den ersten wirksamen Antidepressiva entwickelt. 1962 wurde Tranylcypromin (Jatrosom® N) in Deutschland eingeführt.
Umfassende Übersichtsarbeiten zu Tranylcypromin liegen bislang praktisch nicht vor. Ziel dieser Arbeit ist es deshalb, Ärzten in Klinik und Praxis eine aktuelle Übersicht zu Pharmakologie und therapeutischem Gebrauch dieser nach wie vor als wichtiges Antidepressivum angesehenen Substanz zur Verfügung zu stellen.
Präklinische Pharmakologie
ihrer Affinität zu Substraten,
Spezifität gegenüber Inhibitoren und
ihrer Verteilung in Geweben.
MAO-A metabolisiert vorzugsweise Serotonin und Noradrenalin, wohingegen MAO-B im ZNS eher Dopamin verstoffwechselt. Mit der Nahrung aufgenommene biogene Amine wie Tyramin unterliegen vor allem dem Einfluss hepatischer MAO-B [32, 128, 142].
Monoaminerge Pharmakologie von Tranylcypromin. Die irreversible Blockade des Enzyms durch Tranylcypromin entsteht infolge Bildung einer chemisch stabilen, kovalenten Bindung [109]. Da dies den Normalfall in der organischen Chemie darstellt, kann man auch von einer „echten“ chemischen Bindung sprechen, im Unterschied zu den schwächeren und leichter lösbaren (reversiblen) van-der-Waals-Bindungen mit Rezeptoren. Tranylcypromin liegt als Razemat in zwei stereoisomeren Formen vor (Abb. 2). (+)-Tranylcypromin hat dabei einen stärkeren Anteil an der MAO-Hemmung, was zur Konzentrations-Erhöhung von Neurotransmittern (z.B. Serotonin) und Konzentrations-Erniedrigung ihrer Metaboliten (z.B. 5-Hydroxyindolessigsäure) im ZNS führt. (–)-Tranylcypromin mit schwächerer MAO-Hemmung bewirkt eine zusätzliche Hemmung der Rückaufnahme von Noradrenalin und hat auch eine amphetaminartige, indirekt sympathomimetische Wirkung, die aber bei therapeutischen Dosen nicht annähernd erreicht wird [26, 38, 47, 51, 78].
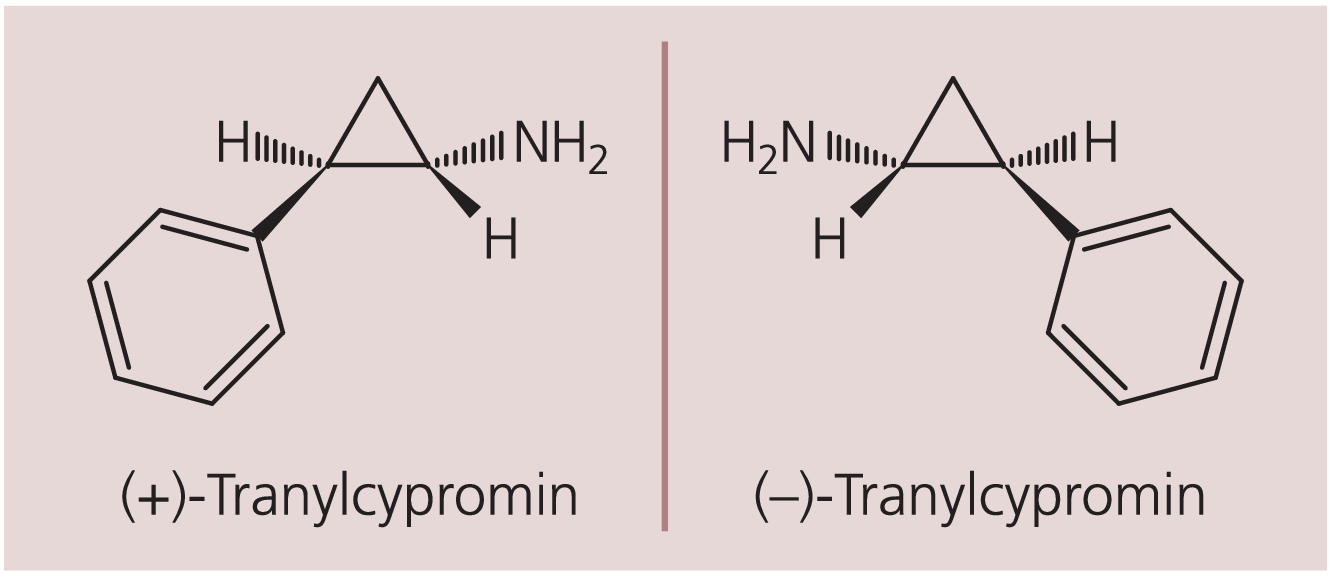
Abb. 2. Strukturformel von Tranylcypromin (TCP) mit räumlicher Darstellung der Stereoisomere infolge Chiralität (spiegelbildliche Stereoisomerie wie z.B. bei unseren Händen)
Präklinische Befunde zur MAO-Hemmung. Für den pharmakologisch zentralen Effekt der MAO-Hemmung wurde gefunden, dass nach einmaligen Dosen von 10 und 20 mg Tranylcypromin die Aktivität der MAO, wie üblich in den Thrombozyten gemessen, bei gesunden Probanden auf 50% (1 Stunde), 30% (3 Stunden) und unter 20% (24 Stunden) des Ausgangswerts sank. Ohne weitere Einnahme des MAO-Hemmers waren 50% Aktivität nach fünf Tagen und 90% Aktivität erst nach 12 Tagen wiederhergestellt. Es bestand kein Unterschied zwischen den beiden Dosen [39, 41]. Für den therapeutisch antidepressiven Effekt in einer typischen mehrwöchigen Behandlung wird eine Unterschreitung von 15% Restaktivität der MAO als notwendig eingeschätzt [83]. Ein einfacher Zusammenhang der antidepressiven Wirkung mit dem Grad der MAO-Hemmung wurde aber für therapeutische Dosen nicht gefunden [77].
Irreversible Blockade der MAO bedeutet, dass eine Erneuerung der Aktivität nur über Neusynthese des Enzyms möglich ist. Diese Neusynthese ist so langsam, dass die volle Aktivität erst einige Tage nach Absetzen von Tranylcypromin wieder vorliegt, aber auch schnell genug, dass eine sehr kleine Restaktivität auch während der Therapie mit Tranylcypromin bleibt. Aufgrund der Besonderheit des Mechanismus von Tranylcypromin wäre eigentlich besser von einer „Deaktivierung“ (Enzym) statt „Blockade“ (Rezeptor) und also nicht von einem „MAO-Hemmer“, sondern von einem „MAO-Deaktivierer“ zu sprechen. Aufgrund der eingeführten Begriffe sollen diese aber weiter verwendet werden. Vorteile des irreversiblen Mechanismus sind naturgemäß eine geringere Schwankung an MAO-Hemmung im Tagesverlauf, von der Pharmakokinetik weitgehend entkoppelt, bei einem hohen prozentualen Anteil von 80% bis 90% blockierter MAO.
Tranylcypromin hemmt nichtselektiv beide Formen MAO-A und MAO-B. Dadurch beeinflusst es alle im ZNS bedeutsamen Monoamine wie Serotonin, Noradrenalin und Dopamin. Da sich gezeigt hat, dass die Strategie einer selektiven Aktivität in ausgewählten Neurotransmittersystemen nicht zu einer Verbesserung des therapeutischen Ansprechens insgesamt führt (z.B. selektive Serotonin-Wiederaufnahmehemmer, SSRI), wird die klinische Bedeutung nichtselektiver Substanzen bestätigt. Allerdings bedingt die unselektive und irreversible Hemmung von MAO auch eine periphere Erhöhung von mit einigen Nahrungsmitteln aufgenommenen Aminen wie Tyramin.
Moderne Zielstrukturen der Depressionsforschung
Nach 28-tägiger Applikation von Tranylcypromin konnte im Großhirnkortex von Ratten eine ausgeprägte Abnahme von Beta1-, nicht jedoch von Beta2-Adrenozeptoren festgestellt werden [90]. Im gleichen Versuchsdesign wurde eine Abnahme von Alpha2-Adrenozeptoren gefunden [46].
Chronische, aber nicht akute Gabe von Tranylcypromin verringerte stressinduzierte Hirnatrophien und den Verlust hippokampaler Neuronen bei Ratten [76].
Die Expression des Wachstumsfaktors GAP-43 in zerebralen Zellkulturen der Ratte wird durch chronische Gabe von Tranylcypromin und Imipramin, nicht aber Haloperidol und Lithiumsalzen, erhöht [23]. Die Zunahme von GAP-43 wird im Zusammenhang mit neuroprotektiven Eigenschaften im Rahmen der antidepressiven Wirkung gesehen.
Der Corticotropin-freisetzende Faktor (corticotropin releasing factor, CRF) ist ein Peptid, für das eine limbische Hypersekretion bei stressinduzierter Depression diskutiert wird. Die Gabe von täglich 1,5 mg/kg Tranylcypromin an Ratten über vier Wochen verringerte die stressinduzierte CRF-Hypersekretion ähnlich Venlafaxin. Rein serotonerge und noradrenerge Substanzen (SSRI und Reboxetin) zeigten eine geringere Beeinflussung der CRF-Hypersekretion [117].
Die pharmakologischen Wirkungen von Tranylcypromin in neuen Zielstrukturen der Depressionsforschung stimmen insgesamt mit anderen Antidepressiva überein.
Tiermodelle zur Depression und Angst
In Tiermodellen der Depression zeigte Tranylcypromin positive Ergebnisse wie Aufhebung einer Reserpin-Hypoaktivität [111], von Aufgabeverhalten (behavioural despair) [95] und erlernter Hilflosigkeit [22]. In einer aktuellen Studie kam es bei stresskonditionierten Ratten unter Dosen von 3 und 15 mg/kg Tranylcypromin zu einer deutlichen Reduktion von Angst. Diese zeigte sich aber nur bei einer gleichzeitigen Hemmung von MAO-A und MAO-B, nicht jedoch bei der Verwendung von selektiven MAO-Hemmern [79].
Pharmakokinetik von Tranylcypromin
Tranylcypromin wird nach oraler Verabreichung schnell und vollständig resorbiert. 30 Minuten nach einer intraperitonealen Dosis von 10 mg/kg Tranylcypromin war der Gehalt im Hirn von Ratten etwa dreifach größer als im Blut [26]. Die Verteilung ins ZNS ist dabei aufgrund der geringeren Lipophilie etwas geringer als für die meisten anderen Psychopharmaka. Die Ausscheidung erfolgt zum größten Teil in Form von hepatisch gebildeten Metaboliten (p-Hydroxytranylcypromin, N-Acetyltranylcypromin) über Galle und Niere [6]. Es konnte letztlich geklärt werden, dass keine amphetaminartigen Metaboliten gebildet werden [66, 77, 108]. Wie für viele andere lipophile Psychopharmaka werden nur etwa 1 bis 5 % der Dosis als unverändertes Tranylcypromin im Urin wiedergefunden. Die pharmakokinetischen Kenngrößen der beiden Enantiomere unterscheiden sich und unterliegen starken interindividuellen Schwankungen. Nach einer Dosis von 10 mg razemischem Tranylcypromin erreicht (–)-Tranylcypromin maximale Plasmaspiegel von 15 bis 50 ng/ml (Mittelwert 30 ng/ml). Die maximalen Plasmaspiegel von (+)-Tranylcypromin streuen zwischen 2 und 12 ng/ml bei einem Mittelwert von 5 ng/ml. Die Plasmaspiegel des (–)-Isomeren übersteigen stets diejenigen seines optischen Antipoden. Die maximalen Blutspiegel sind in der Regel nach 0,5 bis 3 Stunden zu messen. Die terminale Eliminationshalbwertszeit beträgt oft weniger als zwei Stunden [16]. Damit unterscheidet sich Tranylcypromin von den meisten Psychopharmaka, die viel längere Halbwertszeiten aufweisen. Wie schon oben angemerkt, hat aber die Pharmakokinetik wegen der irreversiblen MAO-Hemmung nur einen geringen Einfluss auf den Zeitverlauf der Erhöhung von Monoaminen im ZNS. Eine Indikation von Plasmaspiegelbestimmungen zur Optimierung der Wirksamkeit wie etwa bei trizyklischen Antidepressiva (TZA) ist nicht gegeben [10]. Die kurzfristigen Schwankungen der Plasmaspiegel von Tranylcypromin könnten nur beim zusätzlichen Effekt der Wiederaufnahmehemmung von Noradrenalin eine Rolle spielen, und zwar bei höheren Dosen und zeitlich eng begrenzt im Bereich der Maximalspiegel.
Pharmakokinetische Interaktionen
Aus präklinischen Studien über Tranylcypromin an humanen Enzympräparaten lässt sich nur ein sehr geringes Potenzial für pharmakokinetische Interaktionen ableiten. Tranylcypromin ist ein Inhibitor des Cytochrom-P450(CYP)-Isoenzyms 2C19, allerdings nur bei sehr hohen, therapeutisch irrelevanten Dosen. CYP2D6, CYP2E1 und CYP3A4 werden nicht beeinflusst [120, 138]. Bei therapeutischen Dosen käme nur die Inhibition von CYP2A6 in Betracht. Dieses Enzym spielt aber zumindest für die Metabolisierung anderer Psychopharmaka keine Rolle [105]. In einer neueren klinischen Untersuchung wurde dies bestätigt: Kuß und Ackenheil (2005) fanden unveränderte Plasmaspiegel von Amitriptylin mit und ohne Komedikation von Tranylcypromin [70]. Und schon früher wurde gezeigt, dass Tranylcypromin die Plasmaspiegel von Carbamazepin nicht beeinflusst [62, 75]. Plasmaspiegel von Tranylcypromin selbst werden durch Inhibition von CYP2D6 nicht verändert [28, 65].
Nahrungsmittelinteraktionen
Der Tyramin-Effekt wurde bei acht Probanden anhand der Tyramin-Dosis untersucht, die notwendig ist, um den Blutdruck um 30 mm Hg zu erhöhen (tyramine pressor effect), und zwar ohne und nach 14 Tagen einer täglichen Gabe von 20 mg Tranylcypromin. Bei Plazebo-Gabe betrug diese Tyramin-Dosis 1000 bis 1600 mg, eine Tyramin-Dosis also, die in normaler Kost nie erreicht wird. Bei Gabe von Tranylcypromin reichten schon 20 bis 50 mg Tyramin. Diese Tyramin-Dosis kann in Ausnahmefällen mit einer normalen Mahlzeit eingenommen werden. Tranylcypromin verursacht also eine etwa 30fache Verringerung der Tyramin-Verträglichkeit. Die entsprechenden Ergebnisse nach 14 Tagen Moclobemid-Gabe waren 800 bis 2000 mg Tyramin vor und 150 bis 500 mg Tyramin nach der Gabe des reversiblen und selektiven MAO-A-Hemmers. Moclobemid verursachte also eine nur etwa 5fache Verringerung der Tyramin-Verträglichkeit. Die Erhöhung des Blutdrucks nach Einnahme von Tyramin blieb im Mittel für etwa zwei Stunden unter Tranylcypromin und für eine Stunde unter Moclobemid erhalten [12].
Toxizität
Die orale LD50 von Tranylcypromin beträgt etwa 75 mg/kg (Ratte). Entsprechend einer Abschätzung des Sicherheitsfaktors für verschiedene Antidepressiva als Quotient der LD50 und der therapeutischen Dosis [67] ergibt sich für Tranylcypromin der Wert 132 (das 132fache der therapeutischen Dosis), wenn als therapeutische Dosis 40 mg/d und als Körpergewicht des durchschnittlichen Patienten 70 kg angesetzt werden. Die Werte von Amitriptylin und Imipramin sind 106 und 135 sowie von Fluoxetin und Paroxetin 904 und 748. Die akute Toxizität von Tranylcypromin ist also quantitativ vergleichbar den TZA und um einen Faktor von etwa 6 höher als für SSRI. Als Vorgriff auf klinische Daten sei die retrospektive Erhebung fataler Antidepressiva-Intoxikationen einer 5-Jahresperiode (1987 bis 1992) angeführt [54]. Von 26 Antidepressiva steht Tranylcypromin an 8. Stelle bei fatalen Vergiftungen pro Verordnungshäufigkeit (28 Todesfälle/1 Mio. Verschreibungen) und an 12. Stelle pro definierte Tagesdosen (0,54 Todesfälle/1 Mio. DDD). In Übereinstimmung mit der obigen Abschätzung erscheinen TZA häufiger und SSRI seltener in den Protokollen.
Studien und Fallberichte bei Depressionen und weiteren psychiatrischen Störungen
Tranylcypromin wird klinisch als psychomotorisch stimulierend, stimmungsaufhellend und anxiolytisch beschrieben. In einer Übersicht zu kontrollierten Therapievergleichen sind 19 Studien mit Tranylcypromin enthalten (insgesamt 1220 Patienten, Tranylcypromin in Dosen von 10 bis 150 mg/d) [71]. Die Überlegenheit gegenüber Plazebo wurde in allen entsprechenden fünf Studien gezeigt. Sieben Studien ergaben Überlegenheit von Tranylcypromin im Vergleich zu Imipramin, Amitriptylin, Hydroxytryptamin, Nomifensin und Moclobemid. In sechs Studien mit Imipramin, Amitriptylin, Nortriptylin und Brofaromin wurde für Tranylcypromin ein übereinstimmendes Therapieansprechen gefunden. Eine Überlegenheit von Tranylcypromin gegenüber dem reversiblen MAO-Hemmer Moclobemid folgt aus zwei Studien, in denen Umstellungsversuche beschrieben werden [44, 132]. Beispielsweise erfuhren 30 mit 10 und 20 mg Tranylcypromin täglich gut eingestellte Patienten schon in der ersten Woche nach Umstellung auf 450 und 600 mg Moclobemid täglich Rückfälle mit Antriebsverlust und depressivem Grübeln [44]. Kontrollierte klinische Vergleichsstudien neuerer Antidepressiva wie Mirtazapin und Reboxetin mit Tranylcypromin fehlen.
Tranylcypromin bei therapieresistenter Depression
Tranylcypromin wird bevorzugt bei sogenannter therapieresistenter Depression eingesetzt. Die Verwendung als „Antidepressivum 2. Wahl“ ergibt sich vor allem aus der Notwendigkeit einer besonderen Diät (s. u.). Andererseits macht der eigenständige Wirkungsmechanismus Tranylcypromin zu einem interessanten Therapieansatz (Abb. 1). Beim Wechsel auf Tranylcypromin werden nicht nur neue aminerge Strukturen des ZNS einbezogen, da es Serotonin, Noradrenalin und Dopamin via Abbauhemmung beeinflusst, sondern es liegt gegenüber der Wiederaufnahmehemmung der meisten anderen Antidepressiva ein prinzipiell neuer Wirkungsmechanismus vor.
Systematische Daten zu therapieresistenter Depression wurden von Thase et al. (1992) in einer offenen Studie für 36 Patienten erhoben, die auf Imipramin und interpersonelle Psychotherapie nicht angesprochen hatten [123]. Bei der darauffolgenden sechswöchigen Behandlung mit Tranylcypromin (20–60 mg/d, im Mittel 38,5 mg/d) sank bei fortdauernder Psychotherapie der Hamilton-Depression-Score (HAMD17) von 19,3±4,7 auf 8,6±6,0 und somit um 52% (p<0,001). 55% der Patienten erfüllten nun die Responsekriterien. Nolen et al. (1988) berichteten über 43 Patienten mit Episoden einer Major Depression, die mit einem oder mehreren TZA erfolglos behandelt worden waren [86]. Diese wurden für vier Wochen mit Serotonin- oder Noradrenalin-Wiederaufnahmehemmern therapiert und erhielten bei ausbleibendem Erfolg für weitere vier Wochen die jeweils andere wiederaufnahmehemmende Substanz. Nach beiden Behandlungsphasen waren lediglich 20% der Patienten gebessert. Ein weiterer Therapieversuch mit Schlafentzug oder 5-Hydroxytryptophan führte wiederum nur bei weiteren 20% der Patienten zu einer Besserung der Symptomatik. Daraufhin erhielten die restlichen 60% der Patienten Tranylcypromin, von denen 58% ansprachen.
Diese Ergebnisse wurden in randomisierten und doppelblinden Studien bestätigt, beispielsweise Vergleich
mit Imipramin [124],
mit dem Serotonin- und Noradrenalin-Wiederaufnahmehemmer und Dopamin-Agonisten Nomifensin (nicht mehr im Handel) [85] und
mit dem reversiblen und selektiven MAO-A-Inhibitor Brofaromin (nicht im Handel) [133].
Die Dosen von Tranylcypromin lagen entsprechend bei
20 bis 60 mg/d [124],
bis zu 100 mg/d [85] und
20 bis 30 mg/d [133]
bei einer Therapiedauer von vier bis sechs Wochen.
Die Vorbehandlung bestand überwiegend in TZA aber auch SSRI und Schlafentzug. Tranylcypromin war Imipramin und Nomifensin überlegen sowie vergleichbar mit Brofaromin.
In einer neueren Studie wurde Tranylcypromin (n=39) verglichen mit dem ebenfalls irreversiblen, in Deutschland nicht verfügbaren MAO-Inhibitor Phenelzin (n=38) bei Patienten, die zuvor auf Behandlungen mit Imipramin und Fluvoxamin einschließlich Lithiumsalz-Augmentation und bei therapeutischen Plasmaspiegeln nicht ansprachen [14]. Nach fünf Wochen betrug der Anteil der Patienten, die auf die Therapie ansprachen, gemessen als mindestens 50%ige Besserung des HAMD, 44% bei Gabe von Tranylcypromin (mittlere Dosis 60,5 mg/d, 30 bis 100 mg/d) und 47% bei Gabe von Phenelzin. Sieben Patienten (18%) der Tranylcypromin- und vier (11%) der Phenelzin-Gruppe erreichten eine Remission, die als Endwert der HAMD ≤7 definiert wurde. Kritisch ist allerdings der fehlende Plazebo-Vergleichsarm zu sehen.
Tranylcypromin scheint dem reversiblen und selektiven MAO-A-Hemmer Moclobemid überlegen zu sein, wie sich aus Teilbefunden von direkten Vergleichen [53, 103], vor allem aber aus der klinischen Erfahrung [2, 21] ableiten lässt.
Tranylcypromin bei atypischer Depression
Thase et al. (1995) publizierten eine umfangreiche Literaturübersicht und Metaanalyse über die Wirksamkeit von MAO-Hemmern bei so genannten atypischen Depressionen. Zur Auswertung kamen kontrollierte klinische Studien, in denen irreversible MAO-Hemmer sowohl mit Plazebo als auch mit TZA verglichen wurden [125]. Im Ergebnis wurde festgestellt, dass sowohl Tranylcypromin als auch Phenelzin bei ambulanten depressiven Patienten mit atypischen Depressionen TZA überlegen sind. Verschiedene Autoren sehen MAO-Inhibitoren als Antidepressiva der Wahl bei atypischen Depressionen an [100, 135].
Tranylcypromin bei weiteren Depressionsformen
56 ambulante Patienten mit anerger bipolarer Depression wurden einer sechswöchigen Behandlung mit Tranylcypromin oder Imipramin (jeweils 28 Patienten) unterzogen [55]. Dieser Akutbehandlung folgte eine zehnwöchige Erhaltungstherapie. Die Dosierung wurde mit 20 mg Tranylcypromin täglich und 100 mg Imipramin täglich begonnen und konnte bis auf 60 mg Tranylcypromin und 300 mg Imipramin täglich gesteigert werden. 26 Patienten der Tranylcypromin- und 21 Patienten der Imipramin-Gruppe nahmen vier Wochen und länger an der Studie teil. Von diesen erfüllten 81% in der Tranylcypromin- und 48% in der Imipramin-Gruppe die Responsekriterien.
In einer offenen Studie wurden 14 Patienten zusammengefasst, die zwischen drei und über 30 Jahren an einer saisonal abhängigen Depression (Herbst-Winter-Depression) litten, und zwar mit Therapieresistenz bei vorheriger Verwendung von TZA [30]. Gemessen mit der Carroll-Rating-Scale for Depression sprachen 90% der Patienten sehr gut bis befriedigend auf die durchschnittlich 23 Tage dauernde Behandlung mit Tranylcypromin an. Die Tranylcypromin-Dosis betrug zwischen 20 und 50 mg/d (im Mittel 32,1 mg/d).
Eine kleine Fallserie wurde für vier Patienten mit wahnhafter Depression beschrieben [73], die nach erfolgloser Behandlung mit TZA eine beeindruckende Besserung bei der Gabe von 20 bis 40 mg Tranylcypromin täglich aufwiesen.
Joffe (1996) berichtet über zwei Fälle mit recurrent brief depression, die anhaltend und regelmäßig wiederkehrende Episoden von Depression über mehrere Jahre hatten und erst bei einer Therapie mit Tranylcypromin in Dosierungen bis 40 und 60 mg/d erfolgreich behandelt werden konnten [61].
Tranylcypromin bei anderen psychiatrischen Erkrankungen
16 ambulante Patientinnen mit Borderline-Syndrom wurden in einer doppelblinden Cross-over-Studie im Vergleich zu Plazebo mit Alprazolam, Carbamazepin, Trifluoperazin und Tranylcypromin (bis zu 40 mg/d) behandelt. Jede Behandlungsphase dauerte sechs Wochen. Von den behandelnden Ärzten wurden die Patienten, die Tranylcypromin und Carbamazepin erhielten, im Vergleich zu Plazebo als signifikant gebessert eingestuft, und bei diesen Behandlungen gab es auch die wenigsten Therapieabbrüche. In der Selbstbeurteilung schätzten sich nur die Tranylcypromin-Patienten als signifikant verbessert gegenüber Plazebo ein [27].
In einer offenen Studie nahmen 32 Patienten mit sozialer Phobie über ein Jahr Tranylcypromin in Dosen zwischen 40 und 60 mg/d ein [131]. Von 29 Patienten hatten nach einem Jahr 19 (62%) eine ausgeprägte und fünf (17%) eine mäßige Besserung der Symptomatik. Erfurth und Schmauß (1993) berichteten über zwei Patienten, die sich wegen einer schweren Zwangserkrankung einer stationären psychiatrischen Behandlung unterziehen mussten und durch eine Therapie mit Tranylcypromin deutlich gebessert werden konnten [34].
Verträglichkeit von Tranylcypromin
Nahrungsmittelinteraktionen
Ein spezielles Risiko der konventionellen MAO-Inhibitoren ergibt sich durch biogene Amine, beispielsweise Tyramin und Histamin, die in einigen Nahrungsmitteln wie stark gereiftem Käse vorkommen können. Tyramin steht im Vordergrund der Risikodiskussion, da es als indirektes Sympathomimetikum eine krisenhafte Erhöhung des Blutdrucks, in sehr seltenen Fällen bis hin zu Hirnblutungen, sowie starken Kopfschmerz und Übelkeit hervorrufen kann. Das aufgenommene Tyramin wird normalerweise im Intestinum und der Leber durch MAO-A und vor allem MAO-B desaminiert und so toxikologisch unwirksam. Eine Hemmung beider MAO-Isoenzyme schaltet diese natürliche Schutzfunktion ab und es kann demzufolge zum beschriebenen so genannten „cheese-effect“ kommen [13].
Die nach Einführung der irreversiblen und nichtselektiven MAO-Hemmer tatsächlich in seltenen Fällen beobachteten Tyramin-bedingten Blutdruckkrisen [15] haben das Interesse an diesen Wirkstoffen gedämpft und die Entwicklung anderer Antidepressiva vorangetrieben. Allerdings zeigte die klinische Erfahrung, dass bei Beachtung einer Tyramin-armen Diät auch Tranylcypromin ein sicheres Arzneimittel ist [49]. Zur Bewertung des Nutzen-Risiko-Verhältnisses im Vergleich mit anderen Antidepressiva wird auf ein „übertriebenes Risiko hypertensiver Krisen“ hingewiesen [11]. Allerdings muss betont werden, dass die einzuhaltende Compliance mit den Diätrichtlinien ein entscheidendes Kriterium für die Auswahl von Patienten für Tranylcypromin ist. Über die notwendigen Restriktionen muss der Patient ausführlich mündlich und schriftlich, am besten durch die Mitgabe eines Merkblatts, aufgeklärt werden.
Biogene Amine reichern sich in Lebens- und Genussmitteln durch mikrobielle Stoffwechselprozesse an, zumeist durch Ab- und Umbau von Proteinen bzw. der zugrunde liegenden Aminosäuren (z.B. Tyramin aus Tyrosin, Histamin aus Histidin). Das geschieht bei der normalen Herstellung einiger durch Fermentation gewonnener Lebensmittel (z.B. Käse, Tofu), durch die Inkaufnahme fermentativer Prozesse bei der Haltbarmachung und Ausbildung eines produkttypischen Geschmacks (z.B. Salami, vor allem mit Edelschimmelbelag), aber auch infolge von zu warmer Lagerung (z.B. Fisch, Fleisch) bis hin zu Verderbnis (z.B. unkontrollierter biologischer Säureabbau in Wein, so genannter Säuresturz). In einigen pflanzlichen Produkten sind biogene Amine als physiologischer Bestandteil enthalten (z.B. Bananenschalen), oft aber nur in Abhängigkeit von den spezifischen Sorten und Anbaubedingungen (z.B. Kakao). Um eine Vorstellung über die Größenordnungen des Gehalts von Tyramin in Lebensmitteln zu ermöglichen, seien wenige Beispiele der äußerst umfangreichen Literatur vorgestellt (Tab. 1). Zu berücksichtigen ist die große Variationsbreite innerhalb eines Produkts. Für das Risiko einer Nahrungsmittelinteraktion entscheidend ist natürlich die Menge des verzehrten Tyramin-haltigen Lebensmittels, wobei etwa nur 50% des in einer Mahlzeit enthaltenen Tyramins resorbiert werden [130]. Es wird diskutiert, dass eine Menge bis etwa 6 mg Tyramin pro Mahlzeit auch während Behandlung mit Tranylcypromin für die meisten Patienten noch gut verträglich ist [12, 40].
Tab. 1. Gehalt von Tyramin in Schnittkäse, deutschen Weißweinen, Schokolade und Fruchtfleisch der Banane sowie Abschätzung der überwiegend mit einer Mahlzeit aufgenommenen Menge
|
Lebensmittel |
Tyramin-Gehalt |
Verzehrmenge |
Aufgenommene Tyramin-Menge mit einer Mahlzeit# [mg] |
Quelle |
|
Edamer Schnittkäse |
10,0 |
50–150 |
0–63,4 |
[69] |
|
Deutscher Weißwein |
0,04 |
125–250 |
<0,005–1,75 |
[31] |
|
Schokolade |
0,4–1,2** |
25–100 |
0,05–0,6 |
[57] |
|
Bananenpulpe |
0,7*** |
100–250 |
0,35–0,9 |
[4] |
# Etwa 50% des Tyramins werden resorbiert, * Mittelwert (Bereich), ** Bereich, *** Mittelwert
Bei der Bewertung historischer Daten ist zu berücksichtigen, dass sich die Technologie der Herstellung vieler Lebens- und Genussmittel in den letzten Dekaden grundlegend verbessert hat, auch in Hinsicht des Gehalts an biogenen Aminen (z.B. trockene Weißweine durch Verwendung von Reinzuchthefen). Die verbesserte Lagerung im Handel und beim Kunden hat das Risiko der Entstehung von Tyramin durch Verderbnis ebenfalls verringert. Insgesamt werden mehr frische Nahrungsmittel konsumiert. Das spricht insgesamt für eine Verringerung des Risikos.
Spezialisten beispielsweise der Psychiatrischen Universitätsklinik Toronto [40] und der Psychiatrischen Universitätskliniken Memphis und San Francisco [19] empfehlen für eine einfache und praktikable Diät die Beschränkung auf den Ausschluss gereifter Käsesorten, gealterten und gepökelten Fleischs, von Bananenschalen (gemeint wohl bestimmte Sorten, die mit Schale konsumiert werden), dicker Bohnen, von unzureichend gelagertem Fleisch, Geflügel und Fisch (einschließlich eingelegtem Fisch), von Marmiten (Schmieren aus Hefeextrakt), Sojasoße und -würze, Sauerkraut sowie Fassbier. Weißwein und in Flaschen oder Dosen abgefülltes Bier sind in moderaten Mengen möglich. Restriktionen für Produkte wie Avocado, Bananenfruchtfleisch, Schokolade, frische Käsesorten, Sojamilch und ähnliches werden als überzogen betrachtet. Die Diät wird damit als gut handhabbar bewertet ähnlich anderen und heute recht verbreiteteten Kranken- und Schondiäten.
Selbstverständlich gehen die strengeren Diätrichtlinien anderer Autoren immer von einer sehr hohen Empfindlichkeit jedes einzelnen Patienten gegenüber der Wirkung biogener Amine aus. Dabei ist bekannt, dass recht große interindividuelle Unterschiede existieren [12]. Im Verlaufe einer längeren Therapie mit Tranylcypromin finden Patienten oft ihre eigene angepasste Diät.
Unerwünschte Arzneimittelwirkungen
In einer randomisierten und doppelblinden Vergleichsstudie mit Plazebo und Nortriptylin (75 bis 150 mg/d), die alle Schweregrade von unerwünschten Arzneimittelwirkungen (UAW) berücksichtigte [140], waren für Tranylcypromin (30 bis 60 mg/d) Schwindel, Schlafstörungen und noradrenerg bedingte Mundtrockenheit die häufigsten und gegenüber Plazebo auch statistisch häufigeren Erscheinungen (Abb. 3). Die Anzahl der im Verlauf der vierwöchigen Studie berichteten verschiedenen UAW betrug pro Patient im Mittel 4,5 für Tranylcypromin, 4,8 für Nortriptylin und 2,3 für Plazebo. In einer Vergleichsstudie mit Amitriptylin wird das Fehlen anticholinerger UAW von Tranylcypromin betont [98].
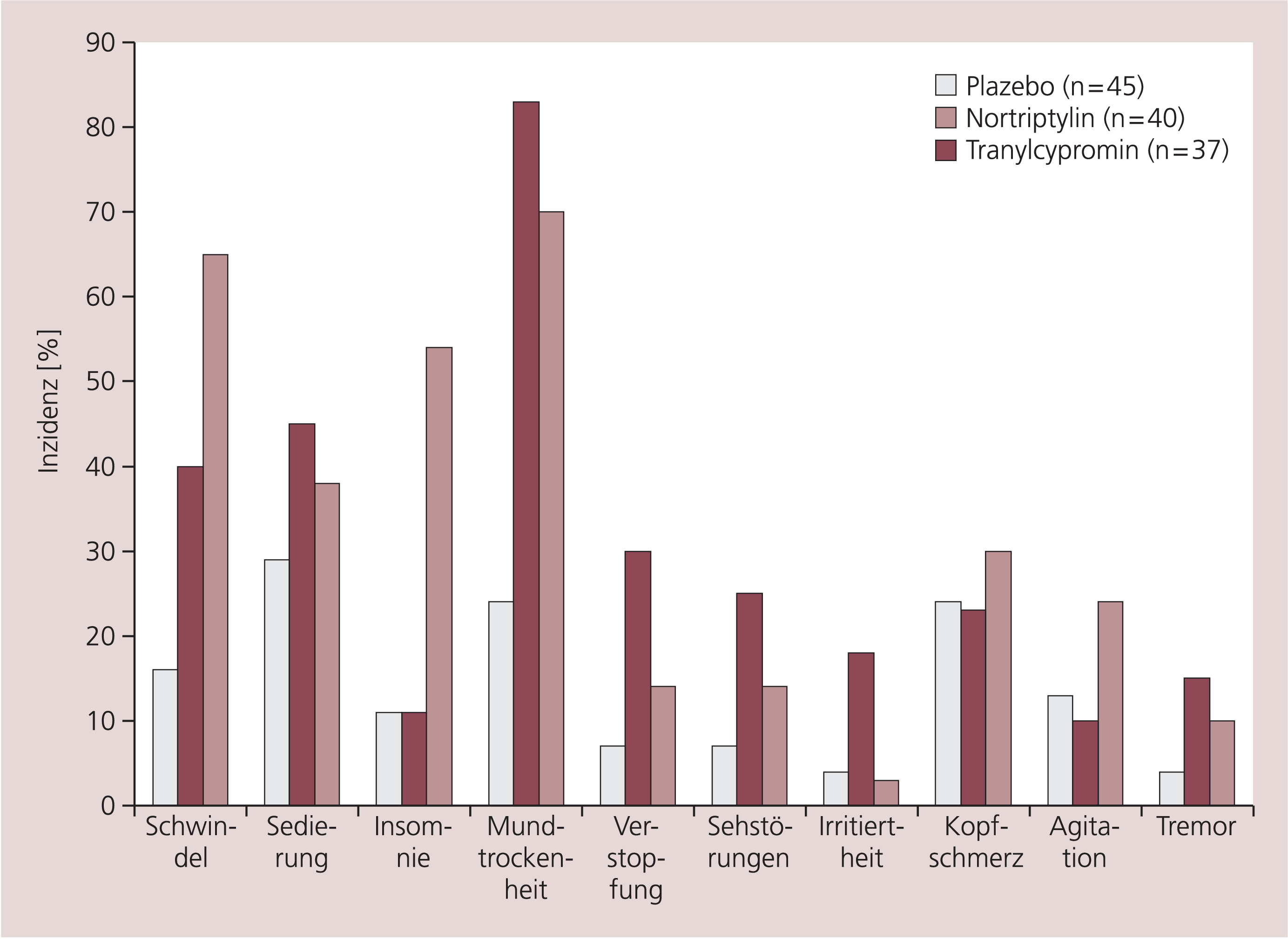
Abb. 3. Vergleich unerwünschter Arzneimittelwirkungen (UAW) von Tranylcypromin, Nortriptylin und Plazebo unter Einschluss von UAW geringen und milden Schweregrads
In einer retrospektiven Sichtung der Unterlagen von 280 Behandlungen aus kontrollierten Studien wurde der Vergleich von medizinisch signifikanten und den Patienten mehr als nur geringfügig beeinträchtigenden UAW von Tranylcypromin (50 ± 15 mg/d), Imipramin (269 ± 68 mg/d) und Plazebo (Abb. 4) unternommen [97]. Agitiertheit/Unruhe, Kopfschmerz und Schlafstörungen erreichten nicht den hier als medizinisch signifikant definierten Grad und wurden letztlich als handhabbar befunden. Im Vordergrund auch dieser Studie steht für Tranylcypromin die orthostatische Dysregulation.
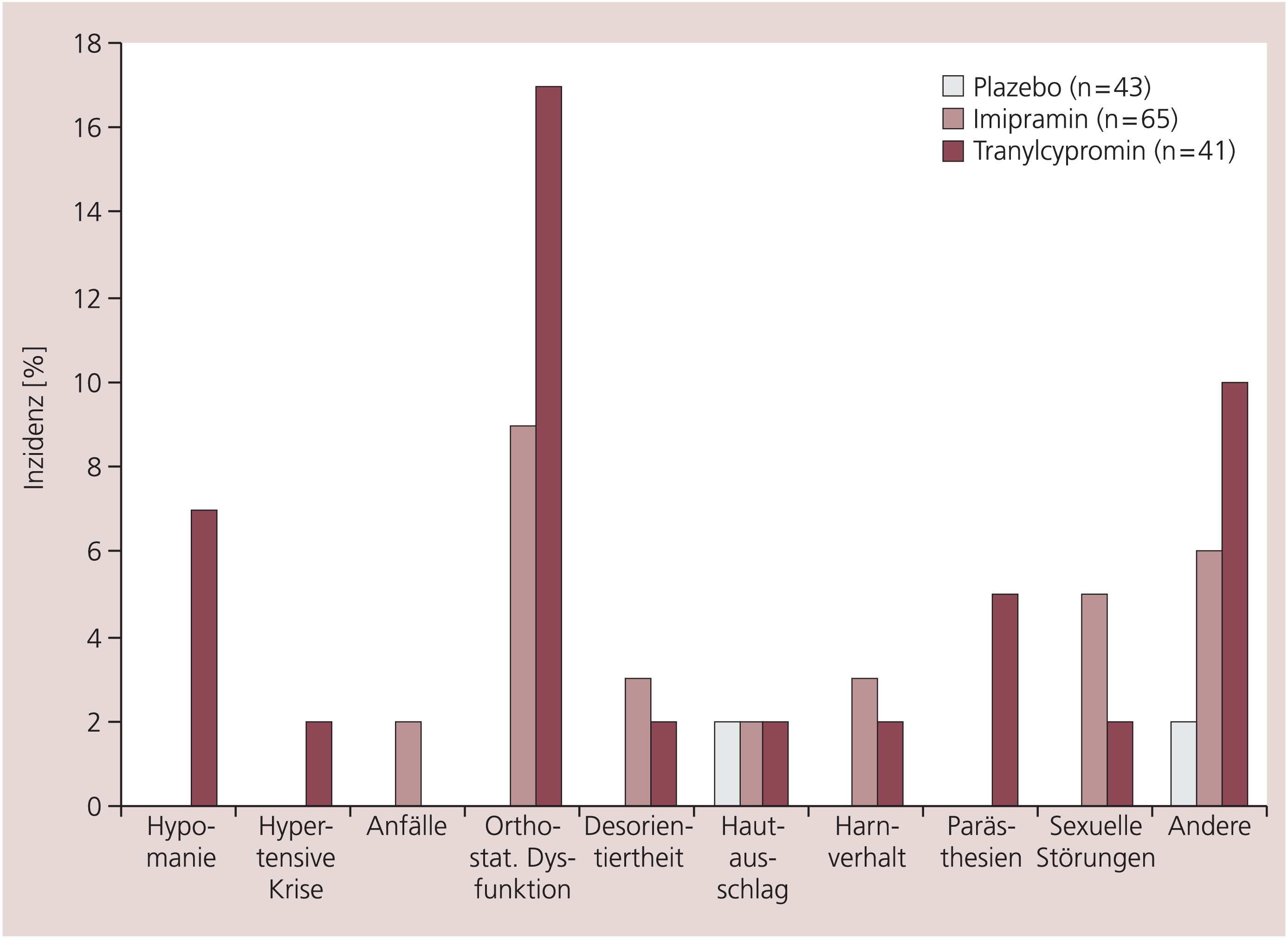
Abb. 4. Vergleich von medizinisch signifikanten und den Patienten mehr als nur geringfügig beeinträchtigenden unerwünschten Arzneimittelwirkungen (UAW) von Tranylcypromin, Imipramin und Plazebo
In einem prospektiven Vergleich mit Phenelzin [14] wurde jüngst für eine Dosis von 60,5 mg Tranylcypromin täglich (30 bis 100 mg/d) gefunden:
Schwindel (26% leicht bis moderat, 18% stark)
Agitiertheit/Unruhe (8% leicht bis moderat, 21% stark)
Kopfschmerz (8% leicht bis moderat, 10 % stark)
Tagesmüdigkeit (5% leicht bis moderat)
Schlafstörungen (10% leicht bis moderat, 21% stark)
Der Anteil starker Schlafstörungen könnte zu hoch bewertet sein, da Tranylcypromin entgegen dem sonst üblichen Vorgehen auch abends verabreicht wurde. Bei keinem Patienten kam es unter Tranylcypromin wegen UAW zum Therapieabbruch, bei 20% wurde aber aufgrund orthostatischer Dysregulation auf eine Dosiserhöhung verzichtet.
Zur Abschätzung der Häufigkeit schwerwiegender Ereignisse und UAW befragten Haase et al. (1973) [49] etwa 3000 deutsche Psychiater zu ihren klinischen Erfahrungen mit Tranylcypromin (damals noch fixe Kombination von 10 mg Tranylcypromin mit 1 mg Trifluoperazin). Die Auskünfte über etwa 100000 Patienten ergaben, dass das Präparat bei einer mittleren Dosis von 10 bis 20 mg Tranylcypromin täglich für die meisten Patienten gut verträglich war. Nur bei 1679 Patienten musste die Therapie aufgrund nicht tolerierbarer UAW abgebrochen werden (1,7%). Schwerwiegende Ereignisse waren intrakranielle Blutungen bei sechs (davon drei fraglich) von 100000 Patienten (0,006%), drei fatale Ereignisse, wobei der MAO-Hemmer letztlich nicht kausal war, vier weitere schwerwiegende Ereignisse wie Infarkt und Parese beim Absetzen sowie neun Suizidversuche mit einer Überdosis (0,009%). Schließlich wurden 64 schwerwiegende Fälle (0,06%) von Nahrungsmittelinteraktionen mitgeteilt. Insgesamt machten 60 von 3000 Psychiatern Erfahrungen mit hypertensiven Krisen (vorwiegend Diätfehler). In einer vergleichbaren Erhebung wurden 15 Todesfälle bei 3,5 Mio. Patienten (0,0004%) infolge zerebrovaskulärer Ereignisse gezählt, für die eventuell ein Zusammenhang mit Tranylcypromin bestand [7].
In einer aktuellen Übersicht zur Veränderung der Krampfschwelle unter Psychopharmaka wird geschlussfolgert, dass Tranylcypromin verglichen mit anderen Antidepressiva ein geringes Risiko aufweist [93]. Andere seltene UAW sind Diarrhö, ein nach Absetzen reversibler Haarausfall, Schwitzen und Blutbildveränderungen. Wiederholt wird die gute kardiale Verträglichkeit von Tranylcypromin festgestellt, beispielsweise in einer Vergleichsstudie mit Amitriptylin [98].
Als Vergleichswerte für 1,7% UAW-bedingte Therapieabbrüche unter Tranylcypromin [49] können die epidemiologischen Daten des AMSP-Projekts (Arzneimittelsicherheit in der Psychiatrie) dienen: 1,0% schwerwiegende UAW bei TZA, 0,7% bei SSRI, 0,7% bei MAO-Hemmern (vorwiegend Moclobemid), 0,9% bei Venlafaxin und 0,6% bei Mirtazapin [29]. Auf einem insgesamt niedrigen Niveau scheint die Häufigkeit für Tranylcypromin etwas höher zu liegen als bei anderen Antidepressiva.
In einer Gesamtschau sind die dominierenden UAW von Tranylcypromin somit orthostatische Dysfunktion/Schwindel, Agitiertheit und Schlafstörungen. Abgesehen von einer Studie (Abb. 5) fehlen vergleichende Untersuchungen mit den seit etwa 1990 eingeführten Antidepressiva wie SSRI, Reboxetin, Mirtazapin und Venlafaxin.
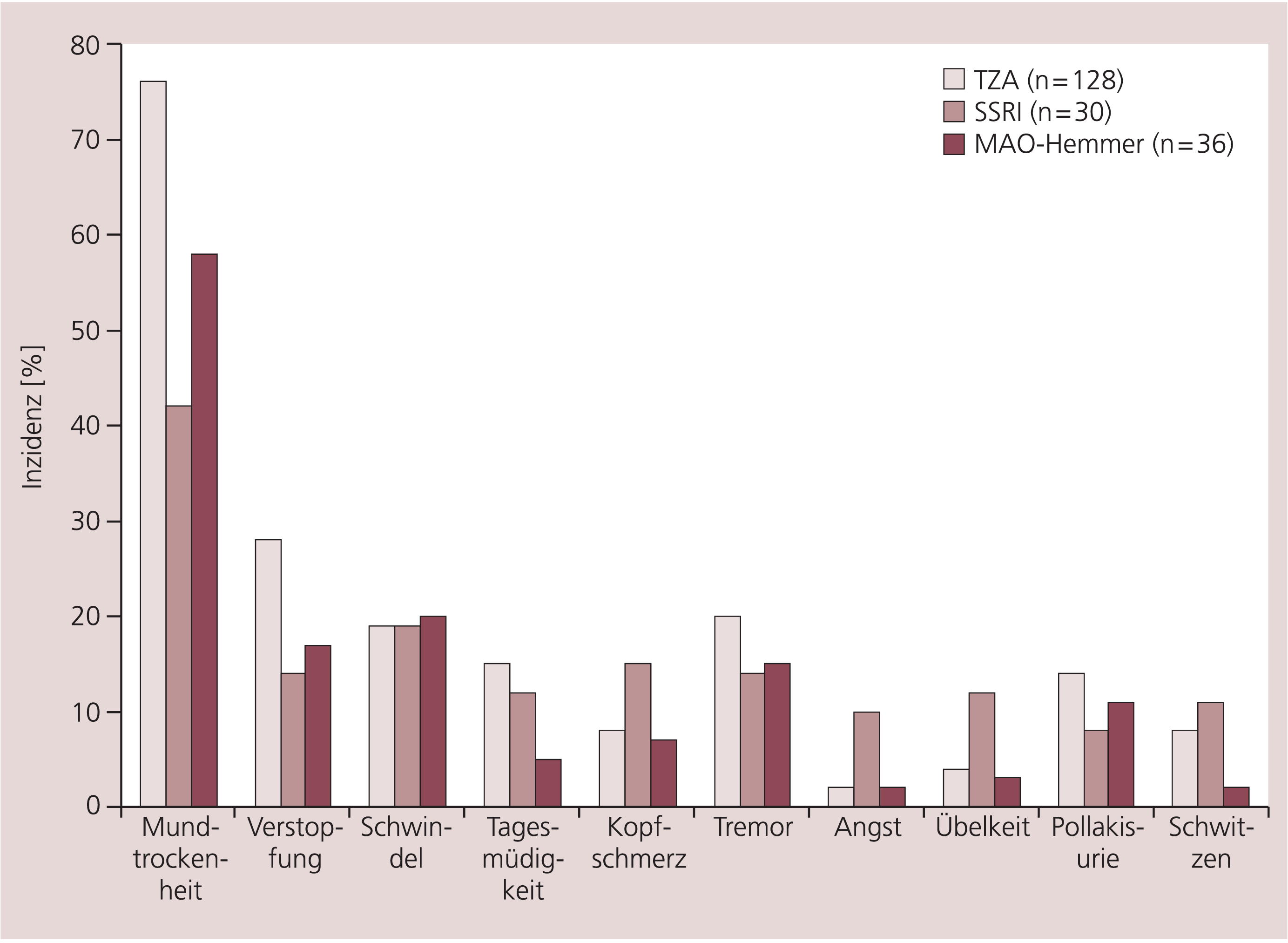
Abb. 5. Vergleich der häufigen UAW von TZA, SSRI und MAO-Hemmern (Tranylcypromin: n=22, Phenelzin: n=8, Moclobemid: n=6) bei Patienten >65 Jahre
Wichtige Arzneimittelinteraktionen
Die Kombination verschiedener serotonerger Arzneimittel ist wegen des Risikos eines Serotonin-Syndroms immer kontraindiziert. Die wichtigsten Arzneimittelwechselwirkungen mit Tranylcypromin (Tab. 2) betreffen deshalb auch eine gegenseitige Verstärkung zentraler serotonerger Effekte [13]. Streng kontraindiziert sind alle ihrerseits stark serotonerg aktiven Substanzen, sei es durch Wiederaufnahmehemmung, agonistisch-postsynaptische Effekte oder Serotonin-Vorstufen [20, 36, 74, 89, 94]. Für moderat und wenig serotonerg wirksame Substanzen bei zusätzlich noradrenergem Wirkungsspektrum, wie etwa einige TZA (Amitriptylin, Doxepin, Nortriptylin, Trimipramin), besteht nur eine relative Kontraindikation. In der Regel werden diese zusammen mit Tranylcypromin gut vertragen, wenn die Reihenfolge des Beginns der Behandlung beachtet wird. Eine langsame Aufdosierung von Tranylcypromin zu einer laufenden Amitriptylin-Therapie sowie gemeinsames langsames Aufdosieren sind möglich. Damit versteht sich, dass beim Umstellen von überwiegend noradrenergen TZA auf Tranylcypromin nur eine sehr kurze Wartezeit oder sogar ein überlappender Übergang möglich ist, wie in einer retrospektiven Untersuchung bei über 400 Patienten bestätigt wurde [63]. Einige Opioid-Analgetika der Pethidin-Gruppe (Phenylpiperidine: Pethidin, Tramadol, Methadon, Dextromethorphan und Propoxyphen) hemmen ebenfalls die präsynaptische Serotonin-Aufnahme und sind deshalb kontraindiziert [42], was natürlich ebenso für diese Opioid-Analgetika mit SSRI und Mirtazapin zutrifft [43].
Tab. 2. Arzneimittelinteraktionen von Tranylcypromin (strenge Kontraindikationen fett hervorgehoben)
|
Arzneimittel |
Symptome |
|
SSRI, Clomipramin, Venlafaxin, |
Serotonin-Syndrom |
|
Serotonin-Agonisten (5-HT1B/1D-Agonisten, Buspiron) |
Serotonin-Syndrom |
|
Serotonin-Vorstufen (L-Tryptophan) |
Serotonin-Syndrom |
|
Andere überwiegend serotonerge TZA, insbesondere Imipramin |
Serotonin-Syndrom |
|
Insulin, orale Antidiabetika |
Wirkungsverstärkung |
|
Bupropion |
Verstärkte UAW (Agitiertheit) |
|
Levodopa ohne Decarboxylasehemmer |
Peripheres Dopamin ↑ |
|
Betablocker |
Bradykardie |
|
Disulfiram |
Toxisch |
|
Indirekte Sympathomimetika |
Hypertonie |
|
Pethidin, Tilidin, Tramadol |
Serotonin-Syndrom |
|
Barbiturate (Anästhesie) |
Dosis geringer |
|
Ether |
Toxisch |
|
Dextromethorphan |
Psychosen, bizarres Verhalten |
|
Guanethidin, Methyldopa |
Störung Blutdruckregulation |
Die unkontrollierte Einnahme indirekter Sympathomimetika [56] wie Ephedrin, die in Nasentropfen, Husten- und Grippemitteln sowie Appetitzüglern enthalten sein können, kann wegen der peripher erhöhten präsynaptischen Amin-Freisetzung zu entsprechenden Reaktionen im Herz-Kreislauf-System führen. Bei Betablockern sind Bradykardie, aber auch Hypotonie zu beachten [99].
Schließlich müssen Wechselwirkungen mit anderen MAO-Hemmern beim Umstellen berücksichtigt werden: Beim Absetzen von Moclobemid bildet sich die MAO-Aktivität parallel zur Ausscheidung dieses reversiblen MAO-Hemmers zurück. Bei einer Halbwertszeit von Moclobemid von ein bis sechs Stunden und einem Sicherheitsfaktor wegen langsamerer Ausscheidung aus dem ZNS sollte ein Abstand von drei bis vier Tagen ausreichen.
Besondere Fragestellungen der therapeutischen Praxis
Umstellung auf Tranylcypromin
Bei serotonergen Substanzen und Moclobemid als Vormedikation sind Abstände von mindestens fünf Halbwertszeiten einzuhalten (nota: Fluoxetin!). Im Falle noradrenerger Vormedikation kann praktisch ohne Pause mit der Aufdosierung von Tranylcypromin begonnen werden, sogar überlappende Übergänge sind möglich.
Übliche Dosierung und Hochdosistherapie
Tranylcypromin liegt in Deutschland als 10-mg-Filmtablette vor (Jatrosom® N). Die therapeutische Zieldosis beträgt drei bis vier Tabletten täglich in der 3. bis 4. Woche nach langsamer und schrittweiser Dosisanpassung, beginnend mit einer Tablette täglich in der 1. Woche. Um das Risiko von Schlafstörungen zu verringern, sollte die letzte tageszeitliche Dosis nicht später als 15.00 Uhr eingenommen werden.
In mehreren Serien von Fallberichten wird geschildert, dass Tranylcypromin in höheren als den sonst therapeutisch verwendeten Dosierungen eine sichere und wirkungsvolle Behandlungsmaßnahme für therapieresistente Depressionen darstellt. In einer Hochdosistherapie gaben beispielsweise Schmauß (1996) [106] und Bschor und Bauer (2004) [21] um 80 mg/d sowie weiter um 90 mg/d [102], 90 bis 170 mg/d [1] oder 100 bis 200 mg/d [48, 91]. Bemerkenswert ist, dass in diesen Kasuistiken die Herz-Kreislauf-Parameter keine Auffälligkeiten aufwiesen und keine Tyramin-Reaktionen beobachtet wurden.
Tranylcypromin und Anästhesie
14 Patienten unter MAO-Hemmer-Therapie (drei Monate bis drei Jahre) zeigten keine perioperativen Nebenwirkungen. Als geeignete Anästhetika wurden Morphin und Fentanyl verwendet [33]. Auch Codein, Oxycodon und Buprenorphin sind möglich [42]. Inhalationsanästhetika und Benzodiazepine sind ebenfalls gefahrlos verwendbar. Die Dosis von Barbituraten sollte verringert werden. Interaktionen mit Vecuronium und Atracurium sind nicht bekannt. Lokalanästhetika wie Lidocain können ebenfalls gefahrlos gegeben werden [72, 127]. Da Tranylcypromin häufig die Ultima Ratio der Depressionsbehandlung darstellt, wird die Notwendigkeit des Absetzens vor einer Operation kontrovers beurteilt und zum Teil als unnötig angesehen [88, 92, 112, 115, 137]. Erwähnenswert ist, dass bei Absetzen von Tranylcypromin 20 Tage vor einer Operation schwere perioperative Hypotension nach Gabe von Bupivacain gefunden wurde [114]. Bei Rückbildung der vollen MAO-Aktivität lag eventuell eine noch nicht vollständige Rückbildung der Aktivität beta-adrenerger Rezeptoren vor (Down-Regulation), wodurch zwischenzeitlich eine verringerte Toleranz für hämodynamischen Stress bestand. Das größere perioperative Risiko könnte also nicht bei bestehender MAO-Hemmung, sondern erst durch Störungen der sich unter dem Antidepressivum eingestellten Homöostase vorliegen.
Aus einer Studie zur intravenösen Gabe von Phenylephrin, Norepinephrin (Noradrenalin), Epinephrin (Adrenalin) und Isoprenalin nach MAO-Hemmern (Phenelzin, Tranylcypromin) und Imipramin mit gesunden Probanden ließ sich ableiten, dass für MAO-Hemmer kein bedeutendes Extrarisiko besteht [17, 126]. MAO-Hemmer-Einnahme ist also wenig relevant für Zahnbehandlungen mit Lokalanästhetika und Zusätzen von Epinephrin/Norepinephrin. Es gilt aber, dass Patienten mit ischämischer Herzkrankheit keine Lokalanästhetika mit Epinephrin/Norepinephrin-Zusatz erhalten sollten, unabhängig von eventueller MAO-Hemmer-Einnahme. Bei empfindlichen Patienten ist eine niedrigere Dosis von Epinephrin und Norepinephrin im Lokalanästhetikum zu wählen. Alternativ kann auf den vasokonstriktiven Zusatz Octapressin ausgewichen werden.
Tranylcypromin und EKT
Monaco und Delaplaine (1964) berichteten in einer Plazebo-kontrollierten Studie an insgesamt 22 Patienten über die Verträglichkeit von Elektrokrampfbehandlung und Tranylcypromin [82]. Im Übrigen sind die Daten zur Anästhesie zu beachten.
Absetzen von Tranylcypromin, Suchtpotenzial
Eine Dosisreduktion oder das Absetzen von Tranylcypromin sollte unter sorgfältiger ärztlicher Beobachtung erfolgen, da wie für andere Antidepressiva in seltenen Fällen Absetzphänomene beschrieben wurden [50]. Die Patienten entwickelten depressive Symptome bereits wenige Tage nach der Dosisreduktion, zum Teil verbunden mit Verwirrtheit und mäßig bis schwergradig ausgeprägten Wahrnehmungsstörungen. Ist schnelles Absetzen von Tranylcypromin beispielsweise bei ausbleibendem Therapieerfolg notwendig, kann trotzdem versucht werden, die Dosis in Schritten von 10 bis 20 mg jeden 2. bis 3. Tag zu senken. Als Übergang bis zu einem Therapieversuch, der im direkten Anschluss wegen Interaktionen mit Tranylcypromin nicht möglich ist, kann ein vorwiegend noradrenerges Antidepressivum gegeben werden.
Tranylcypromin wurde nur in sehr seltenen Fällen im Zusammenhang einer missbräuchlichen Einnahme gefunden, und das immer nur bei Patienten, für die schon vorher Missbrauch bekannter suchterzeugender Substanzen vorlag. In einer 30 Jahre überblickenden Übersicht wurden 18 Fälle registriert [18]. So findet sich ein Fallbericht über eine 35-jährige Patientin mit bekannter Alkoholabhängigkeit, die zusätzlich Tranylcypromin in Dosierungen bis zu 600 mg/d einnahm, zunächst scheinbar ohne Unverträglichkeitsreaktionen, darunter aber eine schwere Thrombozytopenie und in der Folge nach Reduktion und Absetzen ein Entzugssyndrom mit Delir entwickelte [118].
Wirkungsverlust
Vor dem Hintergrund der methodologischen Problematik einer beobachteten Wirkungsabschwächung liegen wie für andere Antidepressiva entsprechende Fallbeschreibungen zu Tranylcypromin vor. So wird über vier Patienten berichtet, die nach anfänglichem guten Therapieansprechen bei 20 mg Tranylcypromin täglich und bei bestehender hoher MAO-Hemmung in den Thrombozyten nach acht bis zehn Wochen Rückfälle der Depression in der gesamten Breite der Symptomatik erlebten [80]. Diese wurden erst nach Dosiserhöhung auf 40 mg/d rückläufig. Als Ursache diskutieren die Autoren eine adaptive Anpassung des Stoffwechsels von Monoaminen, die wieder zu einer Verringerung zentraler Neurotransmitter führt.
Alltagssicherheit/Fahrtauglichkeit
In eine Studie mit 23 depressiven ambulanten Patienten, die mit 40 bis 80 mg/d Tranylcypromin behandelt wurden, gaben vier Patienten Müdigkeit und ein verstärktes Schlafbedürfnis am späten Nachmittag an, wodurch ihre Fähigkeit zum Arbeiten und zur Verkehrsteilnahme beeinträchtigt wurde [104]. An anderer Stelle wird über acht Patienten berichtet, die zwar sehr gut mit Tranylcypromin behandelt werden konnten, aber ausgeprägte nachmittägliche Schläfrigkeit und nächtliche Schlafstörungen schilderten [122]. Weit häufiger als über Somnolenz wird bei Einnahme von Tranylcypromin jedoch über Erregungszustände und Schlafstörungen berichtet [141]. Es ist festzuhalten, dass die Einnahme von Tranylcypromin auch bei bestimmungsgemäßem Gebrauch und insbesondere in den ersten Tagen der Therapie die Fähigkeit zur aktiven Teilnahme am Straßenverkehr und zum Bedienen von Maschinen beeinträchtigen kann. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol oder zentral dämpfenden Arzneimitteln.
Tranylcypromin und ältere Patienten
Die MAO-Aktivität nimmt mit dem Alter im Plasma, in den Blutplättchen und im ZNS zu. Dies führt zur Verringerung von zentralem Noradrenalin und Serotonin, weshalb eine erhöhte Vulnerabilität für Depressionen diskutiert wird [60, 134]. Kontrollierte Studien zur Anwendung von Tranylcypromin bei älteren Patienten existieren nicht. Viele klinische Studien schlossen aber zu einem nicht geringen Anteil auch ältere Patienten ein, zum Beispiel Patienten mit einem mittleren Alter von 60 Jahren (38 bis 80 Jahre) in einer Studie zu Tranylcypromin bei M. Parkinson [35]. Es wurde eine vergleichbare Verträglichkeit zu Studien mit nur jüngeren Patienten gefunden.
In einer prospektiven, offenen Studie wurden
SSRI (n=30),
TZA (n=128) und
MAO-Hemmer (Tranylcypromin: n=22, Phenelzin: n=8, Moclobemid: n=6)
bei ambulanten Patienten (>65 Jahre) mit Major Depression über eine Therapiedauer von mehreren Monaten bis zu zwei Jahren verglichen [81]. Aus den Aufzeichnungen der Montgomery-Asberg Depression Rating Scale (MADRS) ergab sich ein schnellerer Wirkungseintritt bei der Gabe von TZA und MAO-Hemmern sowie längeres Verbleiben bei günstigen Werten der MADRS. UAW wurden in 67% der Visiten von MAO-Hemmern, 85% der Visiten von TZA und 71% der Visiten von SSRI festgestellt. Da dies der einzige den Autoren bekannte prospektive Vergleich von SSRI und MAO-Hemmern ist, sei die gefundene Verteilung der häufigsten UAW in Abbildung 5 dargestellt.
Darauf aufbauend und mit den Daten von Serien von Fallberichten [3, 52, 59, 60, 73, 88] wird diskutiert, dass bei Ausschluss von Kontraindikationen, die im Alter häufiger anzutreffen sind (vaskuläre Erkrankungen des Herzens oder des ZNS, gravierende Hypertonie), eine Therapie mit Tranylcypromin gut möglich ist. Tranylcypromin wird als günstig insbesondere für Depression bei Demenz angesehen [3, 59]. Wegen fehlender peripherer und vor allem zentraler anticholinerger Effekte sowie Abwesenheit von EKG-Veränderungen hat Tranylcypromin Vorteile gegenüber beispielsweise TZA [98]. Es wird betont, dass ältere Patienten sehr gut mit der Tyramin-armen Diät umgehen konnten. Zu achten ist aber besonders auf orthostatische Dysregulation und Hypotonie (Sturzrisiko!).
Hypotonie bei Behandlung mit Tranylcypromin
Hypotonie und orthostatische Dysregulation sind ein häufiges Problem in der Behandlung mit Tranylcypromin. In diesen Fällen sollte ein Therapieversuch mit Dihydroergotamin erwogen werden [11]. Wenn Dihydroergotamin nicht anspricht, könnte als weitere Therapieoption Etilefrin zur Disposition stehen. Eventuell liegt eine andere Ausprägung der Hypotonie vor (asympathikotone Hypotonie), mit besserer Eignung dieses direkten Alpha/Beta-Sympathomimetikums. Etilefrin ist zwar bei gleichzeitiger Gabe von Tranylcypromin nicht kontraindiziert, es liegen aber nur wenige Erfahrungen vor, weshalb besondere Vorsicht angezeigt ist (niedrigere Dosis, langsam titrieren, engmaschige Überwachung insbesondere zu Beginn). In schweren Fällen wurde auch erfolgreich Fludrocortison eingesetzt [110], wobei mögliche Risiken zu beachten sind [25].
Hypertonie bei Behandlung mit Tranylcypromin
Eine vorübergehende Blutdruckerhöhung ohne Diätfehler wird typischerweise etwa 30 Minuten nach Einnahme gefunden und kann sich als UAW bei einem Teil der Patienten bemerkbar machen. Ganz aktuell wurde über gute Erfahrungen mit 5 bis 10 mg Amlodipin täglich bei derartigen Unverträglichkeiten berichtet [121]. Davon abzugrenzen sind die seltenen hypertensiven Krisen (dann zumeist wegen Diätfehler), die akut mit Nifedipin, aber oft besser mit anderen Antihypertensiva, beispielsweise Phentolamin, behandelt werden. Eine überschießende Blutdrucksenkung ist zu vermeiden, da erst diese in vielen Fällen zu Schädigungen geführt hat [5].
Komedikation von Tranylcypromin mit anderen Psychopharmaka
Es sei vorausgeschickt, dass eine Kombination mit anderen Psychopharmaka, insbesondere mit Antidepressiva, unter dem Aspekt der Nutzen-Risiko-Bewertung nur bei entsprechender Indikation (in der Regel schwere Fälle, „Therapieresistenz“) angezeigt ist.
Antidepressiva-Kombinationen
Schmauß et al. (1988) berichten retrospektiv über 94 Patienten, die nacheinander vergeblich mit zwei verschiedenen Antidepressiva und anschließend mit einer Kombination von TZA – Amitriptylin (n=37), Imipramin (n=20), Clomipramin (n=2), Mianserin (n=8), Maprotilin (n=1), Dibenzepin (n=14), Lofepramin (n=2), Nomifensin (n=6) oder Doxepin (n=4) – und Tranylcypromin behandelt wurden [107]. Als effektivste Kombination erwies sich Amitriptylin und Tranylcypromin mit einer Erfolgsrate von 78%. Interessanterweise zeigte sich in dieser Studie keine erhöhte Rate an UAW bei der Kombinationstherapie im Vergleich zur Monotherapie. Lediglich die Kombination von Tranylcypromin mit Clomipramin und Nomifensin führte zu einer Zunahme von orthostatischer Hypotension und Kopfschmerzen oder zu hypertensiven Krisen. Ähnliche Ergebnisse für die Kombination Tranylcypromin/Amitriptylin werden von anderen Autoren auch in kontrollierten Studien mitgeteilt [87, 98, 139]. Für eine Kombination von TZA mit Tranylcypromin empfehlen Wager und Klein (1988) Amitriptylin, Doxepin und Trimipramin [136].
In einem Bericht wurden 39 depressive Patienten zusammengefasst, die ambulant und ohne Verträglichkeitsprobleme mit einer Kombination von Tranylcypromin (20 mg/d) und Mianserin (60 mg/d) behandelt wurden [45]. Nicht nur in seiner chemischen Struktur, sondern auch als Antagonist von Alpha2-Autorezeptoren und postsynaptischer 5-HT2/3-Antagonist ähnelt Mirtazapin sehr dem Mianserin. Aus der Perspektive des Klinikers wurde die Kombination mit Tranylcypromin als sinnvoll bezeichnet [2], da Mirtazapin einerseits sedierend wirkt und andererseits das Risiko überschießender Serotonin-Reaktionen verringert.
Eine aktuelle Mitteilung berichtet über zehn SSRI-therapieresistente Patienten, die mit Kombinationen von Tranylcypromin und Reboxetin behandelt wurden [2].
Niedrig dosiertes Trazodon (50–75 mg/d) wurde 21 Patienten gegeben, die zwar gut auf Tranylcypromin (10–60 mg/d) ansprachen, aber über nächtliche Schlafstörungen klagten. Tranylcypromin wurde in dieser Kombination gut vertragen bei günstiger Beeinflussung der Schlafstörungen [58]. Die Kombination mit Trazodon über eine kurze Dauer von sieben Tagen war auch bei höheren Dosen von Trazodon gut verträglich, bei sehr gutem Ansprechen [84]. An anderer Stelle wird über fünf Patienten mit dieser Kombination berichtet [143]. Es scheint typisch, dass Tagesmüdigkeit während der Therapie mit Tranylcypromin bei zusätzlicher Gabe von niedrig dosiertem Trazodon verschwand [58].
Lithiumsalze
Bewährt hat sich offensichtlich eine zusätzliche Gabe von Tranylcypromin zur laufenden Lithiumsalz-Behandlung bei therapieresistenten Patienten. Zehn von zwölf Patienten zeigten eine signifikante Besserung der Symptomatik mit der Kombination von Lithiumsalzen und Tranylcypromin [96]. Vergleichbare Ergebnisse wurden schon früher berichtet [55], wobei 20 auf TZA therapieresistente, depressive Patienten zunächst Lithiumsalze und dann zusätzlich Tranylcypromin erhielten und bei 16 der 20 Patienten eine gute Besserung der Symptomatik dokumentiert werden konnte. Volz et al. (1996) bestätigen den klinischen Wert dieser Vorgehensweise [135].
Carbamazepin, Valproinsäure und Lamotrigin
Auch bei Patienten, die bei Vorliegen einer therapieresistenten Major Depression mit Carbamazepin und Lithiumsalz-Augmentation behandelt worden waren und dann zusätzlich Tranylcypromin (40–100 mg/d) über zwei bis 12 Wochen erhielten, konnte in Einzelfällen eine Besserung der depressiven Symptomatik erzielt werden, ohne dass es zu auffälligen Nebenwirkungen kam. Die Plasmaspiegel von Carbamazepin blieben unverändert [68]. Übereinstimmende Ergebnisse einer guten Verträglichkeit der Komedikation von Tranylcypromin und Carbamazepin wurden in weiteren Fallberichten zu mindestens zehn Patienten mitgeteilt [8, 9, 58, 62, 75]. Aufgrund der insgesamt aber noch geringen Erfahrungen sollte die gemeinsame Gabe von Tranylcypromin und Carbamazepin nur vorsichtig erfolgen. Über Komedikation mit Valproinsäure oder Lamotrigin liegen bisher nur wenige Mitteilungen in der Literatur vor. Bei gutem Therapieansprechen wurden keine Nebenwirkungen verzeichnet [58, 119].
Neuroleptika
In einer therapeutischen Mitteilung wird über fünf Patienten mit unipolarer und bipolarer, therapieresistenter nichtpsychotischer Major Depression berichtet, die auf Tranylcypromin eingestellt wurden und zusätzlich Risperidon erhielten [116]. Vier der fünf Patienten erlebten unter dieser Kombination eine eindrucksvolle und nachhaltige Besserung ihrer depressiven Symptomatik. Bis auf einen Patienten, bei dem sedierende Effekte beobachtet wurden, vertrugen die übrigen die Kombinationsbehandlung gut. Demgegenüber wurden aktuelle Fälle von Serotonin-Syndrom bei Kombinationen von SSRI mit Risperidon berichtet [64]. Tranylcypromin (10 mg) wurde früher in Deutschland in einer festen Kombination mit einem Neuroleptikum (1 mg Trifluoperazin) gegeben und ist so heute noch in anderen Ländern verfügbar. Umfangreiche ältere klinische Studien fanden keinen Unterschied in der Verträglichkeit der Kombination zum Monopräparat. Die gemeinsame Gabe mit niedrigen Dosen klassischer Neuroleptika ist offensichtlich gut möglich.
Benzodiazepine
In der klinischen Praxis werden Benzodiazepine relativ häufig mit Tranylcypromin kombiniert, um vorübergehend Angst, Unruhe und Schlafstörungen zu bessern [101]. Beispielsweise wurde in einer Anwendungsbeobachtung in 10% der Fälle Tranylcypromin mit Benzodiazepinen kombiniert [129]. In einer randomisierten doppelblinden Vergleichsstudie erhielten 15 von 47 mit Tranylcypromin behandelten Patienten Benzodiazepine (32%) [133].
Stimulanzien
Bei 16 sonst über zwei Jahre nicht erfolgreich behandelbaren Patienten mit hohem Leidensdruck, die mit dem MAO-Hemmer allein nicht tolerierbare orthostatische Dysregulation aufwiesen, wurden Tranylcypromin (bis 40 mg/d) oder Phenelzin gemeinsam mit Methylphenidat (bis 10 mg/d) oder Amphetamin (bis 20 mg/d) gegeben [37]. Neun Patienten waren gut bis sehr gut gebessert bei Behandlungsdauern von letztlich sechs Monaten bis vier Jahre. Schwerwiegende UAW traten nicht auf. Die Autoren betonen die Notwendigkeit einer engmaschigen klinischen Kontrolle und niedriger Anfangsdosen der Stimulanzien. Ähnliche Erfahrungen wurden an anderer Stelle mitgeteilt [113]. Weiterhin waren 200 mg/d Modafinil, ein Stimulanz ohne sympathomimetische Eigenschaften, zusammen mit 50 mg/d Tranylcypromin in einem erst kürzlich mitgeteilten Fall von therapieresistenter Depression und Narkolepsie erfolgreich [24].
Fazit
Die der vorliegenden Übersicht zugrundeliegende Literatur ist zu 25% älter (vor 1985), stammt zu 25% aus einer kurzen Periode von 1985 bis 1990, während der viele wichtige Arbeiten über Tranylcypromin erschienen, und ist zu 50% aus neuerer Zeit (nach 1990), also nach Einführung der SSRI. Entsprechend diesem umfangreichen Material, welches die relevanten Daten zusammenfasst, sollte Tranylcypromin einen festen Platz im Behandlungsplan therapieresistenter Depressionen sowie bei so genannten atypischen Depressionen einnehmen. Bei der Anwendung in Klinik und Facharztpraxis sind Vormedikation/Umstellungsintervall, Aufklärung über die Diätrichtlinien sowie gegebenenfalls Arzneimittelinteraktionen zu beachten. Bei objektiver Betrachtung überwiegen Anhaltspunkte dafür, dass die Risiken einer Therapie mit Tranylcypromin nicht selten übertrieben und die klinisch-therapeutischen Potenziale der Substanz nicht ausreichend genutzt werden.
Tranylcypromine: a review
Tranylcypromine is established in clinical practice as a potent antidepressant drug for 40 years, its therapeutic efficacy was confirmed in controlled studies in comparison to placebo and other antidepressants. As the main pharmacological activity, tranylcypromine increases central serotonin, norepinephrine and dopamine by means of irreversible and nonselective inhibition of monoamine oxidase (MAO), which defines a special mechanism of action and an independent class of antidepressant drugs. With a rather short half-life of the active substance of two hours the pharmacological effect decreases one week after the dose to about 50% only. However, the risk of interaction with food due to the inhibition of peripheral MAO explains that tranylcypromine is not used as an antidepressant of 1st choice today. Thus, the domain of tranylcypromine is treatment resistant depression, i.e. after failure of the usual treatment with reuptake inhibitor antidepressants, as well as atypical depression. Daily doses of 20 to 60 mg should be applied. Orthostatic hypotension, agitation and sleep problems are found as frequent adverse effects of tranylcypromine which may be managed with dihydroergotamine and sedative drugs. A special diet is obligatory (no aged cheese and red wine) to avoid the risk of hypertensive crisis because of tyramine (“cheese-effect”). Serotonergic comedication is contraindicated due to the risk of serotonergic overstimulation (SSRI, clomipramine, venlafaxine, serotonin precursors, serotonin agonists). The combination with antidepressant drugs such as amitriptyline, nortriptyline, reboxetin, trazodon, mianserin, mirtazapin is possible as well as comedication with lithium, antipsychotic drugs and benzodiazepines.
Keywords: Tranylcypromine, MAO-inhibitors, antidepressants
Literatur
Das Literaturverzeichnis finden Sie im Internet: www.ppt-online.de > Inhalt > 2006 > Heft 4
Prof. Dr. med. Gerd Laux, Bezirksklinikum Gabersee, Fachkrankenhaus für Psychiatrie, Psychotherapie, Psychosomatische Medizin und Neurologie, 83512 Wasserburg am Inn, E-Mail: g.laux.bzk-gabersee@t-online.de
Priv.-Doz. Dr. Sven Ulrich, Leiter Abt. Arzneimittelsicherheit/Arzneimittelinformation, esparma GmbH, Lange Göhren 3, 39171 Osterweddingen, E-Mail: s.ulrich@esparma.de
Psychopharmakotherapie 2006; 13(04)
