Hans-Jürgen Möller, München, Wolfgang Gaebel, Düsseldorf, Dieter Naber, Hamburg, und Eckart Rüther, Göttingen
Zur Behandlung der Schizophrenie und verwandter psychotischer Erkrankungen steht seit einigen Jahren neben den typischen Neuroleptika mit der Leitsubstanz Haloperidol (z.B. Haldol) auch eine wachsende Zahl so genannter atypischer Neuroleptika/Antipsychotika (Atypika) zur Verfügung. Die Definition der Atypika basiert im Wesentlichen auf ihrem günstigeren extrapyramidal-motorischen Nebenwirkungsprofil (fehlende/geringere extrapyramidal-motorische Symptome, EPMS) [7]. Zurzeit werden neben Clozapin (z.B. Leponex®) und Sertindol (Serdolcet®), die nur als Medikamente der 2. Wahl zugelassen sind, die Substanzen Amisulprid (Solian®), Aripiprazol (Abilify®), Olanzapin (Zyprexa®), Quetiapin (Seroquel®), Risperidon (Risperdal®), Ziprasidon (Zeldox®) und Zotepin (Nipolept®) zu den Atypika gezählt. Olanzapin und Ziprasidon sind auch als intramuskuläre, Risperidon und Olanzapin als schnell lösliche orale Darreichungsform für die Akuttherapie verfügbar. Eine weitere Therapieoption für die Schizophreniebehandlung steht mit der lang wirksamen Darreichungsform von Risperidon zur Verfügung.
Im internationalen Vergleich werden die Atypika am häufigsten in den USA (79% aller Schizophrenieverordnungen) und in Skandinavien eingesetzt, in Deutschland nur bei 45% der Verordnungen [20, 25]. Diese deutliche Diskrepanz spiegelt sich auch in den Therapieempfehlungen der entsprechenden Länder wider: Während in den USA, England und Australien Atypika als Mittel der ersten Wahl bei neu diagnostizierter Schizophrenie und akuter Exazerbation empfohlen werden [2, 36, 45] und auch die neue DGPPN-Leitlinie zur Schizophreniebehandlung dem folgt [57], heißt es im deutschen Therapiehinweis nach Nr. 14 AMR: „Eine generelle Bevorzugung der atypischen Neuroleptika ist derzeit nicht begründet“ [5]. Auch bei der Beurteilung der Behandlungskosten steht die Aussage des deutschen Therapiehinweises „Der generelle Einsatz der mit sehr viel höheren Kosten verbundenen atypischen Neuroleptika bei Akutbehandlung schizophrener Patienten [ist] medizinisch nicht gerechtfertigt“ im Gegensatz zu den Erkenntnissen in anderen Ländern (z.B. NICE in Großbritannien: „Die höheren Arzneimittelkosten werden durch Einsparungen im stationären Bereich mehr als kompensiert“, [30]). In der vorliegenden Arbeit sollen anhand der Datenlage zu Wirksamkeit, Verträglichkeit, Lebensqualität und Wirtschaftlichkeit die Argumente aufgezeigt werden, die eine Bevorzugung der Atypika begründen. Eine solche Bevorzugung wird in wichtigen internationalen Leitlinien zur Schizophreniebehandlung zum Ausdruck gebracht (WFSBP-Guidelines, CINP-Treatment).
Wirksamkeit atypischer Antipsychotika
Die postulierte bessere Gesamtwirksamkeit der einzelnen Atypika, bedingt durch das breitere, neben Positivsymptomatik auf Negativsymptomatik, depressive Symptomatik und kognitive Störung ausgedehnte Wirkungsprofil, wurde in der Vergangenheit mit Blick auf die vergleichsweise hohe Dosierung der Komparatorsubstanz (Haloperidol) hinterfragt [22]. In einer neuen Metaanalyse zur Wirksamkeit atypischer Antipsychotika zeigte sich jedoch, dass Atypika mindestens gleich wirksam wie Haloperidol sind. Für Clozapin, Risperidon, Olanzapin und Amisulprid konnte sogar eine überlegene Wirksamkeit gegenüber den Typika gezeigt werden [15]. Dieses Ergebnis war unabhängig von der Dosierung der Vergleichssubstanz Haloperidol (Abb. 1).
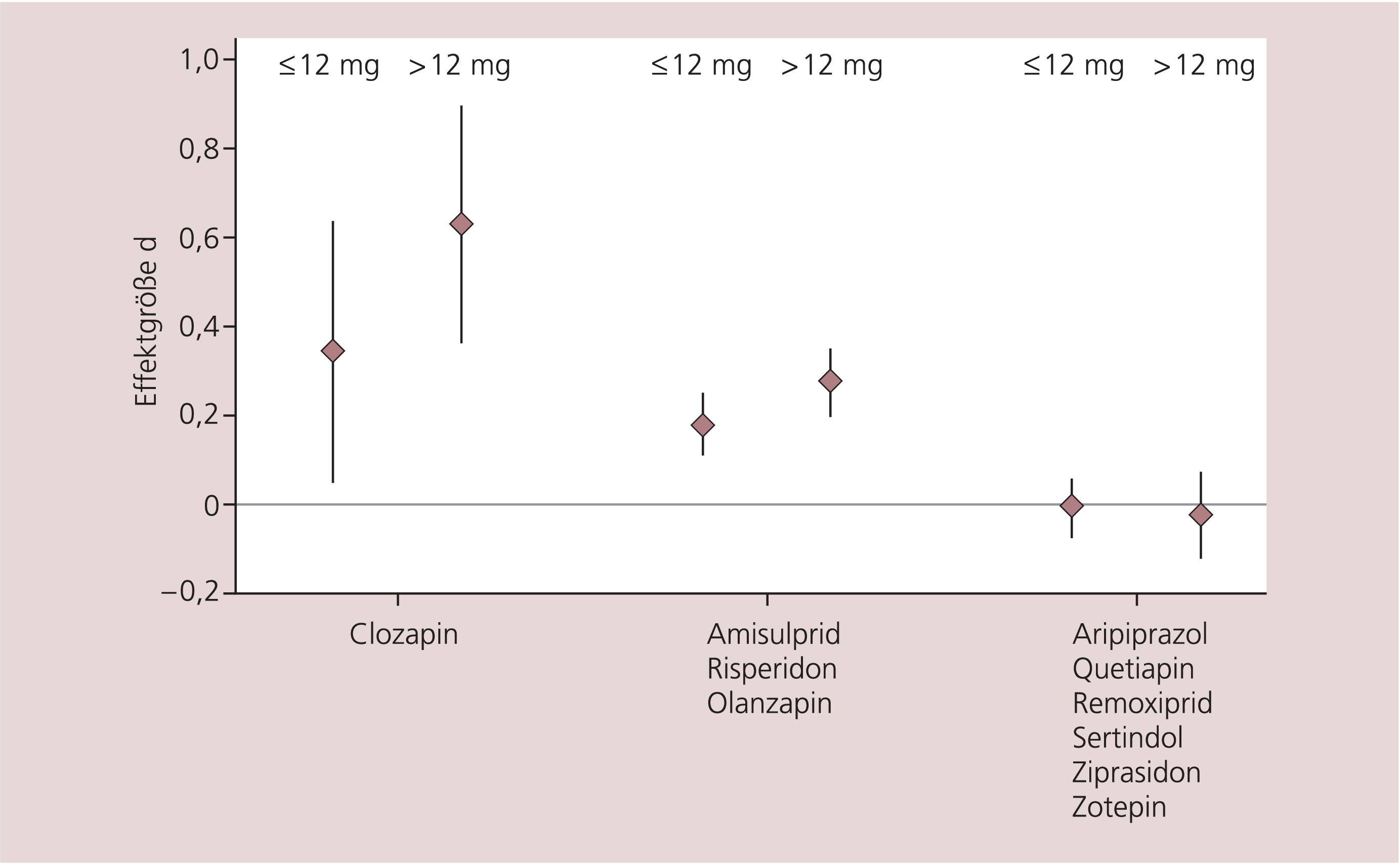
Abb. 1. Ergebnisse der Metaanalyse von Davis et al. [15]. Globale Wirksamkeit der Atypika im Vergleich zu Typika (basierend auf PANSS, BPRS, und CGI). Einige Atypika (Clozapin, Amisulprid, Risperidon und Olanzapin) sind signifikant besser wirksam als Typika. Alle anderen untersuchten Atypika (Aripiprazol, Quetiapin, Remoxiprid, Sertindol, Ziprasidon, Zotepin) haben eine mit den Typika vergleichbare Wirksamkeit. Die Wirksamkeit der Atypika wurde nicht durch unterschiedlich hohe Vergleichsdosen (Haloperidol-Äquivalente ≤ oder >12 mg/Tag) beeinflusst.
Insbesondere für negative, zum Teil auch für kognitive und depressive Symptome der Schizophrenie, zeigt sich im direkten Vergleich zu Haloperidol eine überlegene Wirksamkeit der Atypika [12, 29, 40–42, 53). Signifikante Verbesserungen kognitiver Funktionen durch Atypika im Vergleich zu Typika – unter anderem für Aufmerksamkeit, Reaktionszeit, Wortflüssigkeit, Lernen, Gedächtnis und Handlungsplanung – wurden teilweise gefunden [30, 38].
Inzwischen liegen auch zur Langzeittherapie mit Atypika Untersuchungen vor, die ihre Wirksamkeit im Vergleich zu den Typika bestätigen. Eine Metaanalyse zur Rezidivprophylaxe zeigte im Vergleich zu den Typika Vorteile für die Atypika, insbesondere eine niedrigere Rezidivrate sowie ein geringeres Risiko von Therapieversagen [31]. Damit in Einklang steht eine geringere Rehospitalisierungsrate (Abb. 2). Auch kürzlich publizierte Daten einer großen amerikanischen Vergleichsstudie (CATIE) zeigen eine geringere Rehospitalisierungsrate bei Atypika-Patienten im Vergleich zu Typika-Patienten [34]. Gemessen an der als Hauptzielvariable definierten Therapieabbruchrate schnitt allerdings das klassische Neuroleptikum Perphenazin günstiger als erwartet ab, was durch einen schwerwiegenden Mangel im Design der Studie zu erklären ist [41].
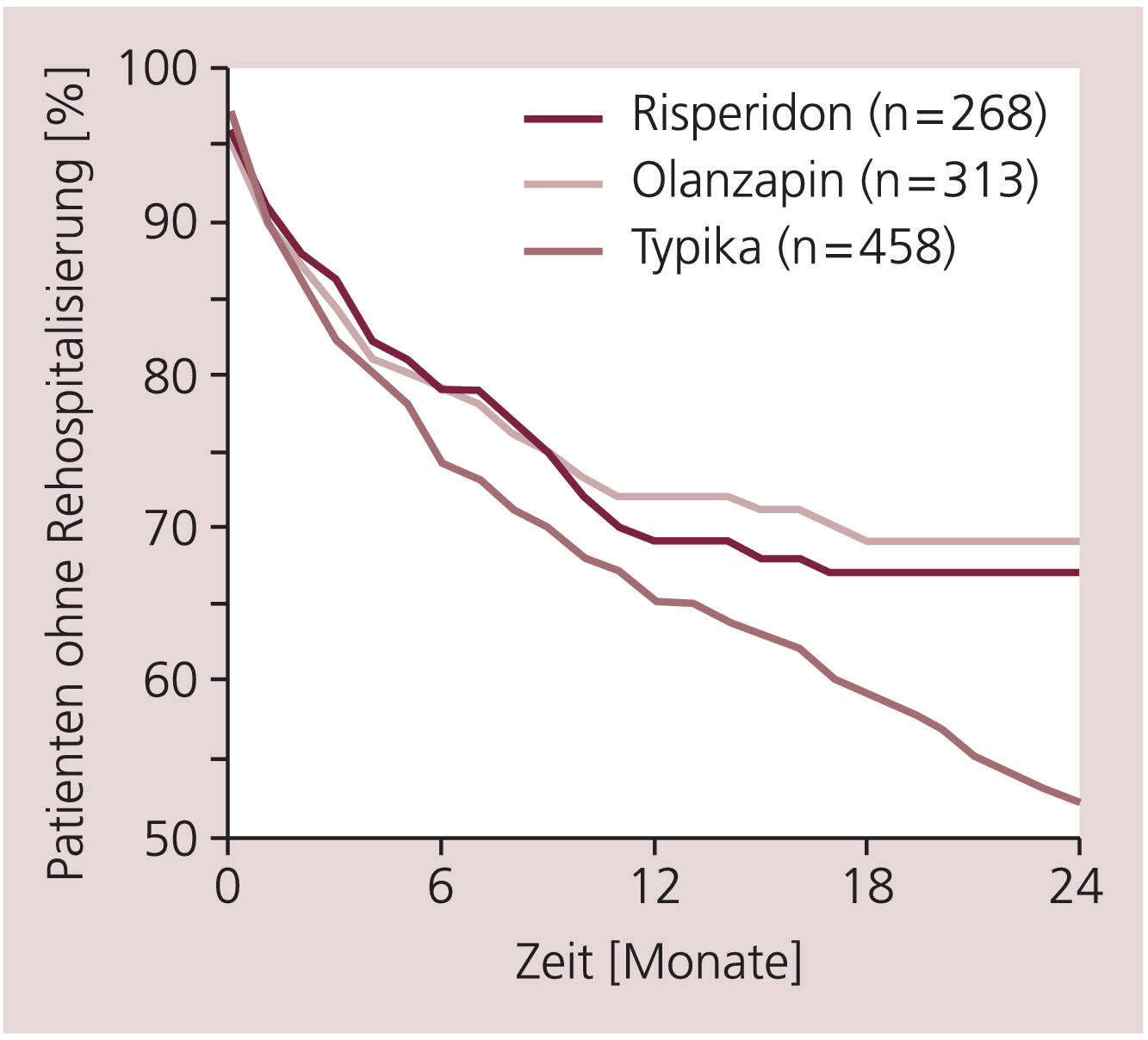
Abb. 2. Zeit bis zur Rehospitalisierung von Patienten mit Schizophrenie, die unter der Behandlung der Atypika Risperidon beziehungsweise Olanzapin oder unter Typika aus dem Krankenhaus entlassen wurden [aus 47]
Verträglichkeit der Atypika
Die deutlich seltener auftretenden extrapyramidal-motorischen Symptome (EPMS) sind das Hauptmerkmal der Atypika und grenzen diese von den Typika ab. EPMS werden von den Patienten als besonders störend und diskriminierend angesehen, führen zu einer zusätzlichen Therapie mit Anticholinergika [7], zu sozialer Ausgrenzung (Stigmatisierung) [21] und zur Reduktion der Lebensqualität [27]. Neben der geringeren Wahrscheinlichkeit für EPMS besteht bei mit atypischen Antipsychotika behandelten Patienten auch ein geringeres Risiko für die Entwicklung von tardiven Dyskinesien als Spätfolge [7, 17, 25]. Bei der Therapie mit Typika sind diese innerhalb von fünf Jahren bei etwa einem Viertel der Patienten zu gewärtigen (Abb. 3). Generell führen EPMS zu einem erhöhten Risiko des Therapieabbruchs und damit zu Problemen bei der Arzt-Patienten-Beziehung [42, 51].
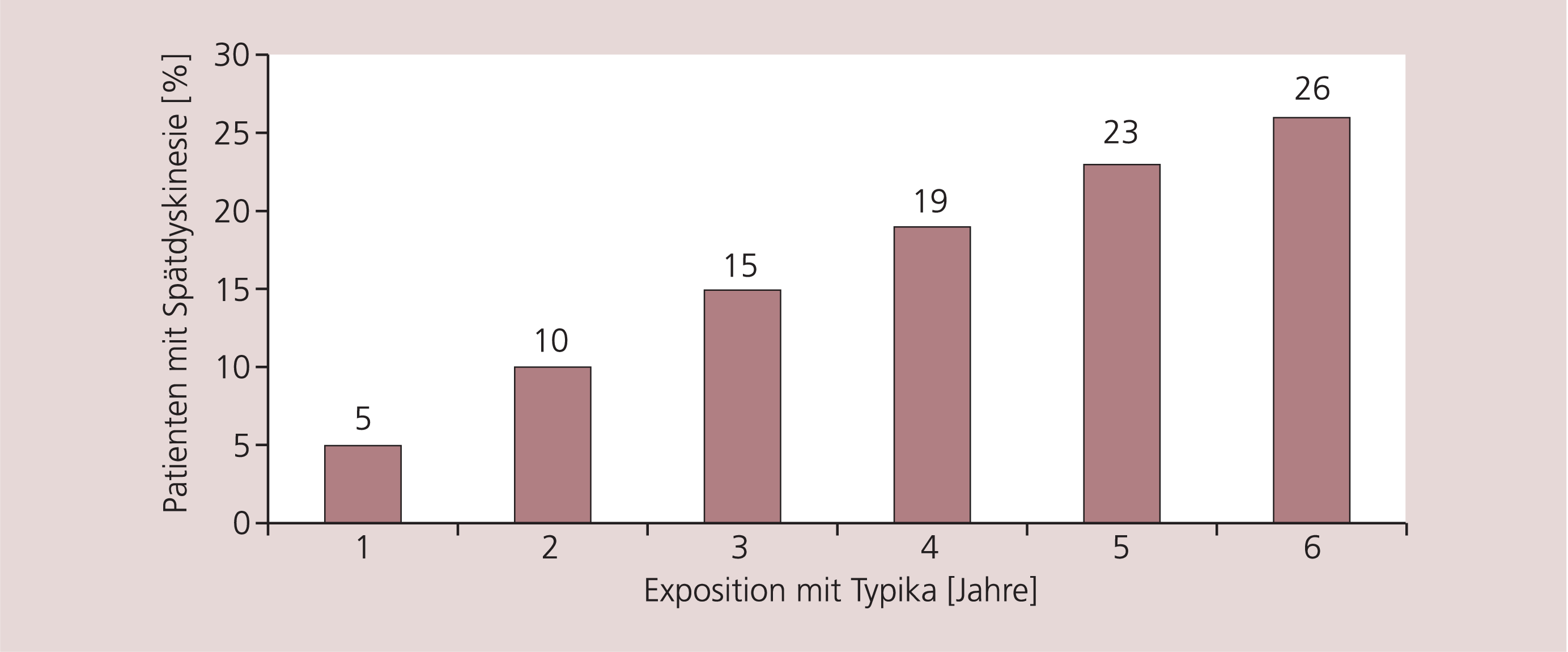
Abb. 3. Anstieg des Spätdyskinesierisikos mit der Dauer der Neuroleptika-Exposition [nach 26]
Während der Vorteil der Atypika in Bezug auf EPMS im Vergleich zu den hochpotenten Typika eindeutig belegt ist [32], entwickelte sich kürzlich eine Diskussion über EPMS im Vergleich mit niedrigpotenten Typika (z.B. Chlorpromazin). Auslöser dieser Diskussion war eine Metaanalyse von Leucht und Kollegen [33], die einen eindeutigen Vorteil im EPMS-Risiko für Atypika zeigte, der nicht mehr auftrat, wenn die niedrigpotenten Typika niedrig (<600 mg/Tag Chlorpromazin-Äquivalent) dosiert wurden. Anzumerken ist, dass die niederpotenten Typika in niedriger Dosierung signifikant geringer wirksam sind als die Atypika [33]. Darüber hinaus führten die Nebenwirkungen der niederpotenten Typika, wie unter anderem ausgeprägte Sedierung und Orthostase, dazu, dass diese Substanzen im klinischen Alltag wenig verschrieben werden, zumeist nur in Kombination mit hochpotenten Typika.
Im Zusammenhang mit den Atypika wird oft auf andere Nebenwirkungen dieser Substanzen hingewiesen, die den Vorteil der fehlenden EPMS relativieren. Dazu gehört die Gewichtszunahme, die unter Atypika häufiger als unter Typika auftritt. Diese Nebenwirkung ist innerhalb der Atypika unterschiedlich ausgeprägt [49, 56], so dass diesbezüglich Wahlmöglichkeiten innerhalb der Gruppe der Atypika bestehen. Obendrein sind dietätische Maßnahmen und allgemeine Maßnahmen zur Gewichtsreduktion erfolgversprechend [4, 18].
Die Relevanz der unter Atypika auftretenden Gewichtszunahme für die Entwicklung von Diabetes mellitus Typ 2 wird kontrovers beurteilt [10]. In diesem Zusammenhang ist daran zu erinnern, dass Patienten mit Depressionen, Schizophrenie und bipolaren Erkrankungen zwei- bis viermal häufiger als die Allgemeinbevölkerung an Diabetes mellitus Typ 2 leiden [8, 43] und dass bereits in den 1950er Jahren ein Zusammenhang zwischen Typika und Hyperglykämien berichtet wurde [10]. Ein erhöhtes Diabetesrisiko ist gegenwärtig sowohl für die Behandlung mit Typika als auch für Atypika belegt, wobei epidemiologische Studien zu den relativen Risiken zwischen einzelnen Antipsychotika widersprüchliche Ergebnisse zeigen [6, 55], wenn auch einzelne Substanzen aus der Gruppe der Atypika stärker belastet scheinen. Regelmäßige Kontrollen des Blutzuckerspiegels und der Blutfette, gegebenenfalls der Glucosetoleranz und des HbA1c sind daher bei (ggf. auch vor) Behandlung vor allem mit Atypika empfehlenswert [1].
Des Weiteren gilt es auch andere Nebenwirkungen einzelner Atypika (z.B. Prolactinerhöhung, Erhöhung der Lipidwerte, kardiale Nebenwirkungen, vorübergehende Erhöhung der Leberwerte) bei der Auswahl der Medikation in Betracht zu ziehen [13, 23, 52]. Die Heterogenität der Atypika ermöglicht es für die Mehrzahl der Patienten, ein Medikament mit einem auf den einzelnen Patienten zugeschnittenen günstigen Nebenwirkungsprofil auszuwählen.
Patientenbefindlichkeit, Lebensqualität und Krankheitskosten der Atypika
Aus der Sicht der Patienten ist eine Behandlung mit Atypika offensichtlich zu bevorzugen. Die subjektive Befindlichkeit von Schizophreniepatienten verbessert sich unter Atypika-Behandlung deutlich stärker als unter Typika [27]. 90% aller Patienten, die bereits beide Medikationsarten erhalten hatten, bevorzugen Atypika gegenüber den Typika. Es konnte gezeigt werden, dass eine verbesserte Lebensqualität der Schizophreniepatienten mit einer signifikant besseren Compliance im Vergleich zu Typika assoziiert ist [28, 54]. Erst durch die positive Beeinflussung der Patientenbefindlichkeit und Lebensqualität durch die Atypika konnte die subjektive Dimension der antipsychotischen Therapie zu einem wichtigen Forschungsgebiet werden.
In der laufenden Diskussion in Deutschland werden oft die höheren Medikationskosten als Argument gegen die Atypika angeführt: „Der generelle Einsatz der mit sehr viel höheren Kosten verbundenen atypischen Neuroleptika bei Akutbehandlung schizophrener Patienten ist medizinisch nicht gerechtfertigt“ [5]. Die Aussagekraft dieser direkten Therapiekosten für die Gesamtkosten einer Schizophreniebehandlung ist jedoch kritisch zu hinterfragen. Beispielsweise wurde für das Gesundheitssystem in Großbritannien von einer unabhängigen Kommission (NICE) ein jährliches Einsparpotenzial durch die Verwendung von Atypika im Vergleich zu Typika von 1000 Pfund (etwa 1500 Euro) pro Patient und Jahr errechnet [45]. Für Deutschland liegen gesundheitsökonomische Analysen vor, die vergleichbar hohe Gesamtkosten für mit Atypika und Typika behandelte Patienten ermitteln, wobei Kosteneffektivität auch für eine Depotformulierung der Atypika gezeigt werden konnte [16, 24, 29, 50]. Diese Modellrechnungen geben dabei Hinweise darauf, dass die höheren Medikationskosten vermutlich durch Einsparungen im Krankenhaus- und Reha-Bereich, durch eine schnellere Reintegration der Patienten und durch geringere Folgekosten fehlender Langzeitnebenwirkungen (vor allem tardiver Dyskinesien) mindestens ausgeglichen werden.
Fazit
Im Vergleich zu den USA, Großbritannien und Skandinavien werden in Deutschland atypische Antipsychotika weniger häufig eingesetzt. Obwohl die Atypika keine einheitliche Medikamentenklasse bilden, sind seltenes Auftreten von EPMS, breitere Wirksamkeit sowie eine höhere Akzeptanz bei Patienten gemeinsame Charakteristika. Ihre klinische Wirksamkeit bei der Positivsymptomatik ist mindestens vergleichbar zu Typika, für einige Atypika und generell bei der Negativsymptomatik sogar besser als für Haloperidol. Dank der Vorteile bei EPMS besitzen die Atypika im Vergleich zu Typika eine günstige Verträglichkeit, wobei die Unterschiede im Nebenwirkungsprofil zwischen einzelnen Substanzen (z.B. bei Gewichtszunahme, Prolactinerhöhung, kardialen Nebenwirkungen) individuelle Auswahlmöglichkeiten für die Patienten erlauben. Bezieht man Krankenhauskosten in eine Kosten-Nutzen Rechnung mit ein, ist eine Behandlung mit Atypika auf mittlere Sicht vermutlich kostengünstiger als mit Typika. Zusätzlich werden Atypika von den betroffenen Patienten ganz überwiegend als die von ihnen bevorzugten Medikamente angesehen und können so zu einer höheren Therapietreue führen. Aufgrund dieser Abschätzung der überwiegenden Vorteile der Atypika im Vergleich zu den Typika werden in der überwiegenden Zahl der internationalen Guidelines Atypika als Mittel der ersten Wahl bei der Behandlung der Schizophrenie empfohlen.
Literatur
1. American Diabetes Association (ADA). Consensus development conference on antipsychotic drugs and obesity and diabetes. Diabetes Care 2004;27:596–601.
2. American Psychiatric Association (APA). Treating Schizophrenia – A Quick Reference Guide. Eingesehen am 15. Mai 2006 unter www.psych.org/psych_pract/treatg/http://www.psych.org/psych_pract/treatg/ quick_ref_guide/ SchizophreniaQRG_04-15-05.pdf
3. Benkert O, Hippius H. Kompendium der Psychiatrischen Pharmakotherapie. 5. Aufl. Heidelberg: Springer, 2005:196–7.
4. Brar JS, Ganguli R, Pandina G, et al. Effects of behavioral therapy on weight loss in overweight and obese patients with schizophrenia or schizoaffective disorder. J Clin Psychiatry 2005;66:205–12.
5. Bundesausschuss der Ärzte und Krankenkassen. Therapiehinweis nach Nr. 14 Arzneimittel-Richtlinien: Atypische Neuroleptika. Dtsch Ärztebl PP 2002;12:569–71.
6. Buse JB, Cavazzoni P, Hornbuckle K, et al. A retrospective cohort study of diabetes mellitus and antipsychotic treatment in the United States. J Clin Epidemiol 2003;56:164–70.
7. Casey DE. Neuroleptic drug-induced extrapyramidal syndromes and tardive dyskinesia. Schizophr Res 1991;4:109–20.
8. Cassidy F, Ahearn E, Carroll BJ. Elevated frequency of diabetes mellitus in hospitalized manic-depressive patients. Am J Psychiatry 1999;156:1417–20.
9. Charatan FB, Bartlett NG. The effect of chlorpromazine (largactil) on glucose tolerance. J Ment Sci 1955;101:351–3.
10. Citrome LL, Jaffe AB. Relationship of atypical antipsychotics with development of diabetes mellitus. Ann Pharmacother 2003;37:1849–57.
11. Correll CU, Leucht S, Kane JM. Lower risk for tardive dyskinesia associated with second-generation antipsychotics: a systematic review of 1-year studies. Am J Psychiatry 2004;161:414–25.
12. Csernansky JG, Ramy M, Brenner R. A comparison of risperidone and haloperidol for the prevention of relapse in patients with schizophrenia. N Engl J Med 2002;346:16–22.
13. Czekalla J, Beasley CM, Dittmann RW, Helsberg K, et al. Cardiac safety during treatment with atypical neuroleptics: Comparative overview of QTc parameters and associated effects with olanzapine and other atypical and typical antipsychotics. Nervenheilkunde 2001;20:194–201.
14. David SR, Taylor CC, Kinon BJ, Brier A. The effects of olanzapine, risperidone, and haloperidol on plasma prolactin levels in patients with schizophrenia. Clin Therapeutics 2000;22:1085–96.
15. Davis JM, Chen N, Glick ID. A meta-analysis of the efficacy of second-generation antipsychotics. Arch Gen Psychiatry 2003;60:553–64.
16. Deckert C, Höffler J, Kortmann J, et al. Kostenanalyse der Schizophrenie-Behandlung in Deutschland. Gesundh ökon Qual manag 2001;6:161–6.
17. Dolder CR, Jeste DV. Incidence of tardive dyskinesia with typical versus atypical antipsychotics in very high risk patients. Biol Psychiatry 2003;53:1142–5.
18. Faulkner G, Saundy AA, Lloyd K. Schizophrenia and weight management: a systematic review of interventions to control weight. Acta Psychiatr Scand 2003;108:324–32.
19. Emsley R, Turner HJ, Schronen J, Botha K, et al. A single-blind, randomized trial comparing quetiapine and haloperidol in the treatment of tardive dyskinesia. J Clin Psychiatry 2004;65:696–701.
20. Gaebel W, Riesbeck M, Janssen B, et al. Atypical and typical neuroleptics in acute schizophrenia and related delusional disorders. Drug choice, switching and outcome under naturalistic treatment conditions. Eur Arch Psychiatry Clin Neurosci 2003;253:175–84.
21. Gaebel W, Zäske H, Baumann A. Psychisch Kranke. Stigma erschwert Behandlung und Integration. Dtsch Ärztebl 2004;101:A3253–5.
22. Geddes J, Freemantle N, Harrison P, et al. Atypical antipsychotics in the treatment of schizophrenia: systematic overview and meta-regression analysis. BJM 2000;321:1371–6.
23. Gordon M. Memorandum from the Division of CardioRenal Drug Products Consultation regarding Ziprasidone, NDA #20825, study report of Clinical Pharmacology Protocol #128-054. June 14. 2000. Verfügbar unter: www.fda.gov/ohrms/dockets/ac/00/backgrd/ 3619b.pdf. Eingesehen am 15. Mai 2006.
24. Hamann J, Leucht S, Kissling W. Are the second generation antipsychotics cost-effective? A critical review on the background on different health systems. Pharmacopsychiatry 2003;36:18–26.
25. IMS Health, Frankfurt, 2003.
26. Kane JM, Woerner M, Lieberman J. Tardive dyskinesia: prevalence, incidence, and risk factors. J Clin Psychopharmacol 1988;8(Suppl 4):52S–6S.
27. Karow A, Naber D. Subjective well-being and quality of life under atypical antipsychotic treatment. Psychopharmacology 2002;162:3–10.
28. Karow A, Czekalla J, Siemer A, Naber D. Correlations fo subjective well-being with compliance [Poster]. World Congress on Biological Psychiatry, Vienna, Austria, 2005.
29. Keefe RS, Silva SG, Perkins DO, Lieberman JA. The effects of atypical antipsychotic drugs on neurocognitive impairment in schizophrenia: a review and meta-analysis. Schizophr Bull 1999;25:201–22.
30. Laux G, Heeg B, van Hout BA, Mehnert A. Costs and effects of long-acting risperidone compared with oral atypical and conventional depot formulations in Germany. Pharmacoeconomics 2005;23(Suppl 1):49–61.
31. Leucht S, Barnes TRE, Kissling W, Engel RR, et al. Relapse prevention in schizophrenia with new-generation antipsychotics: a systematic review and exploratory meta-analysis of randomized, controlled trials. Am J Psychiatry 2003;160:1209–22.
32. Leucht S, Pitschel-Walz G, Abraham D, Kissling W. Efficacy and extrapyramidal side-effects of the new antipsychotics olanzapine, quetiapine, risperidone, and sertindole compared to conventional antipsychotics and placebo. A meta-analysis of randomized controlled trials. Schizophr Res 1999;35:51–68.
33. Leucht S, Wahlbeck K, Hamann J, Kissling W. New generation antipsychotics versus low-potency conventional antipsychotics: a systematic review and meta-analysis. Lancet 2003;361:1581–9.
34. Lieberman JA, Stroup TS, McEvoy JP, Swartz MS, et al. for the Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE) investigators. Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. N Engl J Med 2005;353:1209–23.
35. Markowitz JS, Brown CS, Moore TR. Atypical antipsychotics. Part I: Pharmacology, pharmacokinetics, and efficacy. Ann Pharmacother 1999;33:73–85.
36. McGorry P, Killackey E, Elkins K, Lambert M, et al. for the RANZCP Clinical Practice Guideline Team for the Treatment of Schizophrenia. Summary Australian and New Zealand clinical practice guideline for the treatment of schizophrenia. Australas Psychiatry 2003;11:136–47.
37. Meaney AM, O’Keane V. Prolactin and schizophrenia: clinical consequences of hyperprolactinaemia. Life Sciences 2002;71:979–92.
38. Meltzer HY, McGurk SR. The effects of clozapine, risperidone, and olanzapine on cognitive function in schizophrenia. Schizophr Bull 1999;25:233–55.
39. Möller HJ. Definition, psychopharmacological basis and clinical evaluation of novel/atypical neuroleptics: methodological issues and clinical consequences. World J Biol Psychiatry 2000;1:75–91.
40. Möller HJ. Management of the negative symptoms of schizophrenia: new treatment options. CNS Drugs 2003;17:793–823.
41. Möller HJ. Are the new antipsychotics no better than the classical neuroleptics? The problematic answer from the CATIE study. Eur Arch Psychiatry Clin Neurosci 2005;255: 371–2.
42. Mota NE, Lima MS, Soares BG. Amisulpride for schizophrenia. Cochrane Database Syst Rev 2002;2:CD001357.
43. Mukherjee S, Decina P, Bocola V, Saraceni F, et al. Diabetes mellitus in schizophrenic patients. Compr Psychiatry 1996;37:68–73.
44. Naber D. Long-term phase of schizophrenia: impact of atypical agents. Int Clin Psychopharmacol 2000;15(Suppl 4):S11–4.
45. National Institute for Clinical Excellence (NICE). Guidance on the use of newer (atypical) antipsychotic drugs for the treatment of schizophrenia, N0106, June 2002.
46. Nightengale B, Garrett L, Waugh S, et al. Economic outcomes associated with the use of risperidone in a naturalistic group practice setting. Am J Man Care 1998;4:360–6.
47. Rabinowitz J, Lichtenberg P, Kaplan Z, Mark M, et al. Rehospitalization rates of chronically ill schizophrenic patients discharged on a regimen of risperidone, olanzapine, or conventional antipsychotics. Am J Psychiatry 2001;158:266–9.
48. Santarlasci B, Messori A. Clinical trial response and dropout rates with olanzapine versus risperidone. Ann Pharmacother 2003;37:556–63.
49. Simpson MM, Goetz RR, Devlin MJ, Goetz SA, et al. Weight gain and antipsychotic medication: differences between antipsychotic-free and treatment periods. J Clin Psychiatry 2001;62:694–700.
50. Spannheimer A, Reitberger U, Clouth J, Lothgren M. Length of hospital stay and associated costs for olanzapine vs. haloperidol in the treatment of schizophrenia relapse in Germany. Eur J Health Econom 2003;4:85–9.
51. Tandon R, DeQuardo JR, Taylor SF, et al. Phasic and enduring negative symptoms in schizophrenia: biological markers and relationship to outcome. Schizophrenia Res 2000;45:191–201.
52. Tollefson GD, Beasley CM, Tamura RN, Tran PV, et al. Blind, controlled, long-term study of the comparative incidence of treatment emergent tardive dyskinesia with olanzapine or haloperidol. Am J Psychiatry 1997;154:1248–54.
53. Tran PV, Dellva MA, Tollefson GD, Wentley AL, et al. Oral olanzapine versus oral haloperidol in the maintenance treatment of schizophrenia and related psychoses. Br J Psychiatry 1998;172:499–505.
54. Voruganti L, Cortese L, Oyewumi L, Cernovsky Z, et al. Comparative evaluation of conventional and novel antipsychotic drugs with reference to their subjective tolerability, side-effect profile and impact on quality of life. Schizophrenia Res 2000;43:135–45.
55. Wirshing DA, Boyd JA, Meng LR, Ballon JS, et al. The effects of novel antipsychotics on glucose and lipid levels. J Clin Psychiatry 2002;63:856–65.
56. Wirshing DA, Wirshing WC, Kysar L, et al. Novel antipsychotics: comparison of weight gain liabilities. J Clin Psychiatry 1999;60:358–63.
56. Deutsche Gesellschaft für Psychiatrie, Psychotherapie und Nervenheilkunde (DGPPN) (Hrsg.). S3 Praxisleitlinien in Psychiatrie und Psychotherapie. Band 1: Behandlungsleitlinie Schizophrenie. Darmstadt: Steinkopff Verlag, 2006.
Prof. Dr. Hans-Jürgen Möller, Psychiatrische Klinik der Ludwig-Maximilians Universität, Nussbaumstraße 7, 80336 München, E-Mail: hans-juergen.moeller@med.uni-muenchen.de Prof. Dr. med. Wolfgang Gaebel, Klinik und Poliklinik für Psychiatrie und Psychotherapie, Rheinische Kliniken Düsseldorf, Kliniken der Heinrich-Heine-Universität Düsseldorf, Bergische Landstraße 2, 40605 Düsseldorf, E-Mail: wolfgang.gaebel@uni-duesseldorf.de Prof. Dr. Dieter Naber, Psychiatrische Klinik, Universitätsklinikum Eppendorf, Martinistraße 52, 20246 Hamburg, E-Mail: naber@uke. uni-hamburg.de Prof. Dr. Eckart Rüther, Klinik und Poliklinik für Psychiatrie und Psychotherapie der Universität Göttingen, Von-Siebold-Straße 5, 37075 Göttingen
Atypical antipsychotics in Germany – an inventory
The use of atypical antipsychotics/neuroleptics for the treatment of schizophrenia is steadily increasing since their introduction in the 1990’s. Currently, in the US, 79% of all prescriptions of antipsychotics in this indication are issued for atypicals. In contrast, atypicals are issued in only 45% of these prescriptions in Germany, a lower rate compared to all other North-American and European countries assessed, with the exception of France. The therapeutic notice of the German “Bundesausschuss der Ärzte und Krankenkassen” according to Nr. 14 AMR (Drug Guidelines) issued in 2002 states that a general preference for atypicals is currently not justified and that their use would be linked to higher costs in comparison to typical neuroleptics. This contradicts recommendations in important international and national guidelines. In contrast, in the present article we would like to demonstrate that recent data regarding efficacy, tolerability, quality of life and cost effectiveness indeed build a solid foundation in favor of a general recommendation of atypicals.
Keywords: Schizophrenia, atypicals, neuroleptics, efficacy, safety
Psychopharmakotherapie 2006; 13(04)
