Per Odin, Anne Rüssmann, Bremerhaven, und Sten-Magnus Aquilonius, Uppsala (Schweden)
Morbus Parkinson ist eine schwere, fortschreitende, neurodegenerative Erkrankung, die etwa 200000 bis 300000 Personen in Deutschland betrifft und zu motorischen Symptomen wie Hypokinesie, Rigidität, Tremor und Gleichgewichtsstörungen sowie verschiedenen nicht-motorischen Symptomen führt. Seit der Erstbeschreibung von Dopamin als selbstständige Signalsubstanz 1957 von Arvid Carlsson hat die Parkinson-Therapie sich stark entwickelt. Es gibt heutzutage eine Vielzahl, sowohl medizinischer als auch chirurgischer Therapiemöglichkeiten. Insgesamt haben diese Therapien es möglich gemacht, dass die Parkinson-Patienten jetzt eine beinahe normale Lebenserwartung mit oft guter Lebensqualität haben. Noch gibt es aber Probleme. Vor allem entwickeln viele Patienten Dyskinesien und Fluktuationen in der Wirkung von dopaminergen Medikationen, beispielsweise Wearing-off- und On-off-Phänomene. Andere, vor allem psychiatrische Nebenwirkungen können auch erhebliche Schwierigkeiten verursachen.
Levodopa ist noch das effektivste Medikament gegen Morbus Parkinson. Eine Langzeittherapie mit peroralem Levodopa führt aber oft zu Dyskinesien und motorischen Fluktuationen. Bei Patienten mit fortgeschrittener Erkrankung führt so gut wie jedes Levodopa-Konzentrationsmaximum zu Dyskinesien, und jede Schwankung der Konzentration zu Hypokinesie und Parkinsonismus. Es wird zunehmend schwieriger, mit peroraler Therapie das therapeutische Fenster zu erzielen. Nach fünf Jahren Therapie leiden 50% bis 90% aller Parkinson-Patienten (jüngere Patienten: 80 bis 90%; ältere Patienten: etwa 50%) an solchen Wirkungsfluktuationen. Die Ursache für diese Entwicklung ist noch nicht ganz geklärt, aber es spricht einiges dafür, dass die pulsative Therapie mit Levodopa eine Schlüsselrolle hat.
Im frühen Krankheitsverlauf ist eine physiologische Aufnahme und Decarboxylierung von extern zugeführtem Levodopa noch möglich. Hier ist wahrscheinlich die Speicherung und die Freisetzung von Dopamin relativ normal und die Levodopa-Dosen haben lang andauernde Effekte. Bei Patienten mit fortgeschrittener Erkrankung und Wirkungsfluktuationen wird dagegen zugeführtes Levodopa nahezu unmittelbar decarboxyliert und synaptisch als Dopamin verfügbar (Ergebnisse von PET-Studien). In diesen späten Erkrankungsstadien ist der Anti-Parkinson-Effekt direkt von den fluktuierenden Levodopa-Konzentrationen im Blut abhängig. Ein wichtiger Grund für die fluktuierenden Levodopa-Konzentrationen im Blut ist die unregelmäßige Magenentleerung, in Kombination mit schneller intestinaler Resorption und kurzen Distributions- und Eliminations-Halbwertzeiten. Die unwirksame Zeit der Medikamente im Magen variiert und ist unter anderem davon abhängig, ob der Patient gegessen hat oder nicht [1].
Die Einführung von retardierten Levodopa-Formen sowie Hemmstoffen der Monoaminoxidase B (MAO-B) und der Catechol-O-Methyltransferase (COMT) hat in dieser Beziehung nur begrenzte Verbesserungen bringen können. Mit lang wirkenden Dopaminagonisten war es möglich, eine kontinuierliche dopaminerge Stimulation zu erreichen [2]. Der Grad des Effekts von peroralen Dopaminagonisten ist jedoch meist nicht vergleichbar mit dem von Levodopa und nur wenige Patienten kommt mit einem Dopaminagonisten als Monotherapie über längere Zeit aus.
Um Wirkungsfluktuationen zu vermeiden, versucht man heute, insbesondere bei den jüngeren Patienten, den Beginn der Levodopa-Therapie zu verzögern, und bevorzugt, wenn möglich, eine kontinuierliche dopaminerge Rezeptorstimulation. Ein Weg dieses zu erreichen ist eine kontinuierliche Infusion von Levodopa im Dünndarm mit Hilfe einer tragbaren Pumpe. Das Wirkungsprinzip von Duodopa ist, dass kleine Mengen Levodopa kontinuierlich den Dünndarm erreichen. Dies führt zu stabilerer Levodopa-Konzentration im Blut und Dopamin-Konzentration im Gehirn. Das wiederum bewirkt eine bessere Beweglichkeit und weniger Dyskinesien.
Geschichte
Die erste Studie über eine i.v. Gabe von Levodopa wurde 1975 publiziert und mehrere klinische Studien folgten [1, 3, 4]. Es wurde eindeutig nachgewiesen, dass diese Therapie Wirkungsfluktuationen stabilisieren konnte. Die Patienten wurden aber meist nur wenige Tage behandelt, denn in der Praxis erwies es sich als schwierig, eine i.v. Therapie über längere Zeit durchzuführen.
Die ersten Erfahrungen mit intraduodenaler Levodopa-Infusion wurden 1986 publiziert [5]. Der Effekt war vergleichbar mit dem einer i.v. Levodopa-Gabe. Diese Ergebnisse wurden später in mehreren Studien bestätigt [1]. Die Langzeittherapie mit intraduodenalem Levodopa ist besonders in zwei Zentren weiterentwickelt worden, New Brunswick, NJ, USA und Uppsala, Schweden [6, 7].
Duodopa®
Für die parenterale i.v. Gabe wurde Levodopa früher meist in Wasser oder physiologischer Kochsalzlösung aufgelöst. Ein Decarboxylase-Inhibitor wurde parallel peroral gegeben. Für die enterale Infusion wurde Levodopa in Wasser mit Ascorbat aufgelöst und Decarboxylasehemmer wurden auch hier zusätzlich peroral gegeben. Das Hauptproblem war, dass große Flüssigkeitsvolumina notwendig waren – meist wurde eine Konzentration von 1 mg/ml benutzt, so dass nicht selten 1 bis 2 Liter Infusionslösung täglich notwendig waren. Diese wasserbasierten Lösungen hatten auch nur eine begrenzte Haltbarkeit.
Eine Zusammenarbeit zwischen der neurologischen Klinik und dem Institut für galenische Pharmazie der Universität in Uppsala, Schweden, führte zu der Entwicklung von Duodopa® [1]. Erstmals wurde es 1991 hergestellt. 1994 wurde die Produktion von der Firma Neopharma Production AB (Uppsala, Schweden) übernommen. Seit 2005 hat die Firma Solvay den Vertrieb von Duodopa® übernommen.
Duodopa ist eine Kombination aus Levodopa (20 mg/ml) und Carbidopa (5 mg/ml) in Form eines zähflüssigen pseudoplastischen Gels. Dank der Gelform ist das erforderliche Volumen erheblich kleiner. Gleichzeitig wurde die physikalische und chemische Stabilität verbessert – in Wasser ist Levodopa nur ungefähr einen Tag haltbar, in der Gelzubereitung etwa zwei Monate. Das Gel hält sich homogen, auch bei längerer Lagerungszeit.
Duodopa-Infusionssystem
Für eine Kurzzeittherapie können Nasoduodenalsonden benutzt werden. Für eine Langzeittherapie dagegen wird ein chirurgischer Eingriff notwendig. Meist wird dabei eine perkutane, endoskopische Gastrostomie (PEG) durchgeführt. Diese Methode ist einfach, sicher, gut etabliert und fordert keine Vollnarkose. Chirurgische Jejunostomien sind auch durchgeführt worden, fordern aber einen größeren Eingriff unter Vollnarkose.
Als Pumpe wird zurzeit eine tragbare CADD®-Pumpe (Smiths Medical, Minneapolis, MN, USA) benutzt, die für die Duodopa-Gabe modifiziert ist (Abb. 1).
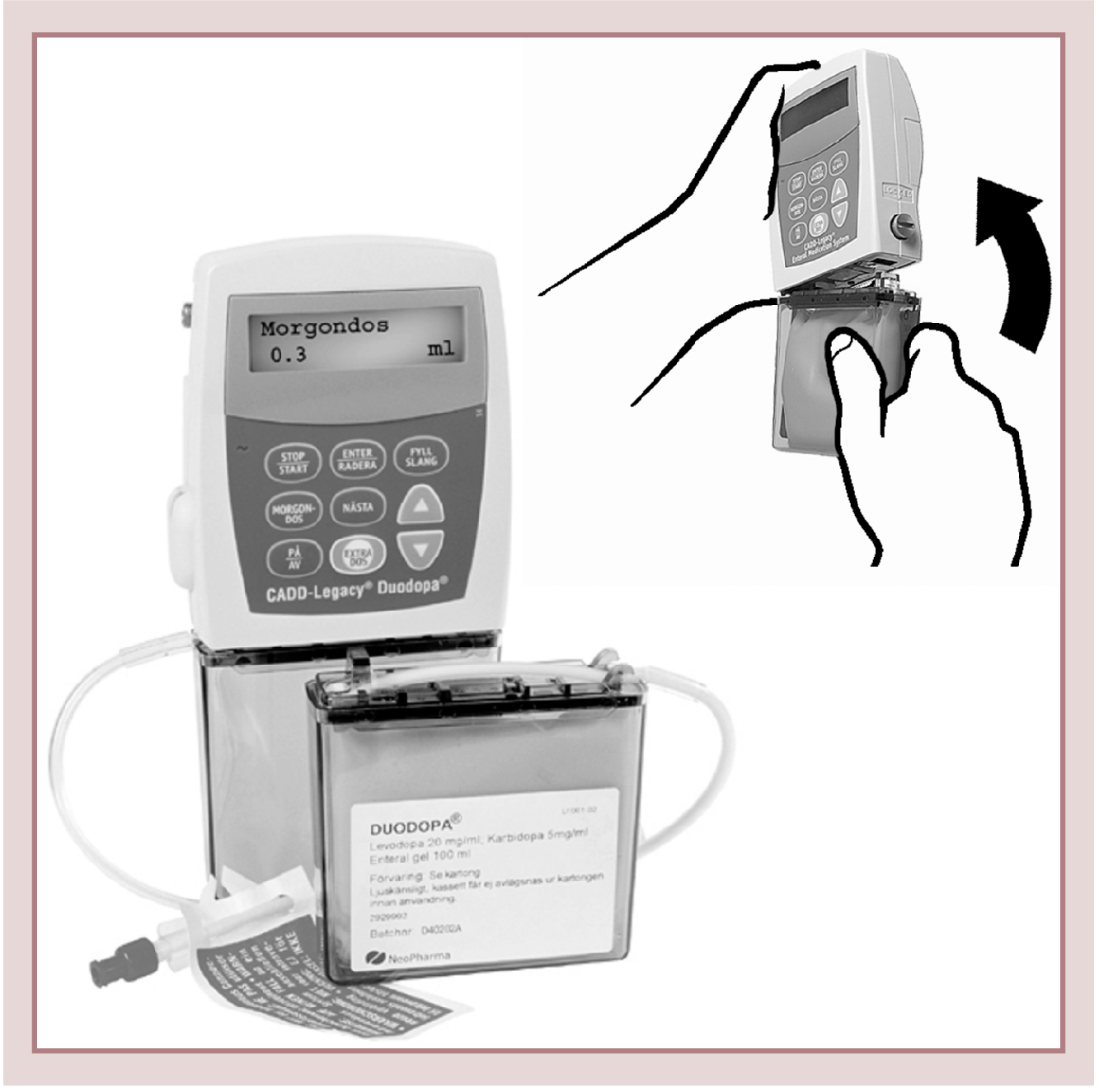
Abb. 1. CADD-Pumpe für Duodopa-Gabe
Methode
Die Duodopa-Therapie wird stationär eingestellt. Bei Therapiebeginn werden meist alle anderen Parkinson-Medikamente abgesetzt. Zuerst wird Duodopa in der Probephase über eine Nasoduodenalsonde gegeben (Abb. 2). Wenn man sich für eine Weiterführung der Therapie entscheidet, wird eine PEG gelegt und ein Duodenal-/Jejunal-Katheter eingeführt. Die tragbare Pumpe liefert kontinuierlich das Wirkstoffgel durch diesen Katheter in den Dünndarm. Somit kann die Therapie innerhalb von drei bis sieben Tagen so eingestellt werden, dass der Patient keine oder nur kurze Off-Perioden oder Phasen mit Dyskinesien hat. Mit Hilfe der Pumpe bekommt der Patient auch die Möglichkeit, die Tagesdosis zu erhöhen oder zu senken oder sich je nach Bedarf eine Extradosis zu geben. Die ganze Einstellung dauert etwa zwei Wochen (stationärer Aufenthalt).
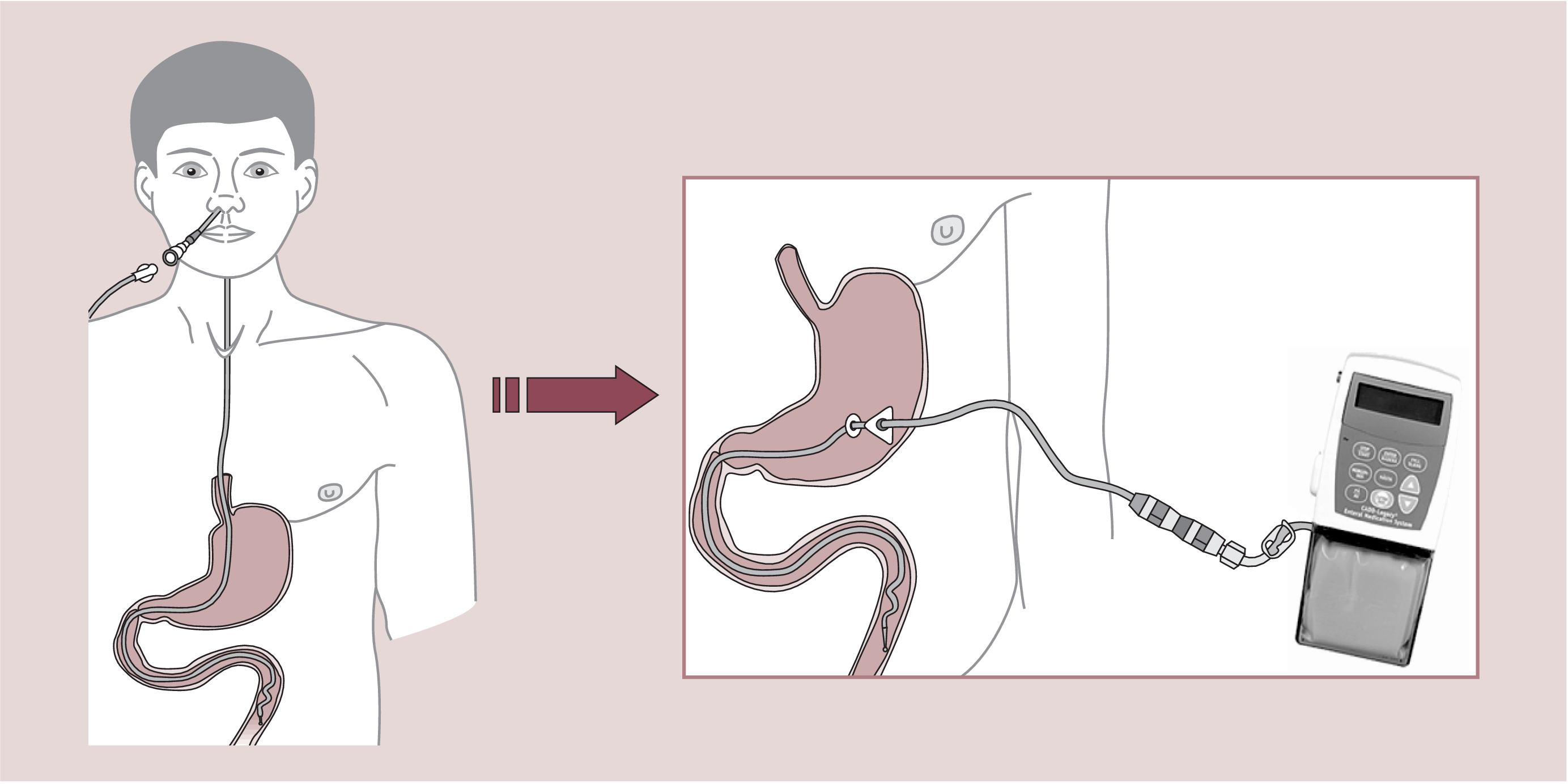
Abb. 2. Testperiode mit Nasensonde, permanente Therapie mit PEG-Sonde
Die benötigte Levodopa-Dosis ist interindividuell sehr unterschiedlich und es ist wichtig, dass sie basierend auf dem klinischen Effekt individuell eingestellt wird. Als mögliche Richtwerte für die gesamte Tagesdosis Duodopa bei Therapiestart werden 1 mg/kg pro Stunde oder 75% der peroralen Gesamttagesdosis empfohlen.
Die gesamte Tagesdosis von Duodopa wird aus drei individuell eingestellten Dosen zusammengesetzt: Der morgendlichen Bolusdosis, der kontinuierlichen Erhaltungsdosis und den Extra-Bolusdosen. Die morgendliche Bolusdosis wird mit der Pumpe verabreicht, um schnell die wirksame Dosishöhe zu erreichen. Die Dosis wird auf der Grundlage der vorhergehenden morgendlichen Levodopa-Dosis des Patienten festgelegt. Die gesamte Morgendosis beträgt gewöhnlich 5 bis 10 ml, was 100 bis 200 mg Levodopa entspricht. Der Effekt ist innerhalb von 10 bis 30 Minuten nach Dosisgabe spürbar. Die kontinuierliche Erhaltungsdosis wird auch individuell eingestellt. Sie sollte innerhalb eines Bereichs von 1 bis 10 ml/h (20–200 mg Levodopa/h) liegen. Meist sind mehrere Dosisanpassungen nötig, bis die optimale Dosis gefunden ist. So wird die Dosis in sehr kleinen Schritten von 0,1 ml/h (2 mg/h) unter Kontrolle der Beweglichkeit des Patienten angepasst. Besonders in den ersten Monaten ist es oft erforderlich, die Dosis neu anzupassen.
Wenn der Patient tagsüber steif wird, hat er die Möglichkeit, Extra-Bolusdosen zu nehmen. Auch diese Extradosen werden individuell eingestellt. Sie liegen normalerweise zwischen 0,5 und 2 ml. Wenn es notwendig ist, mehr als fünfmal täglich eine Extra-Bolusdosis zu verabreichen, sollte die Erhaltungsdosis erhöht werden.
Meist wird Duodopa nur tagsüber gegeben. Wenn medizinisch notwendig, kann es auch während der Nacht verabreicht werden. In wenigstens einem Fall wurde Duodopa bei einem Parkinson-Patienten mit Schlafschwierigkeiten nur nachts gegeben. Der Schlaf verbesserte sich und interessanterweise auch die Parkinson-Symptome tagsüber.
In einigen Studien wurden andere perorale Parkinson-Medikamente völlig abgesetzt, in anderen beibehalten. Hier gibt es keinen Konsens. Viele Patienten haben aber auch andere Formen von Parkinson-Medikation parallel zu Duodopa. Beispielsweise nehmen die Patienten häufig lang wirkende Levodopa-Tabletten, um die Nächte zu überbrücken. Manche Neurologen halten es für indiziert, einen peroralen Dopaminagonisten parallel zu geben.
Duodopa wird im 100-ml-PVC-Beutel in einer Schutzkassette aus Hartplastik geliefert. Die Kassetten sollen bei 2 bis 8 °C gelagert werden. So gelagert ist Duodopa 15 Wochen haltbar. Nach Anbruch ist es über wenigstens 16 Stunden (bei 40 °C) stabil. Gegen Ende der Lagerungszeit kann das Gel leicht bräunlich werden. Dies hat aber keinen Einfluss auf die Konzentration des Arzneistoffs oder den Behandlungseffekt.
Pharmakokinetik
Es ist wiederholt nachgewiesen worden, dass die Duodopa-Infusion eine sehr stabile Plasmakonzentration von Levodopa erzielt (Abb. 3) [8]. Im Vergleich zu retardierten wie auch normalen p.o. Levodopa-Formen hat Duodopa den niedrigsten Variationskoeffizienten (Standardabweichung als Prozentanteil des Mittelwerts). In einer randomisierten Cross-over-Studie mit 12 Patienten die über 3+3 Wochen retardiertes Levodopa beziehungsweise die Duodopa-Infusion erhielten, ergab sich ein Variationskoeffizient von 34% mit oraler Therapie und 14% mit Infusion [8]. Die Levodopa-Infusion kann auch zu einem erweiterten therapeutischen Fenster führen [9]. So bekommen manche Patienten wiederholte zeitbegrenzte Infusionen (meistens i.v.) und werden in der Zwischenzeit mit peroralen Medikamenten behandelt.
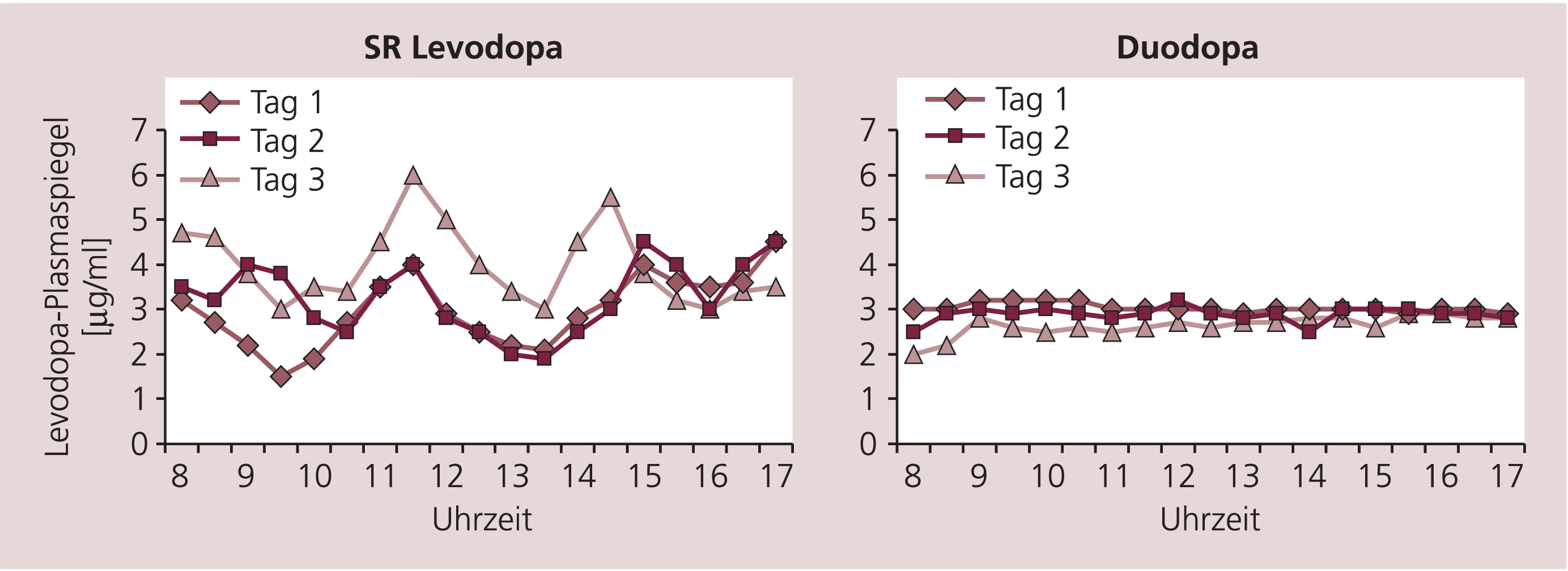
Abb. 3. Levodopa-Plasmakonzentration bei oraler Gabe von anhaltend freisetzenden Levodopa-Tabletten (links) und bei Duodopa-Infusion (rechts) bei einem Patienten mit M. Parkinson. Mit Duodopa werden konstantere Blutspiegel erreicht [8].
Wirkung auf motorische Symptome
Alle publizierten Studien mit Levodopa-Infusionen zeigen signifikant reduzierte Motorfluktuationen und vermehrte Zeit in „on“ [1]. Als Beispiel hierfür haben Nyholm et al. [10] Ergebnisse einer randomisierten Cross-over-Studie (Monotherapie mit intraduodenaler Infusion von Levodopa/Carbidopa vs. individualisierter konventioneller Therapie) mit 24 Patienten publiziert. Hier zeigte sich auf der Basis von Videoaufnahmen eine Zunahme der „on“-Bewertungen von 81 auf 100% (Medianwerte), eine entsprechende Reduktion der „off“-Bewertungen sowie eine Verbesserung des UPDRS-Scores von 53 auf 35. Auch die Lebensqualität verbesserte sich signifikant (gemessen mit „Parkinson’s Disease Questionnaire-39, PDQ-39“ und „15D Quality of Life Instrument“). Die Nebenwirkungen waren in beiden Gruppen vergleichbar.
Manche motorischen Fluktuationen können weiterhin auftreten. Dies betrifft beispielsweise Off-Perioden nach größeren eiweißreichen Mahlzeiten sowie Off-Perioden oder Dyskinesieperioden im Zusammenhang mit Stress. Wiederholt wird auch gesehen, dass Patienten am späten Nachmittag/frühen Abend etwas mehr Off-Symptome haben, so dass man überlegen kann, etwas höhere Dosen nachmittags/abends zu geben.
Wirkungen auf nicht-motorische Symptome und Lebensqualität sind bisher nicht dokumentiert worden. Es gibt auch keine Untersuchungen zu eventuellen neuroprotektiven Eigenschaften dieser Therapie.
Technische Probleme
Das häufigste technische Problem ist, dass der Dünndarmkatheter disloziert. Dies passiert durchschnittlich bei jedem Patienten ein- bis zweimal pro Jahr. Durch die Verlagerung der Sonde zurück in den Magen kommt es zum erneuten Auftreten von Wirkungsfluktuationen. Die Katheterlage muss dann unter Röntgenkontrolle korrigiert werden.
Es kommt auch vor, dass die Sonde verstopft oder abknickt. Verstopfungen können meist dadurch beseitigt werden, dass die Sonde mit Leitungswasser gespült wird. Abknickungen müssen durch eine Neupositionierung der Sonde behoben werden.
Das Stoma heilt meist ohne größere Komplikationen. Kurz nach dem chirurgischen Eingriff kann es jedoch zu Bauchschmerzen, Infektionen und Absonderungen von Magenflüssigkeit kommen. Dies ist aber selten ein Langzeitproblem. Die häufigsten lokalen Langzeit-Komplikationen sind Sekretion und hypertrophisches Granulationsgewebe. Lokale Infektionen um das Stoma herum werden mit Desinfektionsmitteln behandelt, eine Behandlung mit Antibiotika ist selten erforderlich.
Sonstige Nebenwirkungen
Die Nebenwirkungen von Duodopa sind ansonsten die gleichen wie bei der Tablettentherapie mit Levodopa/Carbidopa. Eine leichte Übelkeit und Appetitverlust kommen manchmal, besonders am Anfang der Therapie, vor. Übereffekt in Form von Dyskinesien und Untereffekt in Form von Parkinsonismus kommen seltener vor als bei der Tablettentherapie.
Albträume, Halluzinationen und Verwirrtheit können, wie auch bei Tablettentherapie, auftreten. Es gibt keinen Anhalt dafür, dass diese Nebenwirkungen mit Duodopa häufiger sind als bei peroraler Therapie.
Einige Patienten berichten über eine langfristig sedierende Wirkung von Levodopa und Carbidopa. Daneben treten in Einzelfällen – wie bei anderen Parkinson-Therapien auch – plötzliche Schlafepisoden (plötzliches Einsetzen von Schlaf ohne vorherige Müdigkeit oder Warnsignale) in Zusammenhang mit der Behandlung auf. Patienten, die mit Duodopa behandelt werden, werden deshalb darüber informiert, dass sie beim Autofahren oder beim Bedienen von Maschinen vorsichtig sein müssen.
Behandlungserfahrungen
Patientenbeispiel 1
Die Patientin war 71 Jahre und seit 1986 an M. Parkinson erkrankt. Seit 2000 litt sie unter Wirkungsfluktuationen. Vor der Duodopa-Therapie war sie 55%/Tag in „off“, 15%/Tag in Dyskinesien, und der Score gemäß UPDRS Teil III (motorische Untersuchung) betrug in „off“ 63. Da die Patientin sehr dünn war (begrenztes Fettgewebe), wurde von einer Apomorphin-Pumpe abgesehen. Bei der PEG–Anlage traten Komplikationen mit Temperatursteigerung bis zu 40 °C und CRP 137 mg/l auf. Im Röntgen-Abdomen sah man freie Luft. Perforation wurde durch Gastrografin-Schluck ausgeschlossen. Nach Antibiotika-Gabe und einer Erholungsphase von sechs Wochen bekam die Patientin ohne weitere Komplikationen die PEG-Anlage. Die Duodopa-Einstellung dauerte 10 Tage mit einer Laufzeit von 06:00 Uhr bis 22:00 Uhr. Die kontinuierliche Rate betrug 3,7 ml/h. Ergebnis: On-Phasen bis zu 95%/Tag, 10% davon mit leichten Dyskinesien.
Nach drei Monaten beschrieb die Patientin, dass sie morgens Schwierigkeiten hatte, trotz Extradosen eine Wirkung zu bekommen. Ferner hätten ihre Off-Phasen bis zu 50%/Tag zugenommen. Daraufhin wurde auf eine 24-stündige Duodopa-Therapie umgestellt: Morgendosis 4,0 ml/h (80 mg Levodopa), kontinuierliche Dosis am Tag: 3,6 ml/h (72 mg Levodopa), ab 22:00 Uhr: 3,6 ml/h, Extradosis: 1,1 ml/h (22 mg Levodopa). Die On-Phasen bestanden danach an 99% des Tages, an 25% des Tages mit leichten Dyskinesien. Als Nebenwirkungen traten Hautreizung und Entzündung an der PEG-Einstichstelle auf. Diese konnten mit Fuchsin-Lösung behoben werden.
Patientenbeispiel 2
Der Patient war 62 Jahre alt, männlich und seit 1994 an M. Parkinson erkrankt. Seit drei Jahren bestanden On-off-Fluktuationen, dazu dopaminerge psychotische Nebenwirkungen. Der Patient tendierte zur Überdosierung von Levodopa. Um eine regelmäßige Medikamenten-Einnahme und damit eine verbesserte Symptomatik zu erzielen, wurde eine Duodopa-Pumpe eingesetzt. Vor der Duodopa-Therapie war der Patient 60%/Tag in „off“, 15%/Tag in Dyskinesien, und der UPDRS-Teil-III-Score in „off“ betrug 65. Unter der kontinuierlichen Duodopa-Gabe verbesserte sich die Zeit in „on“ bis zu 90%/Tag. Morgendosis: 5,8 ml/h, Erhaltungsdosis: 4,9 ml/h, Extradosis: 1,7 ml/h. Ab 21:00 Uhr wurde die Erhaltungsdosis auf 3,5 ml/h reduziert. Unter der Therapie mit Quetiapin (Seroquel®) 75–0–100 mg wurden Halluzinationen und Wahnvorstellungen nicht mehr gesehen.
Drei Monate später klagte der Patient über Hypokinesien bis zu 60%/Tag. Die Steifigkeit trat besonders am frühen Abend und nachts auf. Die Erhaltungsdosis wurde auf 6,1 ml/h, ab 22:00 Uhr auf 3,8 ml/h erhöht. Danach befand sich der Patient zu 95%/Tag im On-Zustand, dabei 10%/Tag mit leichten bis mäßigen Überbewegungen.
Patientenbeispiel 3
Der Patient war 69 Jahre alt, männlich und seit 1989 an M. Parkinson erkrankt. Seit 2002 bestanden Wirkungsfluktuationen. Daraufhin wurde zunächst die Apomorphin-Injektion (2 bis 3 mg bis zu 5x täglich) eingesetzt. Dies führte aber zu Nebenwirkungen mit Halluzinationen und wiederholten Stürzen durch orthostatischen Blutdruckabfall. Vor der Duodopa-Therapie: 65%/Tag in „off“ (inkl. off-freezing), 5%/Tag in leichten Dyskinesien, UPDRS-Teil-III-Score in „off“ 46.
Innerhalb einer Woche wurde nach der PEG-Anlage die Duodopa-Pumpe eingestellt. Laufzeit von 6:00 Uhr bis 22:00 Uhr. Morgendosis: 6,8 ml/h, Erhaltungsdosis: 4,6 ml/h und Extradosis: 1,0 ml/h. Die oralen Parkinson-Medikamente wurden, bis auf eine Tablette Nacom® zur Nacht, abgesetzt. Nach vier Wochen stellte sich der Patient ambulant erneut vor und berichtete, dass er meist leicht überbeweglich sei, aber nur noch selten Off-Phasen hatte. Die Erhaltungsdosis wurde daraufhin auf 4,5 ml/h reduziert. Ergebnis: 5%/Tag in „off“ und 95%/Tag in „on“, davon 5%/Tag leichte Dyskinesien.
Toleranzentwicklung
Bei der Tagestherapie mit Duodopa gibt es keinen Anhalt für eine Toleranzentwicklung. Im Gegenteil können die Patienten häufig am Anfang der Therapie (während der ersten Wochen bis Monate) die Dosis reduzieren. Bei einer 24-Stunden-Therapie ist es weniger klar. Hier gibt es einzelne Patientenberichte über eine mögliche Toleranzentwicklung [1].
Indikation und Kontraindikation
Die Therapie ist für Parkinson-Patienten mit Fluktuationen in der Wirkung von peroralen Parkinson-Medikamenten geeignet. Bei folgenden Erkrankungen soll Duodopa laut Hersteller vermieden werden: Überempfindlichkeit gegen Levodopa oder Carbidopa, Glaukom, schwerer Leber- und Nierenerkrankung, schwerer Herzschwäche, schweren Herzrhythmusstörungen, frischem Schlaganfall.
Langzeitbetreuung
Es wird empfohlen, die mit Duodopa behandelten Patienten wenigstens zweimal jährlich ambulant zu kontrollieren, zusätzlich bei Bedarf, beispielsweise bei Verdacht auf Verlagerung der Sonde. Empfohlen wird, dass ein Neurologe, eine spezialisierte Pflegekraft („Parkinson Specialist Nurse“) und ein Radiologe oder ein Chirurg an dieser Betreuung direkt beteiligt sind.
Gründe für bisher relativ begrenzte Nutzung der Levodopa-Infusion
Die Vorteile der kontinuierlichen Gabe von Levodopa sind seit über 20 Jahren eindeutig belegt. Trotzdem ist dieses Konzept bisher selten klinisch angewendet worden. Es gab verschiedene Gründe dafür. Der wichtigste Grund war, dass es bisher keine praktisch-nutzbaren Systeme für eine Levodopa-Infusion gab. Dies hat sich jetzt geändert. Ein weiterer Grund war, dass mehrere neue perorale Therapiemöglichkeiten sowie die kontinuierliche Therapie mit s.c. Apomorphin auf den Markt kamen. Weiter hat sich die Tiefenhirnstimulation als eine wirksame und relativ sichere Therapieform etabliert.
Duodopa vs. Apomorphin-Infusion
Bisher gibt es keine direkten Vergleichsstudien zwischen Duodopa-Therapie und s.c. Therapie mit Apomorphin über tragbare Pumpen [11]. Es handelt sich um zwei hochpotente Therapien und die klinische Erfahrung zeigt, dass die Wirkung relativ ähnlich ist. Es scheint aber, als ob bei einem größeren Anteil von Duodopa-Patienten eine Monotherapie möglich sei als bei Apomorphin-Behandlung. Entscheidend für die Wahl zwischen Duodopa und Apomorphin sollten am ehesten mögliche Nebenwirkungen und praktisch-klinische Aspekte sein. Bei Duodopa ist ein chirurgischer Eingriff (PEG) notwendig, bei Apomorphin nicht. Bei Apomorphin kommen lokale Irritationen (Noduli) an der Infusionsstelle häufig vor, bei Duodopa nicht. Auch Pumpen und Infusionsmaterial unterscheiden sich.
Duodopa vs. Tiefenhirnstimulation
Es gibt bisher keine Vergleichsstudien zwischen Langzeit-Duodopa-Therapie und Tiefenhirnstimulation [12]. Es gibt auch zu wenig klinische Erfahrung, um über den relativen Effekt sichere Aussagen machen zu können. Deutlich ist, dass beide Methoden in Bezug auf die Verbesserung der motorischen Symptome sehr potent sind. Das Faktum, dass Duodopa keine schweren und meist rückläufige Nebenwirkungen und Risiken und Tiefenhirnstimulation zum Teil nicht-rückläufige Nebenwirkungen haben kann [13], spricht dafür, Duodopa wenigstens zu erwägen, bevor eine Tiefenhirnstimulation durchgeführt wird. Außerdem kann dies eine Alternative für Patienten sein, bei denen ein chirurgischer Eingriff kontraindiziert ist.
Zusammenfassung
Mehrere Forschungsgruppen haben unabhängig voneinander die Vorteile einer kontinuierlichen Levodopa-Therapie in Bezug auf konstante Plasmakonzentration und Reduktion von Wirkungsfluktuationen bei Patienten mit fortgeschrittener Parkinson-Krankheit nachgewiesen. Duodopa bietet jetzt eine praktikable Lösung für Patienten, bei denen diese Art der Therapie indiziert ist.
Literatur
1. Nyholm D, Aquilonius SM. Levodopa infusion therapy in Parkinson disease: state of the art in 2004. Clin Neuropharmacol 2004;27:245–56.
2. Movement Disorder Society. Management of Parkinson’s disease: an evidence-based review. Mov Disord 2002;17:S1–166.
3. Quinn N, Marsden CD, Parkes JD. Complicated response fluctuations in Parkinson’s disease: response to intravenous infusion of levodopa. Lancet 1982;2:412–5.
4. Shoulson I, Glaubiger GA, Chase TN. On-off response. Clinical and biochemical correlations during oral and intravenous levodopa administration in parkinsonian patients. Neurology 1975;25:1144–8.
5. Kurlan R, Rubin AJ, Miller C, Rivera-Calimlim L, et al. Duodenal delivery of levodopa for on-off fluctuations in parkinsonism: preliminary observations. Ann Neurol 1986;20:262–5.
6. Syed N, Murphy J, Zimmerman T Jr, Mark MH, et al. Ten years’ experience with enteral levodopa infusions for motor fluctuations in Parkinson’s disease. Mov Disord 1998;13:336–8.
7. Nilsson D, Nyholm D, Aquilonius SM. Duodenal levodopa infusion in Parkinson’s disease – long-term experience. Acta Neurol Scand 2001;104:343–8.
8. Nyholm D, Askmark H, Gomes-Trolin C, Knutson T, et al. Optimizing levodopa pharmacokinetics: intestinal infusion versus oral sustained-release tablets. Clin Neuropharmacol 2003;26:156–63.
9. Stocchi F, Bonamartini A, Vacca L, Ruggieri S. Motor fluctuations in levodopa treatment: clinical pharmacology. Eur Neurol 1996;36(Suppl 1):38–42.
10. Nyholm D, Nilsson Remahl AI, Dizdar N, Constantinescu R, et al. Duodenal levodopa infusion monotherapy vs. oral polypharmacy in advanced Parkinson disease. Neurology 2005;64:216–23.
11. Hagell P, Odin P. Apomorphine in the treatment of Parkinson’s disease. J Neurosci Nurs 2001;33:21–34, 37–8.
12. Volkmann J. Deep brain stimulation for the treatment of Parkinson’s disease. J Clin Neurophysiol 2004;21:6–17.
13. Hariz MI. Complications of deep brain stimulation surgery. Mov Disord 2002;17(Suppl 3):S162–6.
Prof. Dr. Per Odin, Anne Rüssmann, Neurologische Klinik, Klinikum Bremerhaven Reinkenheide, Postbrookstraße 103, 27574 Bremerhaven, E-Mail: per.odin@klinikum-bremerhaven.de
Sten-Magnus Aquilonius, Dept. of Neurology, Uppsala University Hospital, 75185 Uppsala, Schweden, E-Mail: sten-magnus.aquilonius@neurologie.uu.se
Pump-driven continuous duodenal administration of levodopa – a new therapy for patients with advanced Parkinson’s disease
Oral levodopa, combined with a decarboxylase inhibitor, is still the golden standard in the therapy of Parkinson’s disease. A problem with this therapy is the occurrence of fluctuations in the effect of the medication, seen in a majority of the patients, already after a few years of treatment. This depends on the correlation of dopamine concentration at the striatal dopamine receptors with the plasma levodopa concentration. Levodopa is resorbed first in the proximal part of the small intestine and the plasma concentrations are therefore dependent on an often very irregular gastric emptying. In more advanced stage not only the plasma concentration, but also the dopamine concentration at the dopamine receptors become irregular. Improvements of the oral therapy, including the introduction of MAO-B and COMT inhibitors, have not solved this problem. Therefore methods for continuous infusion of levodopa (intravenous or intraduodenal) have been developed. Several clinical studies have demonstrated that both the plasma levodopa concentrations and the clinical symptomatology stabilize with this type of levodopa infusions. The therapy has proved safe and effective. Since about a year now Duodopa is on the market in several European countries. Duodopa is a levodopa/carbidopa gel, which can be infused intraduodenally with portable pump systems. A number of clinical studies have showed that Duodopa treatment leads to clear improvement in motor symptomatology when given to Parkinson patients with motor fluctuations. The time in “on” (good status) increases and the time on “off” (Parkinson symptoms) and time with dyskinesias decrease, compared to oral therapy. Duodopa is today beside deep brain stimulation and s.c. apomorphine infusion, an interesting and important option for patients with advanced Parkinson’s disease.
Keywords: Parkinson’s disease, levodopa, infusion, motor fluctuations, pharmacokinetics
Psychopharmakotherapie 2005; 12(06)
