Wolfgang H. Jost, Wiesbaden
Stalevo® ist die Kombination von Levodopa mit einem Decarboxylase- und einem COMT-Hemmer. Es stellt sich natürlich die Frage, welche Vorteile die fixe Kombination bietet. Hierzu eine Aussage des Begründers der Levodopa-Therapie:
„Walter Birkmayer war immer der Meinung, dass sich die Therapie mit Levodopa nur dann durchsetzen würde, wenn die abbauenden Enzyme von Dopamin gehemmt werden können. Deswegen waren MAO-Hemmer schon anfangs der 60er Jahre in Verwendung. Ab 1974 wurde Selegilin wegen geringerer Nebenwirkungen therapiereif gemacht. Konsequenterweise wurde später die Hemmung von COMT erfolgreich geprüft. Damit ist die Vision des Doyen der modernen Parkinson-Therapie, Walter Birkmayer, in Erfüllung gegangen. Die moderne Parkinson-Therapie war geboren.“ [Prof. Dr. Peter Riederer]
Warum setzten wir COMT-Hemmer ein?
Ein großes Problem der Levodopa-Therapie ist, dass nur ein Teil der oral aufgenommenen Dosis die Blut-Hirn-Schranke überwindet. Der erste für die Levodopa-Therapie bahnbrechende Schritt war die Zugabe eines Decarboxylase-Hemmers (Benserazid, Carbidopa), wodurch eine ausreichende Konzentration erreicht und die unerwünschten Wirkungen reduziert werden konnten. Nach Hemmung der Decarboxylase durch Benserazid oder Carbidopa ist die O-Methylierung der wichtigste Stoffwechselweg der Metabolisierung (Abb. 1).
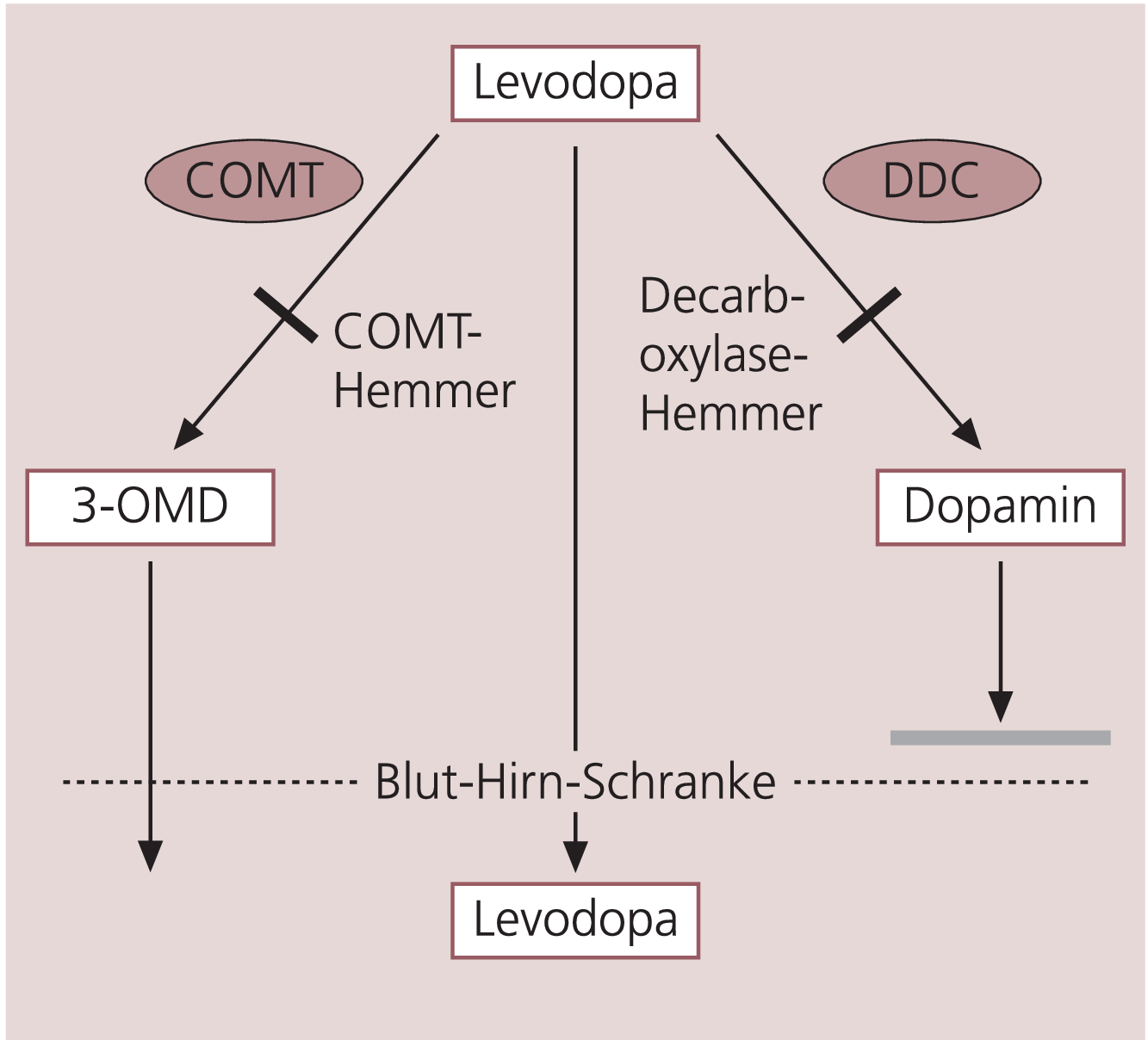
Abb. 1. Levodopa wird peripher über die COMT und Dopa-Decarboxylase (DDC) abgebaut. Werden diese beiden Abbauwege gehemmt, gelangt mehr Levodopa durch die Blut-Hirn-Schranke ins Gehirn.
Dieser Abbauweg zu 3-O-Methyldopa (3-OMD) erfolgt über die Catechol-O-Methyl-Transferase (COMT). COMT-Hemmer reduzieren die Bildung von 3-OMD bis zu 90% [15].
Es war daher folgerichtig, zur Optimierung der Levodopa-Therapie auch diesen Abbauweg zu hemmen. In der Entwicklung ergaben sich jedoch Probleme, da entweder die ubiquitäre unspezifische Hemmung der COMT zu erheblichen unerwünschten Wirkungen, vor allem an der Leber führte, oder die Substanz zu toxisch oder zu wenig wirksam war. Bisher gelangten nur zwei Substanzen, beide reversible COMT-Hemmer mit einer Nitrocatecholstruktur, zur Markteinführung: Tolcapon (Tasmar®) und Entacapon (Comtess®).
Entacapon
Entacapon ist ein rein peripher wirkender COMT-Hemmer, der seit Herbst 1998 zugelassen ist. Er verringert die Plasmaelimination und erhöht somit die Plasmakonzentration von Levodopa, wodurch die Verfügbarkeit für den Transport durch die Blut-Hirn-Schranke erhöht wird. Die Wirkungsdauer des Levodopa wird verlängert, wobei sich die Spitzenkonzentrationen nicht wesentlich ändern. Auch bei längerer Einnahme akkumuliert Entacapon nicht. Durch die Gabe des COMT-Hemmers können durchschnittlich 100 mg oder 10 bis 30% der Levodopa-Dosis eingespart werden [9].
Entacapon verlängert die On-Zeit der Patienten um etwa 20%, in Einzelfällen bis maximal 60%, bei gleichzeitiger Verbesserung der motorischen Scores.
Bioverfügbarkeit und Wirkungsdauer des Levodopa-Präparats werden durch die COMT-Hemmer erhöht. Einen Effekt erzielt man bereits mit 50 mg Entacapon. Bei Dosissteigerung zeigt sich ein linearer dosisabhängiger Anstieg der maximalen Plasmakonzentration. Die pharmakologisch beste Wirkung wird mit 200 mg erreicht. Die Substanz wird schnell resorbiert, die Wirkung tritt nach knapp 20 Minuten ein, das Wirkungsmaximum wird nach etwa einer Stunde erreicht. Die Halbwertszeit im Plasma liegt bei etwa 3,4 Stunden. Die Ausscheidung erfolgt hauptsächlich biliär. Etwa 10% der eingenommen Dosis werden renal ausgeschieden.
Hierbei ist anzumerken, dass die Halbwertszeit von Levodopa (plus Decarboxylase-Hemmer) bei unter zwei Stunden liegt und durch die Gabe von COMT-Hemmern um etwa eine Stunde auf knapp drei Stunden verlängert werden kann [2, 9].
Levodopa und Entacapon haben eine ähnliche Pharmakokinetik, weswegen es sinnvoll erscheint, jede Levodopa-Dosis mit einer Entacapon-Gabe zu kombinieren. Durch die kurze Halbwertszeit ist die Therapie gut steuerbar. Ein Einschleichen ist nicht erforderlich, kann sich jedoch in Einzelfällen als sinnvoll erweisen, da hierdurch möglichen unerwünschten Wirkungen wie Dyskinesien und Überdosierungen besser begegnet werden kann. Zwar werden die Spitzenkonzentrationen nicht erhöht, doch werden durch die höhere Bioverfügbarkeit und längere Wirkungsdauer die Levodopa-Plasmaspiegel erhöht.
Als vorteilhaft erweist sich, dass man bereits innerhalb der ersten Tage weiß, ob die Gabe des COMT-Hemmers hilfreich ist.
Unerwünschte Wirkungen
Die banalste, für Patienten aber sehr unangenehme unerwünschte Wirkung ist eine Gelbverfärbung des Urins, worüber man die Patienten aufklären sollte, damit nach der Einnahme keine Verunsicherung besteht. Die häufigsten unerwünschten Wirkungen sind Übelkeit und Diarrhöen (jeweils bis zu 20%). Vor allem die Durchfälle, die in einigen Untersuchungen in bis zu 26% der Fälle auftreten, führen häufig zu einem Therapieabbruch. Die Ursache dieser Diarrhöen ist noch nicht definitiv geklärt [8]. In einer anderen Studie lag die Rate an relevanten Durchfällen, die zum Therapieabbruch führten, deutlich niedriger [22]. Handelt es sich nur um einen dünnflüssigen Stuhl über einige Tage, kann abgewartet werden, ob sich dieses Symptom zurückbildet. Zum Therapieabbruch führen die Diarrhöen jedoch seltener [9]. Die Rate an Diarrhöen ist unter Tolcapon höher als unter Entacapon [16].
Als weitere häufige und sehr relevante unerwünschte Wirkungen sind die Dyskinesien erwähnenswert. Diese Dyskinesien sind Ausdruck der Wirkung des Medikaments und sollten zur Reduktion der Levodopa-Dosis führen. Sind Compliance-Probleme absehbar, empfiehlt es sich, Entacapon nicht sofort in der Maximaldosis zu geben, damit bei möglichen Dyskinesien besser gegengesteuert werden kann.
Werden COMT-Hemmer abgesetzt, sollte dies nicht abrupt geschehen, da hierdurch rein theoretisch ein Levodopa-Entzugssyndrom auftreten könnte. Wichtiger ist, dass bei dieser Umstellung in der Regel die Levodopa-Dosis erhöht werden muss, da sich ansonsten der klinische Zustand verschlechtert.
Eine Kombination von Entacapon ist mit jedem anderen Parkinson-Medikament möglich. Unterschiede bezüglich retardierter und unretardierter Levodopa-Formen ergeben sich nicht [22]. Man muss natürlich wissen, dass retardiertes Levodopa eine deutlich geringere Wirkung (Plasmakonzentration) erzielt als gleich dosiertes unretardiertes Levodopa.
Ob MAO- und COMT-Hemmer gemeinsam gegeben werden sollten, ist zum jetzigen Zeitpunkt noch nicht abschließend beantwortet. Einige Untersuchungen lassen eine potenzielle Neurotoxizität bei kombinierter Gabe vermuten. Bis zu 10 mg Selegilin (z.B. Movergan®) ist eine Kombination möglich.
Kontraindiziert oder relativ kontraindiziert sind MAO-A-Hemmer, Noradrenalin-Wiederaufnahmehemmer sowie Substanzen mit einer Catecholgruppe (z.B. Dopamin, Apomorphin).
Die für Tolcapon vermuteten fulminanten Hepatitiden, durch eine Entkopplung der oxidativen Phosphorylierung, treten unter Entacapon nicht auf, da sie nicht direkte Folge der COMT-Hemmung sind [1]. Die Leberwerterhöhungen unter Entacapon sind nach den vorliegenden Studien minimal [9]. Eine Überprüfung der Leberwerte ist nicht erforderlich, in der Aufdosierungsphase jedoch gerechtfertigt. Demgegenüber müssen bei der Verordnung von Tolcapon regelmäßige Laborkontrollen entsprechend den Herstellerrichtlinien durchgeführt werden.
Da Entacapon bei vielen Patienten mittlerweile über einen längeren Zeitraum gegeben wird, darf die Substanz insgesamt als gut verträglich angesehen werden [22].
Indikationen für COMT-Hemmer
Derzeit lassen sich keine verbindlichen Empfehlungen zum Zeitpunkt des Einsatzes von COMT-Hemmern treffen. Es darf davon ausgegangen werden, dass sowohl fluktuierende als auch nicht fluktuierende Patienten profitieren [3, 24]. Stellenweise wird der frühe Einsatz der COMT-Hemmer gefordert, um die pulsatile Stimulation zu reduzieren [19]. Hierdurch könnten eventuell die motorischen Komplikationen reduziert oder verzögert werden [24], was im Tierversuch bereits belegt werden konnte [11, 20].
Als unbestritten darf zum jetzigen Zeitpunkt der Einsatz bei Wirkungsfluktuationen angesehen werden. Weitere Indikationen können mangelndes Ansprechen nicht-fluktuierender Patienten, Therapieprobleme unter der sonstigen Medikation, wie Psychosen, kardiovaskuläre Probleme, Unverträglichkeiten anderer Substanzen sein.
Dreifachkombinationen
Entacapon wird üblicherweise parallel mit Levodopa eingesetzt. Dies ist möglich durch die vergleichbare Halbwertszeit. Die Maximaldosis von Entacapon beträgt 2000 mg, was einer Einnahme von zehn Tabletten Comtess® entspricht. Daher liegt es nahe, Entacapon in einer fixen Kombination (Stalevo®) zu geben. Hierdurch wird die Compliance des Patienten verbessert, da er weniger Tabletten einnimmt. Es lassen sich aber auch Einnahmefehler, wie zu seltene oder zu häufige Einnahme, vermeiden.
In verschiedenen Studien (z.B. SIMCOM, TC-INIT, SELECT-TC) konnte gezeigt werden, dass die Tablette mit den drei Inhaltsstoffen genauso wirksam ist wie die gemeinsame Gabe der einzelnen Präparate [4, 14, 25]. Eine Umstellung von Levodopa/Decarboxylase-Hemmer und Entacapon auf die Dreifachkombination (Stalevo®) kann direkt erfolgen [4, 10, 14].
In einer Vergleichsstudie von Brooks et al. [4] konnte gezeigt werden, dass Stalevo® gleich wirksam ist wie die Kombination eines Levodopa/Decarboxylase-Hemmer-Präparats mit Entacapon. Dabei wurde die „Triple-Tablette“ von 81% der untersuchten Patienten bevorzugt [4].
Gibt es noch einen Grund für Levodopa ohne COMT?
Grundsätzlich wäre zu überlegen, ob man nicht generell bei Beginn der Levodopa-Therapie die „Triple-Tablette“ verordnet. Dies scheitert derzeit vor allem an den Kosten, aber auch an der Zulassungssituation. Aktuell besteht eine Zulassung für Stalevo® „bei Patienten mit Morbus Parkinson, bei denen End-of-Dose-Fluktuationen im Krankheitsverlauf auftreten, die durch eine Behandlung mit Levodopa und einem Decarboxylase-Hemmer nicht ausreichend stabilisiert sind“.
Sollte eine derzeit durchgeführte Studie (STRIDE-PD) belegen, dass durch die frühe Kombination Spätkomplikationen vermieden werden [11, 20, 24], wäre dies ein Grund den COMT-Hemmer früher einzusetzen.
Probleme
Stalevo® ist nur geeignet für Patienten, die 50, 100 oder 150 mg Levodopa bekommen sollen, da nur entsprechende Tabletten vorliegen. Bei Patienten die mit 75 oder 87,5 mg Levodopa behandelt werden, besteht die Option zur einfachen Umstellung nicht. Eine leichte Gefahr ergibt sich, wenn Patienten aus Unwissenheit statt einer Stalevo® 100 zwei Tabletten Stalevo® 50 einnehmen. Hierdurch würden sie die doppelte Entacapon-Dosis, das heißt 400 mg Entacapon einnehmen.
Ein Argument gegen den Einsatz von Stalevo® sind häufig die Kosten. Dabei ist zu sagen, dass man einerseits Kosten gegenüber der Kombination von Levodopa/Decarboxylase-Hemmer und Comtess® einspart und weiterhin in einer großen Untersuchung gezeigt werden konnte, dass durch Einsatz von Stalevo® die Gesamtkosten sogar reduziert werden können [7].
Literatur
1. Assal F, Spahr L, Hadengue A, et al. Tolcapone and fulminant hepatitis. Lancet 1998;352:958.
2. Baas H, Zehrden F, Selzer R, et al. Pharmacokinetic-pharmacodynamic relationship of levodopa with and without tolcapone in patients with Parkinson’s disease. Clin Pharmacokinet 2001;40:383–93.
3. Brooks DJ, Sagar H, and the UK-Irish Entacapone Study Group. Entacapone is beneficial in both fluctuating and non-fluctuating patients with Parkinson’s disease: a randomised, placebo controlled, double blind, six month study. J Neurol Neurosurg Psychiatry 2003;74:1071–9.
4. Brooks DJ, Agid Y, Eggert K, et al. Treatment of end-of-dose wearing-off in Parkinson’s disease. Stalevo (levodopa/carbidopa/entacapone) and levodopa/DDCI given in combination with Comtess/Comtan (entacapone) provide equivalent improvements in symptom control superior to that of traditional levodopa/DDCI treatment. Eur Neurol 2005;53:197–202.
5. Ceravolo R, Piccini P, Bailey DL, et al. 18F-dopa-PET evidence that tolcapone acts as a central COMT inhibitor in Parkinson’s disease. Synapse 2002;43:201–7.
6. Factor SA, Molho ES, Feustel PJ, et al. Long-term comparative experience with tolcapone and entacapone in advanced Parkinson’s disease. Clin Neuropharmacol 2001;24:295–9.
7. Findley LJ, Lees A, Apajasalo M, et al. Cost-effectiveness of levodopa/carbidopa/entacapone (Stalevo) compared to standard care in UK Parkinson’s disease patients with wearing-off. Curr Med Res Opin 2005;21:1005–14.
8. Gerlach M, Ukai W, Ozawa H, Riederer P. Different modes of action of catecholamine-O-methyltransferase inhibitors entacapone and tolcapone on adenylyl cyclase activity in vitro. J Neural Transm 2002;109:789–95.
9. Gordin A, Kaakkola S, Teräväinen H. Clinical advantages of COMT inhibition with entacapone – a review. J Neural Transm 2004;111:1343–63.
10. Hauser RA. Levodopa/carbidopa/entacapone (Stalevo). Neurology 2004;62(Suppl 1):S64–71.
11. Jenner P. Avoidance of dyskinesia. Neurology 2004;62(Suppl 1):S47–55.
12. Jorga K, Fotteler B, Schmitt M, et al. The effect of COMT inhibition by tolcapone on tolerability and pharmakokinetics of different levodopa/benserazide formulations. Eur Neurol 1997;38:59–67.
13. Koller W, Lees A, Doder M, et al. Randomized trial of tolcapone versus pergolide as add-on to levodopa therapy in Parkinson’s disease patients with motor fluctuations. Mov Disord 2001;16:858–66.
14. Koller W, Guarnieri M, Hubble J, et al. An open-label evaluation of the tolerability and safety of Stalevo (carbidopa, levodopa and entacapone) in Parkinson’s disease patients experiencing wearing-off. J Neural Transm 2005;112:221–30.
15. Nutt JG, Woodward WR, Gancher ST, et al. 3-O-methyldopa and the response to levodopa in Parkinson’s disease. Ann Neurol 1987;21:584–8.
16. Nutt JG. Effects of catechol-O-methyltransferase (COMT) inhibition on the pharmacokinetics of L-dopa. Adv Neurol 1996;69:493–6.
17. Oechsner M, Buhmann C, Strauss J, Stürenburg HJ. COMT-inhibition increases serum levels of dihydroxyphenylacetic acid (DOPAC) in patients with advanced Parkinson’s disease. J Neural Transm 2002;109:69–75.
18. Offen D, Panet H, Galili-Mosberg R, Melamed E. Catechol-O-methyltransferase decreases levodopa toxicity in vitro. Clin Neuropharmacol 2001;24:27–30.
19. Olanow CW, Obeso JA. Pulsatile stimulation of dopamine receptors and levodopa-induced motor complications in Parkinson’s disease: implications for the early use of COMT inhibitors. Neurology 2000;55(Suppl 4):S78–81.
20. Olanow CW, Stocchi F. COMT inhibitors in Parkinson’s disease. Neurology 2004;62(Suppl 1):S72–81.
21. Parkinson Study Group. Entacapone improves motor fluctuation in Levodopa treated Parkinson’s disease patients. Ann Neurol 1997;42:747–55.
22. Poewe WH, Deuschl G, Gordin A, et al. Efficacy and safety of entacapone in Parkinson’s disease patients with suboptimal levodopa response: a 6-month randomised placebo-controlled double-blind study in Germany and Austria (Celomen study). Acta Neurol Scand 2002;105:245–55.
23. Rinne UK, Larsen JP, Siden A, et al. Entacapone enhances the response to levodopa in parkinsonian patients with motor fluctuations. Nomecomt Study Group. Neurology 1998;51:1309–14.
24. Schrag A. Entacapone in the treatment of Parkinson’s disease. Lancet Neurology 2005;4:366–70.
25. Silver DE. Clinical experience with the novel levodopa formulation entacapone + levodopa + carbidopa (Stalevo). Expert Rev Neurother 2004;4:589–99.
Prof. Dr. med. Wolfgang Jost, Fachbereich Neurologie, Deutsche Klinik für Diagnostik, Aukammallee 33, 65191 Wiesbaden, E-Mail: jost.neuro@dkd-wiesbaden.de
Triple combination in parkinsonian therapy
Bringing levodopa into use meant a breakthrough in the treatment of Parkinson’s disease, although this did not materialize until after the introduction of decarboxylase inhibitors, which prevented peripheral decarboxylation of dopamine. COMT is the second important peripheral degradative pathway apart from dopa-decarboxylase. Application of a COMT inhibitor will not only significantly reduce the peripheral degradation of levodopa; it also prevents the degradative product 3-OMD from passing the blood-brain barrier. Thus, it was just consequent to usher a product in that would not only work upon levodopa but also on both a decarboxylase- and COMT-inhibitor. Since the half-life period of the COMT-inhibitor entacapone is similar to that of levodopa, this agent had been chosen to create the preparation Stalevo®. The fact that patients don’t need to take that many tablets anymore is an advantage of the compound, as this enhances better compliance and reduces the risk of faulty application. It is still being debated at what point of the disease Stalevo® should be administered.
Keywords: Parkinson’s disease, decarboxylase inhibitors, COMT inhibitors, Stalevo®
Psychopharmakotherapie 2005; 12(06)
